电导法测定乙酸乙酯皂化反应的速率常数Word格式文档下载.docx
《电导法测定乙酸乙酯皂化反应的速率常数Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《电导法测定乙酸乙酯皂化反应的速率常数Word格式文档下载.docx(9页珍藏版)》请在冰豆网上搜索。
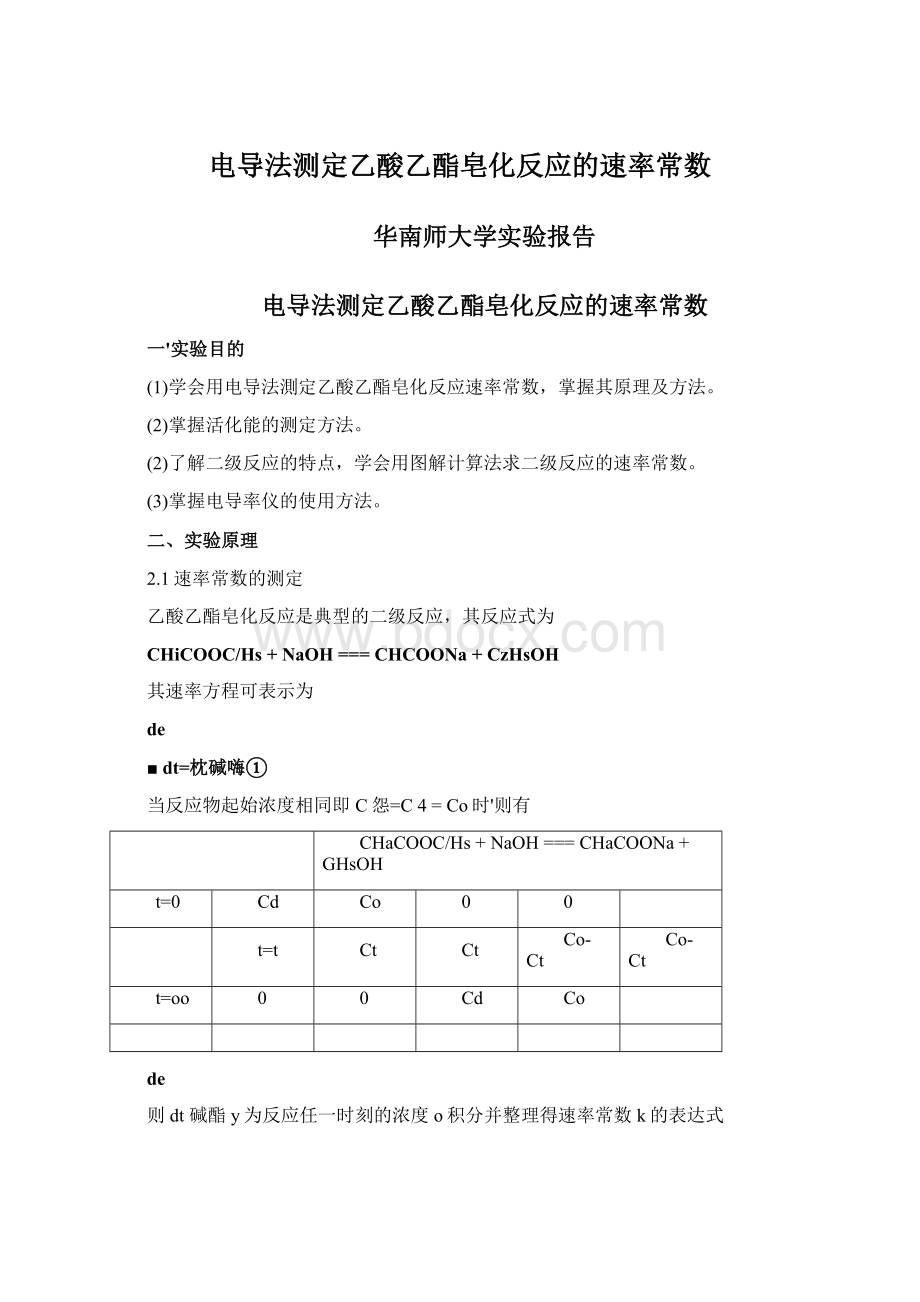
在反应过程中,Ct随时间变化而变化,不同反应的Ct可以用各种方法测量,本实验通过测定溶液电导率随时间的变化从而求出速率常数k。
假定此反应在稀溶液中进行,且CH<COONa全部电离。
则参加导电离子有Na*、OH、CHaCOO»
而曲反应前后不变,0H的迁移率比CILCOO大得多,随着反应的进行,0H不斷价绍,CH:
<COO不断增加,所以体系电导率不斷下降。
体系电导率(k)的下降和产物CHaCOO的浓度成正比。
另/O、I和兀3分别为0、t和*时刻的电导率'
则
t=t时♦co-Ct=K(/co-/c«
)K为比例常数
tfOO时,Cd=K(A;
o一兀8)
两式联立,整理得Ct=K(/Ct-/CJ
代入动力学方程②,并消去比例常数K得
进一步整理得
可见,即已知起始浓度C(「在恒温条件下,测得Ko和/C「并以/Ct对t
m
作图,可得一直线,则直线斜率为
加0>从而求得此温度下的反应速率常数
2.2活化能的测定原理
因此只要测定两个不同温度(T】、T?
)对应的速率常数ki和kz,根据式⑤可算出反应的表观活化能E“。
三、仪器与试剂
电导率仪
1台
大试管
5支
恒温槽
0.0200mol/L
NaOH
去离子水
钳黑电极
1支
lOOmL烧杯
3只
1OmL移液管
3支
0.0200mol/L
乙酸乙酯
四、实验步骤
(1)调节恒温槽温度在25°
C±
0.05°
C。
(2)安装调节好电导率仪。
(3)在卜3号三只大试管中,依次倒入约20吗L蒸饱水'
35inL0.0200mol/LNa0H和25mL0.0200mol/LCH:
)C00C2H5»
用塞子塞紧试管口,并置于恒温槽中恒温10min.
(4)zo的测定从1号和2号试管,分别准确移取IOiiiL蒸饱水和lOmLNaOH溶液注入4号大试管中摇匀,置于恒温槽中恒温,插入电导池,測定其电导率/u。
(5)I的测定从2号试管中准确移取1OmLNaOH注入5号试管中置于恒温槽中恒温,再从3号试管中准确移取lOmLCHlOOC屆也注入5号试管中,当注入5mL时启动秒表,用此时刻作为反应的起始时间»
加完全部酯后,迅速充分摇匀*并插入电导池。
测7U后该电导电极必须先用水洗再用滤纸擦干。
从计时起加in开始读/ct值,以后每加in读一次,至30min时可停止测量。
(6)反应活化能的測定
A-在35°
C恒温条件下,用与步骤⑤同样浓度的溶液及方法测I值。
B.由25°
C和35°
C时測得的数据求和切2,代入式⑤,从而求得反应的活化能氏。
五、数据记录与处理
kT
5.1求25°
C的反应速率常数‘1
表L相关数据说明
恒温温度
/Co
V乙瞰乙a
[乙酸乙酯]
[NaOH]
25.4°
C
2・15ms/cm
10.OOmL
表2.实验数据记录1
t/min
/ct/(ms/cm)
一/ct/(ms/cm)
(/Co-/Ct)/t
2
2.04
0.11
0.0550
4
1.95
0.20
0.0500
6
1.91
0.24
0.0400
8
1.85
0.30
0.0375
10
1.80
0.35
0.0350
12
1.77
0.38
0.0317
14
1.74
0.41
0.0293
16
1.72
0.43
0.0269
18
1.68
0.47
0.0261
20
0.0235
22
1.66
0.49
0.0223
24
1.65
0.50
0.0208
26
1.63
0.52
0.0200
28
1.59
0.56
图l.(K0-Kt)/t关系图
(K()-Kj/tms/(cm-min)
-/Ct)/t作图,舍去前6分钟的三个数据点,得图1•得出拟合曲
Kt=T-X
线的方程为y=12.83x+1.363,斜率为12.83。
根据式④%
1
则有kco=12.83.已知初始浓度co=O.Olmol/mL>求得25.4°
C时,速率常数
1=7.7942L-mol-min
5.2求25°
C的反应速率常数件2
表3.相关数据说明
34.9°
2.40ins/cm
表4.实验数据记录2
2.29
2.14
0.26
0.0650
2.09
0.31
0.0517
2.02
0.0475
1.98
0.42
0.0420
0.0408
1.86
0.54
0.0338
1.83
0.57
1.82
0.58
0.0290
1.79
0.61
0.0277
0.0254
1.75
0.65
0.0250
0.0232
图2.(Ko—Kt)/t~叫关系图
对(X。
-/c()/t作图,舍去前6分钟的三个数据点,得图2•得出拟合曲
1勺一耳
Kt=-—X+Kg
线的方程为y=ll.64x11.470,斜率为11.1964。
根据式④%t
则有屁0=11.64,已知初始浓度co=0.01mol/L,求得34.9°
C温度下,速率常数?
2=8.5911L-mol'
-inin'
°
5.3求乙酸乙酯皂化反应的表观活化能Ea
°
C时,速率常数^1=7.7942L-mol,-niin,,而在34.9°
厂2=8.5911L-niol'
-min1°
根据公式⑤
可求得乙酸乙酯皂化反应的表观活化能E产7.83kJ/mol
六、注意事项
(1)配置好的乙酸乙酯溶液要做好储存工作,以防挥发,影响实际浓度。
(2)配好的NaOH溶液要防止空气中的C02气体进入。
(3)电极每測定一次电导率,都要用去离子水冲洗,并用滤纸擦干再进行下一次测量。
(4)温度对反应速率及溶液电导率的影响颇为显著,应严格控制恒温。
七、分析与讨论
7.1误差分析
本次实验测定的实验结果为:
C时,反应速率常数/<
ri=7.7942L-mor*-niin,,
C时,反应速率常数灯2=&
sgilL-nior'
-min*-
乙酸乙酯皂化反应的表观活化能L=7.83kJ/mo1
与文献值相比:
25°
C时'
反应速率常数为6.4254L-mor,-min,,
35°
C时,反应速率常数为11.9411L・moL・min7,
乙酸乙酯皂化反应的表观活化能Ea=46.lkJ/mol
分析上述实验数据,实验值与文献值有一定的差距,特别是活化能,与文献值相差了将近7倍。
以下进一步分析实验过程中的误差来源:
(1)乙酸乙酯与氢氧化钠的浓度的准确性。
本实验中所用到的乙酸乙酯溶液和氢氣化钠溶液均为0.02inol/L,溶液为人工配制,移液管、容量瓶等量器的使用必然存在一定的系统误差。
(2)溶液配制完待用或者取用的过程,都有可能导致溶液浓度或者性质发生改变。
例如NaOH溶液容易吸收空气中的COz生成Na£
03,乙酸乙酯挥发性很强,取用过程中很容易发生挥发。
这些因素都会改变反应物的浓度,对电导率的测定产生影响。
(3)温度。
一般对于溶液来说,温度升高时电导率会增大。
故在反应过程中应保持体系处于恒温状态。
本实验中使用接触式温度计来调节恒温槽的温度,相对于数控的超级恒温槽来说,接触式温度计的反应存在一定的滞后性,这种方法使得恒温槽的水温波动较大。
7.2实验改进建议
乙酸乙酯皂化反应常数的测定一般会用到电导法。
目前来说,通常是采用乙酸乙酯和氢氧化钠初始浓度相等的条件下进行皂化反应的。
但是由于乙酸乙酯极易挥发,氢氧化钠又极易吸收空气中的CO?
发生化学变化,两者的浓度难以保持不变。
另外有一种方法是,采用了两种反应物初始浓度不相等的条件下进行皂化反应,即实验中不需要知道准确乙酸乙酯的初始浓度,只要求其初始浓度略低于氢氣化钠的浓度即可。
待皂化反应结束后,用酸度计測定该体系剩余的氢氧化钠浓度,就可以进行数据处理。
这样既节省了时间,又简化了实验步骤,使测量结果更准确。
八、提问与思考
&
1为何本实验要在恒温条件下进行,而乙酸乙酯和氢氧化钠溶液在混合前还要预先恒温?
因为速率常数受温度的影响很大,实验过程必须保持恒温。
而在乙酸乙酯与氢氧化钠混合前就将两种液体预先恒温,是为了保证两溶液在混合时已经处于同一温度,保证实验结果的准确性。
2为什么乙酸乙酯和氢氧化钠起始浓度必须相同,如果不同,试问怎么计算k值?
因为乙酸乙酯的皂化反应是二级反应,乙酸乙酯和氢氧化钠起始浓度相同时计算比较方便。
如果浓度不等,则要用到以下公式,计算相对麻烦。
11b(a-x)
k=4n—
ta_ba(b-x)
3有人提出用pH法测定乙酸乙酯皂化反应速率常数,此法可行吗,为什么?
乙酸乙酯皂化反应属二级反应,它是目前测量反应速率常数实验教学最常使用的例证。
该反应的反应方程为:
CH3COOC2H5+NaOH==CH3COONa+C2H5OH。
反应速率方程为:
v=dx/dt=k(a-x)(b-x),当初始浓度相同,即a=b时,对该式积分简化得:
k=x(ta)(a-x),设t时刻溶液的pH值为E(t),则此时溶液中OH的浓度为C.(0H)=10(pH-14),即a-x=10(pH-14),则[a-10(pH-14)]/[tx10(pH-14)]。
所以用a-10(pH-14)对txl0(pH-14)作图,可得到一条直线,该直线的斜率m=ka即k=m/a。
九、参考文献
[1]何广平,南俊民等.物理化学实验[M]:
化学工业,2007,106-10&
[2]易回阳,陆江林等.电导法测定皂化反应速率常数的影响因素[J].师学院学报(自然科学版),2001.21(4):
56-59.
[3]王晓菊,瑞战.电导法测定乙酸乙酯皂化反应速率常数的实验改进[J].师学院学报,1999,18(5):
25-26.
[4]邵水源,向荣等.pH值法测定乙酸乙酯皂化反应速率常数[J].科技学院学报‘2004.24
(2):
196-199.