高中化学选修三第二章第三节课时练习修订版DOCWord格式.docx
《高中化学选修三第二章第三节课时练习修订版DOCWord格式.docx》由会员分享,可在线阅读,更多相关《高中化学选修三第二章第三节课时练习修订版DOCWord格式.docx(20页珍藏版)》请在冰豆网上搜索。
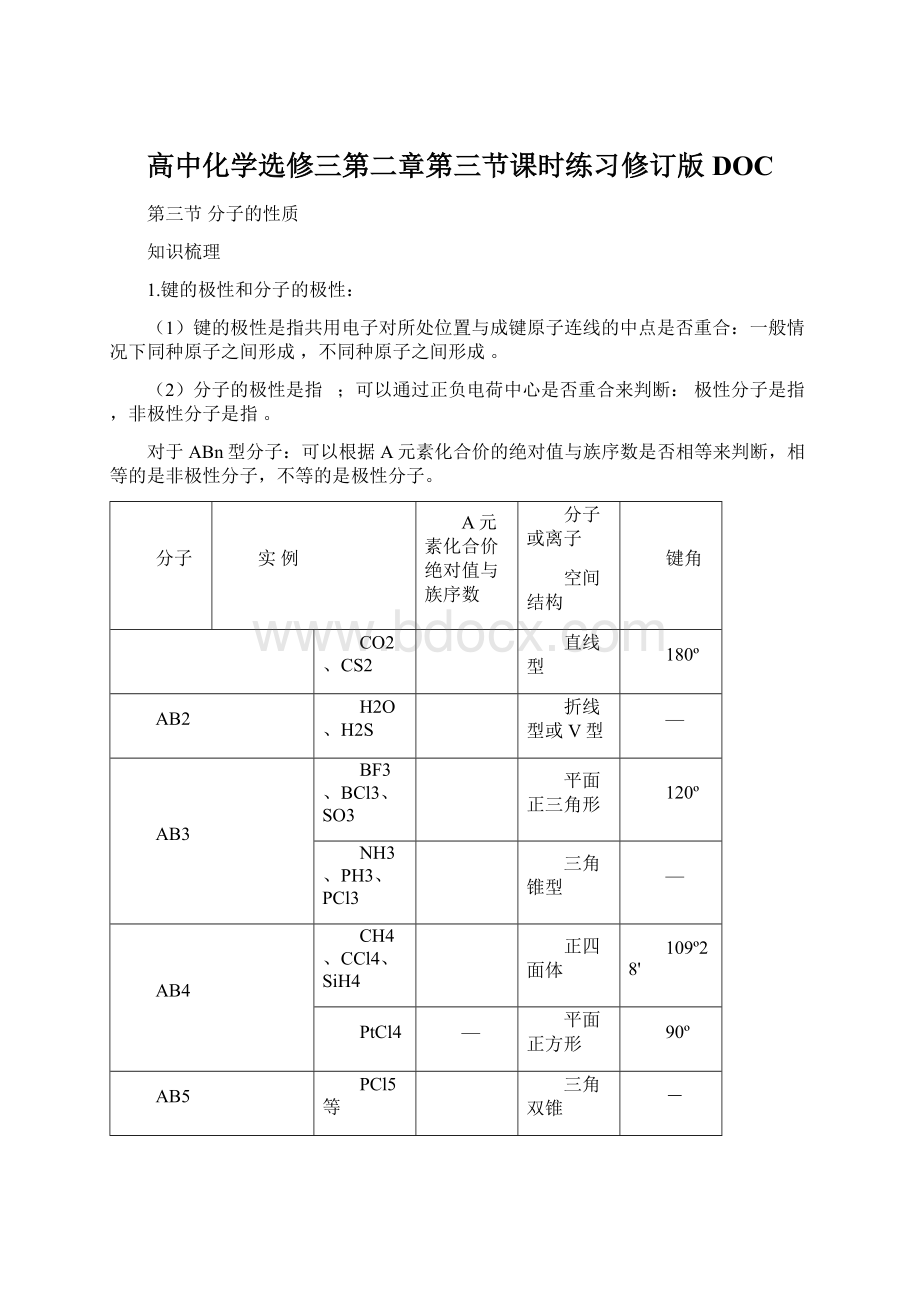
SF6等
正八面体
(3)键的极性和分子的极性的关系:
只含非极性键的分子是非极性分子(O3除外),只含极性键的分子是极性分子,极性分子中含有极性键。
2.范德华力及其对物质性质的影响:
范德华力是指,其强度比化学键。
一般来讲,具有组成和结构相似的分子,相对分子质量越大,范德华力越大,越高。
3.氢键及其对物质性质的影响:
(1)氢键是。
(2)氢键通常用表示。
(3)氢键可以存在于,也可存在于;
形成能使某些物质的熔、沸点升高。
4.物质的溶解性及其影响因素:
(1)分子极性:
相似相溶原理
(2)分子结构:
含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。
例如,乙醇与水能互溶;
戊醇与水不能互溶,但与己烷能互溶。
(3)氢键:
溶质与溶剂分子之间若能形成分子间氢键,则会增大溶解度。
(4)反应性:
溶质若能与溶剂发生反应,则会增大溶解度。
5.手性:
判断方法是:
。
6.无机含氧酸分子的酸性:
(1)一般地,无机含氧酸分子中能够电离成H+的H原子都是与O原子直接相连的(即羟基氢),不与O原子相连的H原子一般不能电离。
(2)大多数无机含氧酸的通式可以写成(HO)mROn的形式,非羟基氧的个数n越大,酸性越强。
①同一元素的不同价态含氧酸,R的价态越高,酸性越强。
②成酸元素R不同时,非羟基氧数n越大,酸性越强;
n相同,酸性相近。
思维导航
【例1】Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大。
请回答下列问题:
(1)请在以下空格内画出这两种固体分子的几何构型图:
淡黄色固体:
,黄绿色固体:
(2)淡黄色固体物质是由组成,黄绿色固体物质是由
组成(填“极性分子”或“非极性分子”)
(3)黄绿色固体在水中溶解度比淡黄色固体大,原因是。
【解析】可以类比确定甲烷的空间结构的方法来处理。
Pt(NH3)2Cl2如果是平面正方形,就有两种不同结构,如果是正四面体,就只有一种结构。
答案:
(1)
(2)非极性分子;
极性分子
(3)水分子是极性分子,而黄绿色固体的分子也是极性分子,根据相似相溶原理可知黄绿色固体在水中的溶解度应比淡黄色固体大
【例2】利用相关结构理论,画出平面型分子C2N2和N2F2的空间构型,并确定其极性。
分析:
先根据C、N、F原子的最外层单电子数画出它们的电子式:
再确定C和N的杂化形式:
C2N2分子中的C采用的是sp杂化,分子是线型结构
正负电荷中心重合,是非极性分子。
N2F2分子中的N采用的是sp2杂化,分子是平面三角型结构,有如下图A、B两种结构。
若为A,正负电荷中心重合是非极性分子,若为B,正负电荷中心不重合是极性分子。
【例3】含氧酸可表示为:
(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大其酸性越强。
一般情况下
n的取值
n=0
n=1
n=2
n=3
酸的相对强弱
弱酸
中强酸
强酸
超强酸
已知亚砷酸(H3AsO3)是弱酸,而亚磷酸是中强酸(H3PO3)
(1)写出两种酸的结构式:
、。
(2)亚磷酸是元酸,写出它和过量的NaOH反应的方程式.
(3)次磷酸是一种一元酸,化学式为H3PO2,它的结构为:
。
【解析】根据酸的相对强弱规律确定分子中非羟基氧的个数,根据成酸元素的价键确定其结构,根据—OH个数确定酸的元数。
(2)二
H3PO3+2NaOH=Na2HPO3+2H2O
(3)
例4某链烃B的分子式为C7H10,在B的各种结构(不考虑
结构)中,含有手性碳原子,且与足量的
发生加成反应后仍具有光学活性的有机物有五种,已知其中有两种的结构简式为:
①HC≡C—
CH=CH—
②
—C≡C—
CH=
则另三种结构简式为:
、、。
本题从C7H10与H2的反应产物C7H16着手:
首先在一个碳原子上按从简单到复杂的顺序。
连接以下三个原子或者原子团。
即:
—H、—CH3、—CH2CH3,剩下的3个碳原子可以构成正丙基和异丙基—CH2CH2CH3,
分子的结构简式为
若为Ⅰ式,出现双键或者三键的位置只有下列四种情况
a
b
c
⑴
C≡C
C=C
⑵
⑶
⑷
若为Ⅱ,在e出只能出现C=C,在d出只能出现C≡C。
对照题目给出的结构简式是上表中的⑴和⑵。
另外三种是:
课时训练
第一课时(键的极性和分子的极性)
基础练习
1.下列说法中不正确的是()
A.共价化合物中不可能含有离子键B.有共价键的化合物,不一定是共价化合物
C.离子化合物中可能存在共价键D.原子以极性键结合的分子,肯定是极性分子
2.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型。
下列分子属于非极性分子的是()
A.HCNB.CO2C.BCl3D.CH3Cl
3.下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移的是()
A.BeCl2B.COCl2C.PCl5D.N2
4.下列对极性分子和非极性分子的认识正确的是()
A.只含非极性键的分子一定是非极性分子B.含有极性键的分子一定是极性分子
C.非极性分子一定含有非极性键D.极性分子一定含有极性键
5.下列四种分子中,只含极性键而没有非极性键的是()
A.CH4B.C2H6C.C2H4D.H2O2
6.下列物质中不含非极性共价键的是()
①Na2O2②CCl4③FeS2④NH4F⑤C2H2⑥NaOH
A.①②③④B.④⑤⑥C.②④⑥D.②③⑤
7.下列反应中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是()
A.NH4Cl
NH3↑+HCl↑
B.
Na2CO3+CO2+H2O=2NaHCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
8.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。
下列叙述中不正确的是()
A.WZ2分子中所有原子最外层都为8电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X<
W<
Y<
Z
9.下列物质中含有非极性键的化合物是()
A.CaCl2B.CO2C.N2D.Na2O2
10.试填写下表:
空间构型
分子的极性
AlCl3
CO2
H2O
BF3
NH3
CCl4
SO3
11.已知H2O2的分子空间结构可在二面角中表示,如右图所示。
在有关H2O2结构的说法中正确的是()
A.分子的正、负电荷中心重合B.分子的正、负电荷中心不重合
C.H2O2是极性分子D.H2O2是非极性分子
12.根据下列要求,各用电子式表示一实例:
(1)只含有极性键并有一对孤对电子的分子
(2)只含有离子键、极性共价键的物质
(3)只含有极性共价键、常温下为液态的非极性分子
13.二氯乙烯的同分异构体有非极性分子和极性分子两种,其中属于极性分子的结构简式是;
属于非极性分子的结构简式是。
14.短周期元素D、E、X、Y、Z原子序数逐渐增大。
它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。
回答下列问题:
(1)Y的最高价氧化物的化学式为;
Z的核外电子排布式是 。
(2)D的最高价氧化物与E的一种氧化物为等电子体,写出E的氧化物的化学式 。
(3)D和Y形成的化合物,其分子的空间构型为 ,D原子的轨道杂化方式是 。
X与Z构成物质的晶体类型为 晶体。
(4)写出一个验证Y与Z的非金属性强弱的离子反应方程式 ;
(5)金属镁和E的单质在高温下反应得到的产物与水反应生成两种碱性物质,该反应的化学方程式是;
能力提升
1.据2001年11月17日网易报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制出了新型氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,下列有关O4的说法不正确的是()
A.O4与O3、O2都是氧的同素异形体
B.合成O4的反应可看做核聚变反应,即不属于化学反应
C.O4分子内存在极性共价键
D.O4的能量比普通氧分子高,将来可用做火箭燃料的更强有力的氧化剂
2.NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。
根据上述实例可推出ABn型分子是非极性分子的经验规律是()
A.分子中不能含有氢原子
B.在ABn分子中A原子没有孤对电子
C.在ABn分子中A的相对原子质量小于B的相对原子质量
D.分子中每个共价键的键长应相等
3.把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏转的是()
A.CCl4B.C2H5OHC.CS2D.CH2Cl2
4.下列分子中,属于含有极性键的非极性分子的一组是()
A.SO3、CCl4、CO2B.C2H4、C2H2、C6H6
C.Cl2、H2、N2D.NH3、H2O、SO2
5.有下列物质:
①O2②CO2③NH3④Na2O⑤Na2O2⑥NaOH⑦CaBr2⑧H2O2⑨NH4Cl⑩HBr回答下列问题:
⑴只含有极性键的是;
⑵只含有非极性键的是;
⑶含有极性键和非极性键的是;
⑷只含有离子键的离子化合物是;
⑸含有非极性键的离子化合物是;
⑹含有极性键的离子化合物是;
⑺含键的类型最多的是。
6.已知化合物B4F4中每个硼原子结合一个氟原子,且任意两个硼原子间的距离相等,试画出B4F4的空间构型,并分析该分子的极性。
7.在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。
极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。
分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·
q。
试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是;
(2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,3种分子的偶极矩由大到小的排列顺序是:
(3)实验测得:
μ(PF3)=1.03、μ(BCl3)=0。
由此可知,PF3分子是构型,BC13分子
是构型。
8.现有A、B、C三种物质,A为气态氢化物,分子式为RH3,含R为82.4%;
B是另一气态氢化物,A+B→C,C与碱液共热放出A。
C的水溶液加入稀HNO3酸化后,滴入AgNO3溶液产生不溶性的白色沉淀,回答下列问题:
⑴写出A的名称和电子式,并指出它是否是极性分子?
其稳定性比PH3、H2O如何?
⑵写出B的结构式,并比较其与HF、HBr的稳定性,其水溶液与HF、HBr水溶液的酸性强弱。
⑶写出C的电子式,并指明C物质中所含有的化学键。
⑷写出上述有关的化学方程式或离子方程式。
第二课时(范德华力、氢键及其对物质性质的影响)
1.下列各组物质的晶体中,化学键类型相同,熔化时所克服的作用力也完全相同的是()
A.CO2和SiO2B.NaCl和HClC.(NH4)2CO3和CO(NH2)2D.NaH和KCl
2.你认为下列说法不正确的是()
A.氢键存在于分子之间,不存在于分子之内
B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C.NH3极易溶于水而CH4难溶于水的原因是NH3是极性分子,CH4是非极性分子
D.冰熔化时只破坏分子间作用力
3.沸腾时只需克服范德华力的液体物质是()
A.水B.酒精C.溴D.水银
4.下列物质中分子间能形成氢键的是()
A.N2B.HBrC.NH3D.H2S
5.关于氢键,下列说法正确的是()
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
6.下列氢键中最强的是()
A.O—H…OB.N—H…NC.F—H…FD.F—H…N
7.下列气体最难液化的是()
A.H2B.O2C.N2D.Cl2
8.右图为冰晶体的结构模型,大球代表O原子,小球代表H原子。
下列有关说法正确的是()
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H-O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
9.硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。
A.硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
10.下列物质的变化,破坏的主要是分子间力的是()
A.碘单质的升华B.NaCl溶于水 C.将水加热变为气态D.NH4Cl受热分解
11.2007年9月,美国科学家宣称:
普通盐水在无线电波照射下可燃烧,这伟大的发现,有望解决用水作
人类能源的重大问题。
无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,
氢原子就会在该种频率下持续燃烧。
上述中“结合力”实质是()
A.分子间作用力B.氢键C.非极性共价键D.极性共价键
12.环己基氨基酸钙[
-NH-SO3]2Ca2+约比蔗糖甜30倍,曾广泛用于食品中,但近年来发现它能致癌而禁止使用。
下列溶剂中不能溶解该化合物是()
A.H2O
B.CH3OH
C.NH3(液)
D.CCl4
13.①下列物质中,哪些能形成分子内氢键,哪些能形成分子间氢键?
(填序号)
A.B.
C.D.
能形成分子内氢键的有;
只能形成分子间氢键有
②二聚甲酸解聚反应为:
(HCOOH)2→2HCOOH,该反应需吸收60kJ.mol-1的能量,此能量是
断开所需的能量,所以此键的键能为kJ.mol-1。
1.碘的熔点和沸点较低,其原因是()
A.碘的非金属性较弱B.碘分子中I-I键能较小
C.碘晶体中分子间范德华力较弱D.碘分子中I-I键长较长
2.不存在氢键的是()
A.纯H2O中的H2O分子之间B.液态HF中的HF分子之间
C.NH3·
H2O分子中的NH3与H2O之间D.可燃冰CH4·
nH2O中的CH4与H2O之间
3.SiH4的沸点比CH4高,其主要原因为()
A.SiH4分子间的范德华力比CH4强B.SiH4是极性分子,CH4是非极性分子
C.SiH4分子内的共价键比CH4强D.SiH4分子间会产生氢键,CH4则不会
4.下列物质中能够形成分子内氢键的是()
A.NH3B.邻羟基苯甲醛
C.对羟基苯甲酸D.CH3CH2OH
5.对于HCl、HBr、HI,随着相对分子质量的增大而增强的是()
A.共价键的极性B.氢化物的稳定性C.范德华力D.共价键的键能
6.下列物质中,按沸点降低次序排列的一组是()
A.CI4、CBr4、CCl4、CF4B.O2、S、Se、Te
C.H2O、H2S、H2Se、H2TeD.F2、Cl2、Br2、I2
7.下图中A、B、C、D四条曲线分别表示ⅣA、
ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表
示ⅥA族元素气态氢化沸点的是曲线表示;
ⅣA族元素气态氢化物沸点的是曲线;
同一
族中第3、4、5周期元素的气态氢化物沸点依次升高,
其原因是。
A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于
第3周期元素气态氢化物的沸点其原因是。
如果把这些氢化物分子间存在的主要影响沸点的相互作用表示
为A-H…A,则A元素一般具有的特点是
。
8.
现已知O3分子为V字形结构,据理推断O3应为(极性或非极性)分子,O3在水中的溶解度比O2要(大或小)得多,其主要原因。
乙醇和甲醚互为同分异构体,但前者沸点(78.5℃)远比后者(-23℃)高,常温下乙醇为液态,甲醚为气体。
原因是。
9.一定压强和温度下,取两份等体积氟化氢气体,在35℃和90℃时分别测得其摩尔质量分别为40.0g/mol和20.0g/mol。
(1)35℃氟化氢气体的化学式为___________________。
(2)不同温度下摩尔质量不同的可能原因是________________________________________。
10.水是生命之源,它与我们的生活密切相关。
在化学实验和科学研究中,水也是一种常用的试剂。
(1)写出与H2O分子互为等电子体的微粒 。
(写一个即可)
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。
下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),
已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华
力(11kJ/mol),则冰晶体中氢键的“键能”是kJ/mol(此时的气
态水不含氢键)。
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合离子。
请写出生成此配合离子的离子方程式:
。
11.现有A、B两有机物,结构简式如下图所示,、
A可通过分子内氢键形成了一个六元环,而B只能通过分子间氢键缔合。
若用“”表示硝基、用“…”表示氢键,
画出A分子形成分子内氢键时的结构____。
A、B分别溶于水,的溶解度稍大些。
(填A或B)
工业上用水蒸气蒸馏法分离A、B的混合物,则首先被蒸出的成分是(填A或B)。
12.2008年9月13日中央电视台报导了三鹿集团在牛奶中添加三聚氰胺使全国1200多名婴幼儿患上肾结石的“三鹿奶粉重大安全事故”,国务院立即启动国家重大食品安全事故I级响应。
就下列网上查得的有关三聚氰胺的物理物质资料回答问题:
三聚氰胺性状为纯白色原子晶体。
有难闻的气味,密度1.573克/厘米3(16℃)。
常压下为熔点354℃(分解),快速加热升华,升华温度为300℃。
难溶于水,
易溶于醚、苯和四氯化碳,可溶于甲醇、乙酸、热乙二醇等。
(1)三聚氰胺为三个氰胺分子加聚而成如右图所示的环状物,则三聚氰胺的
分子式为_______________,分子中含氮的质量分数为________________;
(2)已知氰胺分子中除H原子外,C、N原子的最外层均达8个电子的结构,则氰胺的电子式为
_______________,结构式为__________________。
(3)和相对分子质量相近的硝基苯比较
(无色或微黄色具苦杏仁味的油状液体。
相对质量为分子量
123.11。
熔点5.7℃。
沸点210.9℃)。
三聚氰胺的熔点特殊的高,基原因是
____________________________________________________________。
(4)上述有关三聚氰胺的物理性质叙述中有四处明显错误。
请找出错误之处,同时在错误处下面画上横
线,并根据你已有的知识把错误之处加以改正后填写在下列空格内
①_________________②___________________③___________________④___________________;
第三课时(溶解性、手性分子和无机含氧酸分子的酸性)
1.下列现象不能用“相似相溶”规律解释的是()
A.氯化氢易溶于水B.氯气易溶于NaOH溶液
C.碘易溶于CCl4D.碘难溶于水
2.根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说法正确的是()
A.溴、碘单质和四氯化碳中都含有卤素B.溴、碘是单质,四氯化碳是化合物
C.
、
是非极性分子,
也是非极性分子,而水是极性分子D.以上说法都不对
3.根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是()
A.乙烯B.二氧化碳C.二氧化硫D.氢气
4.下列氯元素含氧酸酸性最强的是()
A.HClO B.HClO2C.HClO3D.HClO4
5.下列物质中溶解度最小的是()
A.LiFB.NaFC.KFD.CsF
6.已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示
。
一般而言,该式中m大的是强酸,m小的是弱酸。
下列各含氧酸中酸性最强的是()
A.HBrO4B.
C.
D.
7.下列说法不正确的是()
A.互为手性异构体的分子互为镜像B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体分子组成相同D.手性异构体性质相同
8.下列化合物中含有2个手性碳原子的