仿制药质量和疗效一致性评价品种生产情况信息表.docx
《仿制药质量和疗效一致性评价品种生产情况信息表.docx》由会员分享,可在线阅读,更多相关《仿制药质量和疗效一致性评价品种生产情况信息表.docx(3页珍藏版)》请在冰豆网上搜索。
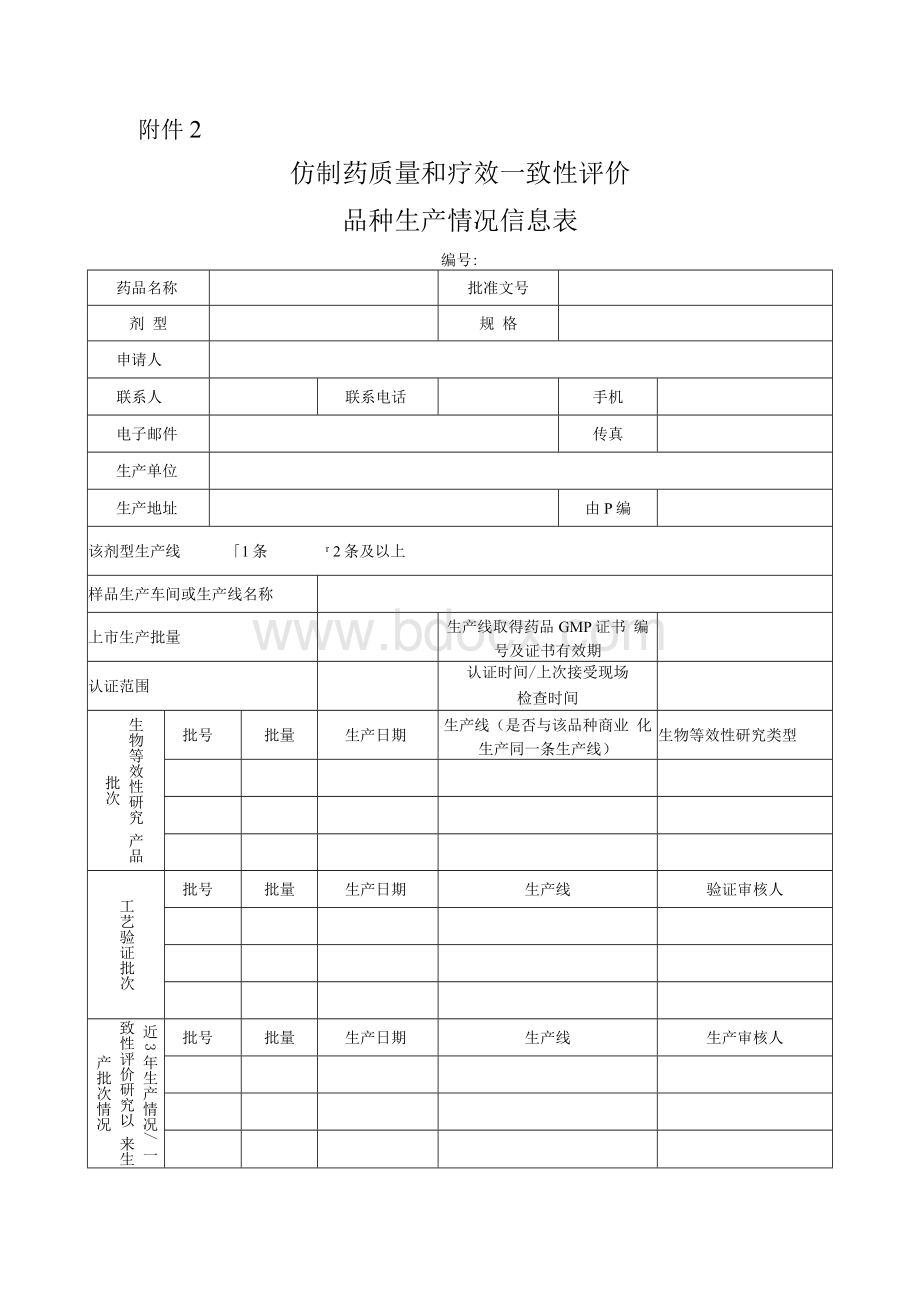
附件2
仿制药质量和疗效一致性评价
品种生产情况信息表
编号:
药品名称
批准文号
剂型
规格
申请人
联系人
联系电话
手机
电子邮件
传真
生产单位
生产地址
由P编
该剂型生产线 「1条 r2条及以上
样品生产车间或生产线名称
上市生产批量
生产线取得药品GMP证书编号及证书有效期
认证范围
认证时间/上次接受现场
检查时间
生物等效性研究产品批次
批号
批量
生产日期
生产线(是否与该品种商业化生产同一条生产线)
生物等效性研究类型
工艺验证批次
批号
批量
生产日期
生产线
验证审核人
近3年生产情况/一致性评价研究以来生产批次情况
批号
批量
生产日期
生产线
生产审核人
品种生产所用设施设备情况
设备名称
型号
购买时间
安放位置
原辅料情况
名称
规格
标准
生产单位
批准文号/核准的编码
用途
包装材料情况
名称
规格
标准
生产单位
批准文号/
核准的编码
该生产线生产的其他品种情况
药品名称
规格
批准文号
批量
生产频率
(批/年、批/季度、批/
月)
生产人员登记表
姓名
部门
所在岗位
附件
声明
接受现场检查的药品批量生产的处方及工艺与注册核准的/本次申报的批量、处方、工艺、原辅料标准和来源、设施设备等一致。
申请人对申报资料和数据的真实性负责。
(申请人公章)
年月日
注:
本表一式四份,其中三份原件,国家食品药品监督管理总局受理中心存一份原件,其余报送国家食品药品监督管理总局药品审评中心,药品审评中心根据立卷审查提出有因检查后,将该表原件一份转核查中心供现场检查用。
填表说明
1. 上市生产批量栏,如存在多个批量的情况,均应写明。
不同批量如使用的设备不同应在设施设备栏注明。
2. 生产线取得药品GMP证书有效期应填xx年xx月xx日至XX年XX月XX日。
3. 近3年生产情况适用于未发生处方工艺变更的品种;有处方工艺变更的品种应填写一致性评价研究以来的所有生产批次情况。
因工艺验证批相关情况有专门栏填写,故该栏填写的批次不含工艺验证批。
4. 原辅料情况及包装材料栏中批准文号/核准的编码如填写的为批准文号,应填写相应注册证的有效期,有效期的描述方式为XX年XX月XX日至XX年XX月XX日。
5. 原辅料情况中用途栏应填写:
原料药、助流剂、润滑剂等
6.生产频率栏应按品种实际生产频率进行选择多少批/年、多少批/季度、多少批/月。