饮用水氯离子检测文献Word文档下载推荐.docx
《饮用水氯离子检测文献Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《饮用水氯离子检测文献Word文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
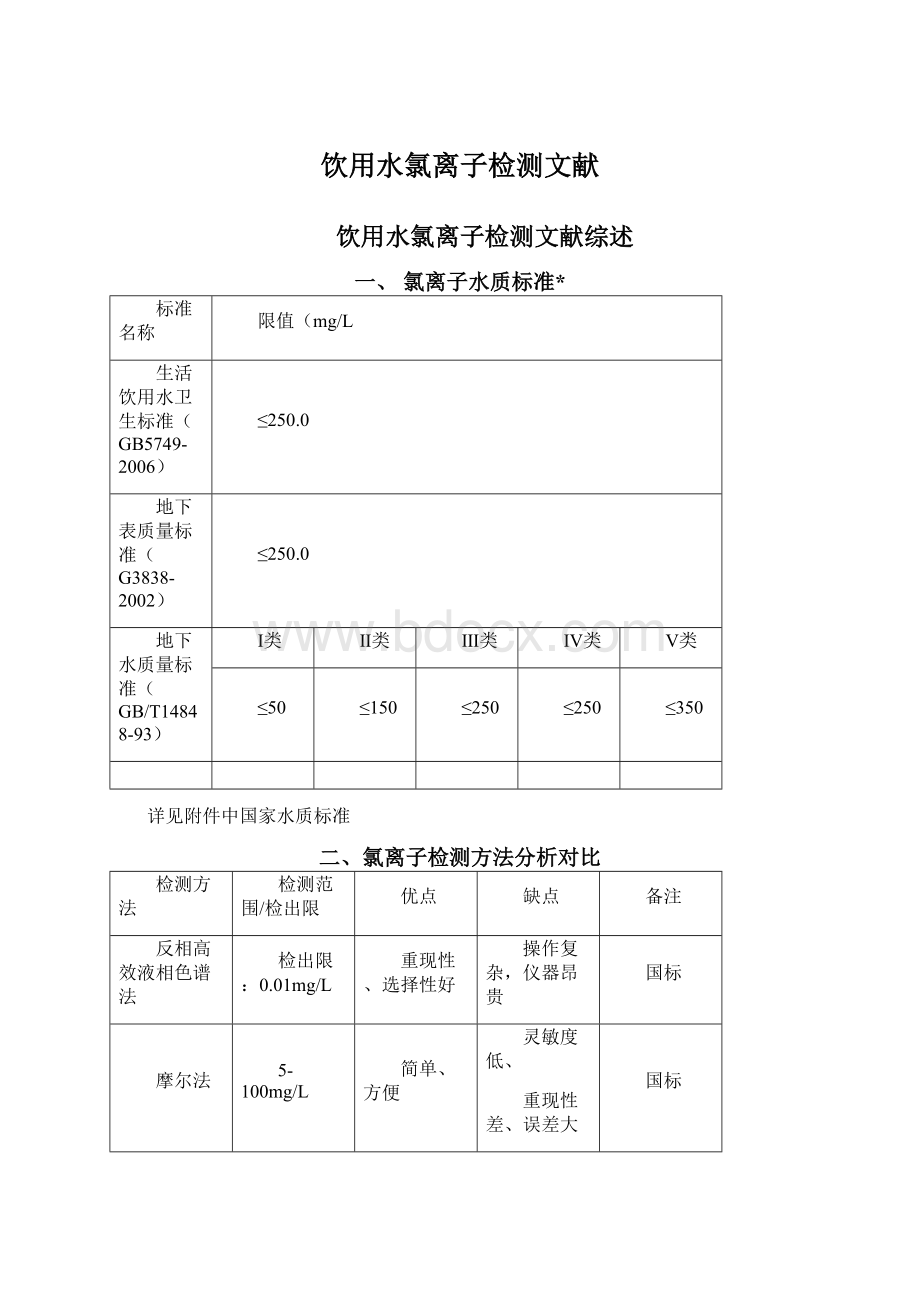
5-100mg/L
简单、方便
灵敏度低、
重现性差、误差大
电位滴定法
简捷方便,工作效率高
灵敏度低、误差大
汞盐滴定法
1-100mg/L
共沉淀富集分光光度法
10-100ug/L
灵敏度高,选择性好
操作复杂麻烦
比浊法
0-6mg/L
操作简便、分析时间短,分析科学广泛应用。
涉及化学操作
离子交换色谱法
0.1-20mg/L
简单方便,灵敏度高,测量快速而准确
仪器昂贵
原子吸收法
1-30mg/L
较高的灵敏度、很好的重现性、较高的准确度和操作简单
间接测量
自动注射法(FIA)
检测下限:
100ug/L
自动化程度高,分析速度快
极谱法
0-5mg/L
0.18ug/g
快速稳定
IC法
从以上的分析比较来看,国标方法大都灵敏度较低;
共沉淀富集痕量检测方法,可以有效提升检测精度,但操作复杂;
比浊法、原子吸收法都属于利用特征吸收波长间接测量氯离子;
离子交换色谱法灵敏度高,测量快速准确;
自动注射法自动检测分析溶液,可制作在线监测仪器;
极谱法属于伏安法中一种,灵敏度高,快速准确。
对于我们将要检测的饮用水(氯离子限值≤250.0),所有方法都能达到要求,相较而言可以采用比浊法或者原子吸收法和自动注射法联用;
也可研究采用极谱法检测。
三、氯离子检测方法分析
1.反相高效液相色谱法
GB/T5009.1672003《饮用天然矿泉水中氟、氯、溴离子和硝酸根、硫酸根含量的反相高效液相色谱法测定》
本标准适用于饮用天然矿泉水中氟、氯溴离子和硝酸根、硫酸根含量的测定,本方法检出限为:
F-0.01mg/L,Br-0.01mg/L,Cl-0.01mg/L,NO3-0.025mg/L,SO4-20.025mg/L。
检测机理
吸附色谱的作用机制认为溶质在固定相上的保留主要是疏水作用,在高效液相色谱中又被称为疏溶剂作用。
根据疏溶剂理论,当溶质分子进入极性流动相后,即占据流动相中相应的空间,而排挤一部分溶剂分子。
当溶质分子被流动相推动与同定相接触时,溶质分子的非极性部分或非极性因子会将非极性间定相上附着的溶剂膜排挤开,而直接与非极性固定相上的烷基官能团相结合(吸附)形成缔合络合物,构成单分子吸附层。
当流动相极性减少时,这种疏溶剂斥力下降,会发生解缔,并将溶质分子解放而被洗脱下来。
在此检测系统中,试样中阴离子保留时间固定不变,利用试样阴离子的这种特征可进行定性分析。
同时试样中阴离子的质量浓度与负信号的高度(或峰面积)成正比,利用这种关系可进行定量分析。
色谱图的记录
在正常情况下,由于阴离子不具备生色团,故不能用紫外检测器进行检测,但当流动相中加人邻苯二甲酸时则能产生高的背景吸收。
当无吸收的阴离子试样通过检测器流通池时,吸收的降低导致一负的色谱信号,该信号可以由记录数据极性的改变而反转。
下图为所记录的色谱图,根据保留时间确定离子的种类,出峰顺序为.F-、Cl-、Br-、NO3-、SO4-2
2.摩尔法
GB6905.1-1986《锅炉用水和冷却水分析方法氯化物的测定——摩尔法》
本标准适用于天然水、锅炉(以软化水作补给水)炉水和冷却水中氯化物的测定。
氯化物(以氯离子计)测定范围:
5-100mg/L。
在中性至弱碱性范围内(pH6.5~10.5),以铬酸钾为指示剂,用硝酸银滴定氯化物时,由于氯化银的溶解度小子铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀,产生砖红色,指示滴定终点到达。
该沉淀滴定的反应如下:
允差
水样中氯化物不同含量时的允差如下表所示。
mg/L
氯化物含量
室内允许差T2
室外允许差Y2
标准允许差B2
5.0~10.0
10.1~20.0
20.1~50.0
50.1~100.0
0.5
0.7
1.0
1.6
1.4
1.7
2.4
3.7
0.3
3.电位滴定法
GB6905.2-1986《锅炉用水和冷却水分析方法氯化物的测定——电位滴定法》
以双液型饱和甘汞电极为参比电极,以银电极为指示电极,水样用硝酸银标准液滴定至氯离子浓度与银离子浓度相等(即理论终点时),两电极的电位差可作为终点电位,滴定至该电位时即停止滴定。
从硝酸银标准液消耗体积可算出氯离子含量。
溴、碘、硫等离子存在有干扰。
终点电位的确定
在之前之言的基础上,确定较小范围,逐次准确加人硝酸银溶液,读下其相应毫伏值,并按表格式进行记录和计算(当水温变化±
2.5C时,要相应地重新确定终点电位)。
表中△V为硝酸银每次体积读数的增量,△E为两次体积读数相应的电位之差。
加入硝酸银的体积
ml
E
mV
△E/△V
mV/0.1ml
△2E/△V2
mV/(0.1ml)2
5.40
5.50
5.60
5.70
5.80
5.90
6.00
247
251
258
27
290
298
300
4
7
12
20
8
2
3
5
-12
-6
从表数据可看出,因△2E/△V2=0时即为滴定终点,顾滴定终点在△2E/△V2=8和-12之间,即滴定体积在5.7~5.8ml之间。
滴定电位在270~290mV之间。
终点体积和终点电位的计算方法如下:
终点体积(ml):
终点电位(mV):
0.6
0.9
1.2
0.25
4.汞盐滴定法
GB6905.3-1986《锅炉用水和冷却水分析方法氯化物的测定——汞盐滴定法》
本标准适用于天然水、锅炉(以软化水作补给水)炉水和冷却水中氯化物的测定。
1-100mg/L,超过100mg/L时,可适当地减少取样体积,稀释至100ml后测定。
在pH2.3--2.8的水溶液中,氯离子(Cl-)与汞离子(Hg2+)反应,生成微解离的氯化汞。
过量的汞离子与二苯卡巴腙(二苯偶氯碳酰肼)形成紫色络合物指示终点,可用汞盐滴定水样中氯化物含量。
指示剂中加澳酚蓝、二甲苯蓝-FF混合液作背景色可提高指示剂的灵敏度。
铁(Ш)、铬酸根、亚硫酸根、联氨等对测定有一定干扰,可加适量的对苯二酚或过氧化氢消除干扰。
1.0~10.0
0.4
1.3
0.2
5.共沉淀富集分光光度法
GB6905.4-1986《锅炉用水和冷却水分析方法氯化物的测定——共沉淀富集分光光度法》
本标准规定了痕量氯化物测定的共沉淀富集分光光度法。
本标准适用于除盐水、给水、蒸汽水、凝结水和以除盐水为补给水的炉水等水样的氯化物的测定。
测定范围:
10~100ug/L。
本方法基于磷酸铅沉淀做载体,共沉淀富集痕量氯化物,经高速离心机分离后,以硝酸铁——高氯酸溶液完全溶解沉淀,加硫氰酸汞——甲醇溶液显色,用分光光度法间接测定水中痕量氯化物。
ug/L
≤10.0
20.1~30.0
30.1~50.0
6.2
6.4
6.6
7.2
8.4
10.4
11.4
12.4
14.4
19.4
3.1
3.2
3.3
3.6
4.2
6.比浊法
比浊法是在比色法的基础上发展起来的,是根据测量光线通过悬浮液后透射光的强度进行分析的一种分析方法。
应用
陈振华等研究了在表面活性剂下用硝酸银浊度法测定Cl-。
结果表明,在0.3mol/L酸性条件下,吐温-60作为AgCl浊度的稳定剂,该方法的线性范围为0~8ug/mL,相关系数r=0.991,回收率为87.75%~103.33%,可用于发电厂炉水中Cl-的测定。
王爱荣等研究了以乙二醇为增溶剂,硝酸银作沉淀剂,采用氯化银比浊法,在不分离硫酸铜的条件下,直接测定酸性镀铜液中微量氯离子。
测定波长为440nm,线形范围为0~2ug/mL,其表观摩尔吸光系数
=113×
105,方法检出限为0.035ug/mL,该法用于测定酸性镀铜液中微量氯离子在不同水平的加标回收率为95.4%~104.5%。
申海燕利用氯化银沉淀在明胶一乙醇水溶液中的稳定性,建立了一种测定有机工艺水中微量氯离子的浊度法。
该法的线性范围为0~6mg/L,r=0.9993,回收率为95.2%~101.3%。
7.离子交换色谱法
以离子交换树脂作固定相,在流动相带着试样通过离子交换树脂时,由于不同的离子与固定相具有不同的亲合力而获得分离的色谱法。
张新申等利用离子色谱仪对制革生产中的浸酸废液、铬蹂废液、污水中的氯离子含量进行了测定。
测定结果的氯离子浓度在10-5M~10-2M范围内有很好的线性关系,其测量上限为10-2M,仪器性能指标的下限达Ppb数量级,回收率为98.6%%~102.5%
宋晓年等采用预浓缩离子色谱法(采用浓缩柱预先浓缩样品然后进来)测定高纯度水中痕量氯离子,实验后得出线性回归方程为H=0.429C-0.596C,式中H一测得氯离子的峰高;
C一氯离子含量,线性相关系数r=0.9985标准曲线有很好的线性关系,可监测高纯去离子水中10-9mg/L级氯离子。
8.原子吸收法
原子吸收是基于被测物质的原子蒸气对特定谱线的吸收作用来进行定量分析的一种方法。
钱初洪等用原子吸收法间接测定了己二酸铵中的微量氯离子,此法通过加入乙醇和雾化增效剂,使AgCl的溶解度降低并提高了原子化效率,从而使测定的灵敏度提高,利用AgNO3与己二酸铵中的微量氯离子反应,测定剩余Ag+间接求出氯离子的含量,测定的相对标准偏差1.9%、4.8%,灵敏度(1%A)为0.022mg/L。
袁志莉等研究了在酸性环境中,氯离子与银离子生成沉淀,经氨水溶解后,用火焰原子吸收法测定银,从而间接测定出氯离子的含量。
本方法测定氯的线性范围为.0~30ug/mL,相关系数r=0.999,灵敏度为0.023ug/mL(1%),检测下限为0.059ug/mL,回收率为95%~105%。
9.流动注射法
自动分析方法中,基于流动注射分析(FlowInjectionAnalysis,FIA)技术的居多。
FIA分光光度法是基于Cl-从Hg(SCN)2中置换出的SCN-与Fe3+
形成血红色配合物的反应原理:
该流程分为2个流路,超纯水作载流,显色试剂(硫氰酸汞+硝酸铁+硝酸+乙醇)由另一路导入。
测定时,试样注入载流中并与显色剂汇流、反应,生成物通过带有2.0cm光程流通池的721分光光度计检测,同时,记录下对应的曲线。
该方法的检出限为0.02mg/L,RSD<
0.89%,回收率为100%~105%,分析速度为60~120样/h。
10.极谱法
极谱法的基本装置见图。
极化电极(滴汞电极)通常和极化电压负端相连,参比电极(甘汞电极)和极化电压正端相连。
当施加于两电极上的外加直流电压达到足以使被测电活性物质在滴汞电极上还原的分解电压之前,通过电解池的电流一直很小(此微小电流称为残余电流),达到分解电压时,被测物质开始在滴汞电极上还原,产生极谱电流,此后极谱电流随外加电压增高而急剧增大,并逐渐达到极限值(极限电流),不再随外加电压增高而增大。
这样得到的电流-电压曲线,称为极谱波。
极谱波的半波电位E1/2是被测物质的特征值,可用来进行定性分析。
扩散电流依赖于被测物质从溶液本体向滴汞电极表面扩散的速度,其大小由溶液中被测物质的浓度决定,据此可进行定量分析。
赵桂荣等提出用氯离子本身在选定的极谱底液中,当交流示波极谱图上呈现一灵敏切口时,用AgNO3标准溶液滴定至切口消失,以示终点的方法。
周俊明等提出了HCOOH(质量分数为0.1%)/百里香酚兰(质量分数为0.008%)/HClO4(浓度为0.4mol/L)/TritonX-100(质量分数为0.4%)极谱法测定痕量氯离子的体系,检出限为0.18ug/g。
四、附件:
相关知识点
1.液相色谱法
液相色谱法的分离机理是基于混合物中各组分对两相亲和力的差别。
根据固定相的不同,液相色谱分为液固色谱、液液色谱和键合相色谱。
应用最广的是以硅胶为填料的液固色谱和以微硅胶为基质的键合相色谱。
根据固定相的形式,液相色谱法可以分为柱色谱法、纸色谱法及薄层色谱法。
按吸附力可分为吸附色谱、分配色谱、离子交换色谱和凝胶渗透色谱。
近年来,在液相柱色谱系统中加上高压液流系统,使流动相在高压下快速流动,以提高分离效果,因此出现了高效(又称高压)液相色谱法。
根据固定相和流动相相对极性的强弱,可将液向色谱法分为正相色谱法和反相色谱法。
反相色谱法即反相高效液相色谱。
在正相色谱法中,固定相的极性大于流动相的极性,适用于分离油溶性或水溶性的极性和强极性化合物。
在反相色谱法中,固定相的极性小于流动相的极性,适用于分离非极性、极性或离子型化合物,其应用范围也比正相色谱法更广泛。
2.生色团
生色团是指分子中含有的,能对光辐射产生吸收、具有跃迁的不饱和基团。
某些有机化合物分子中存在含有不饱和键的基团,能够在紫外及可见光区域内(200~800nm)产生吸收,且吸收系数较大,这种吸收具有波长选择性,吸收某种波长(颜色)的光,而不吸收另外波长(颜色)的光,从而使物质显现颜色,所以称为生色团。
3.背景吸收
原子吸收光谱分析时,在原子化过程中生成的分子以及火焰气体对光源辐射的吸收,还有散射光的干扰等形成背景吸收。
来自原子化器的一种光谱干扰,即未被解离的气态分子的吸收和未能被原子化的固体微粒对光的散射而发生相互作用后的一种综合吸收即背景吸收。
当待测元素的分析谱线与分子蒸汽吸收光谱线重叠时,待测元素的吸收就异乎寻常地增高,该现象就是所谓“分子吸收”,分子吸收主要来自原子化过程中生成气态分子对辐射的吸收,这种吸收基本上可以分为两类:
金属卤化物、氧化物、氢氧化物,以及硫酸、磷酸分子对辐射的吸收,这种吸收是宽波长范围的吸收。
这类分子吸收的大小依赖于产生分子吸收物质的浓度,浓度越大,分子吸收越强;
火焰气体成份对辐射的吸收,火焰气体燃烧时,主要成份有N2、OH、CO2、CN、C2\CH2等均出现分子吸收干扰。
4.共沉淀
一种沉淀物从溶液中析出时,引起某些可溶性物质一起沉淀的现象。
共沉淀(coprecipitation),一种沉淀从溶液中析出时,引起某些可溶性物质一起沉淀的现象。
例如,用氯化钡沉淀硫酸钡时,若溶液中有K+、Fe3+存在,在沉淀条件下本来是可溶性的硫酸钾和硫酸铁,也会有一小部分被硫酸钡沉淀夹带下来,作为杂质混在主沉淀中。
产生共沉淀的原因有:
①表面吸附,由于沉淀表面的离子电荷未达到平衡,它们的残余电荷吸引了溶液中带相反电荷的离子。
②包藏,在沉淀过程中,如果沉淀剂较浓又加入过快,则沉淀颗粒表面吸附的杂质离子来不及被主沉淀的晶格离子取代,就被后来沉积上来的离子所覆盖,于是杂质离子就有可能陷入沉淀的内部,这种现象称为包藏。
③生成混晶,如果晶形沉淀晶格中的阴、阳离子被具有相同电荷的、离子半径相近的其他离子所取代,就形成混晶。
5.比浊法
悬浮颗粒在液体中造成透射光的减弱,减弱的程度与悬浮颗粒的量相关,据此可定量测定物质在溶液中呈悬浮状态时浓度的方法。
当光束通过一含有悬浮质点的介质时,由于悬浮质点对光的散射作用和选择性的吸收,使透射光的强度减弱。
在比浊法中,透光度和悬浮物质浓度的关系类似于朗伯-比尔定律(见紫外-可见分光光度法)的数学式:
式中s为浊光度(或浊率),表示由于悬浮物的散射作用而引起的光强度衰减;
I0和I分别为入射光强度(通过纯溶剂)和透射光强度(通过混浊样品);
b为光程长度;
c为悬浮质点的浓度;
K为常数,有时又叫浊度系数,其值与粒子的大小、形状、入射光的波长、悬浮物和介质的折射率有关。
在分析时,必须先做工作曲线,以s对已知散射物的浓度c作图。
显然,比浊法和比色法所依据的原理是相同的,实验方法也相似。
通常,比色计或分光光度计都可用于比浊分析。
也有专门用于比浊分析的仪器,即浊度计或比浊计。
6.离子交换色谱
以离子交换剂(如聚苯乙烯基质离子交换树脂)作固定相,基于流动相中溶质(样品)离子和固定相表面离子交换基团之间的离子交换作用而达到溶质保留和分离的离子色谱法。
将改进后的电导检测器安装在离子交换树脂柱的后面,以连续检测色谱分离的离子的方法。
分离机理除电场相互作用(离子交换)外,还常常包括非离子性吸附等次要保留作用。
其固定相主要是聚苯乙烯和多孔硅胶作基质的离子交换剂。
离子交换色谱法最适合无机离子的分离,是无机阴离子的最理想的分析方法。
离子色谱主要用于测定各种离子的含量,特别适于测定水溶液中低浓度的阴离子,例如饮用水水质分析,高纯水的离子分析,矿泉水、雨水、各种废水和电厂水的分析,纸浆和漂白液的分析,食品分析,生物体液(尿和血等)中的离子测定,以及钢铁工业、环境保护等方面的应用。
离子色谱能测定下列类型的离子:
有机阴离子、碱金属、碱土金属、重金属、稀土离子和有机酸,以及胺和铵盐等。
7.极谱法
极谱法(polarography)通过测定电解过程中所得到的极化电极的电流-电位(或电位-时间)曲线来确定溶液中被测物质浓度的一类电化学分析方法。
于1922年由捷克化学家J.海洛夫斯基建立。
极谱法和伏安法的区别在于极化电极的不同。
极谱法是使用滴汞电极或其他表面能够周期性更新的液体电极为极化电极;
伏安法是使用表面静止的液体或固体电极为极化电极。
分类
极谱法分为控制电位极谱法和控制电流极谱法两大类。
在控制电位极谱法中,电极电位是被控制的激发信号,电流是被测定的响应信号。
在控制电流极谱法中,电流是被控制的激发信号,电极电位是被测定的响应信号。
控制电位极谱法包括直流极谱法、交流极谱法、单扫描极谱法、方波极谱法、脉冲极谱法等。
控制电流极谱法有示波极谱法。
此外还有极谱催化波、溶出伏安法。
直流极谱法
又称恒电位极谱法。
通过测定电解过程中得到电流-电位曲线来确定溶液中被测成分的浓度。
其特点是电极电位改变的速率很慢。
它是一种广泛应用的快速分析方法,适用于测定能在电极上还原或氧化的物质。
交流极谱法
将一个小振幅(几到几十毫伏)的低频正弦电压叠加在直流极谱的直流电压上面,通过测量电解池的支流电流得到交流极谱波,峰电位等于直流极谱的半波电位E1/2,峰电流Ip与被测物质浓度成正比。
单扫描极谱法
在一个汞滴生长的后期,其面积基本保持恒定的时候,在电解池两电极上快速施加一脉冲电压,同时用示波器观察在一个滴汞上所产生的电流~电压曲线。
方波极谱法
在通常的缓慢改变的直流电压上面,叠加上一个低频率小振幅(≤50mV)的方形波电压,并在方波电压改变方向前的一瞬间记录通过电解池的交流电流成分。
方波极谱波呈峰形,峰电位Ep和直流极谱的E1/2相同,峰电流与被测物质浓度成正比。
脉冲极谱法
在汞滴生长到一定面积时在直流电压上面叠加一小振幅(10~100mV)的脉冲方波电压并在方波后期测量脉冲电压所产生的电流。
依脉冲方波电压施加方式不同,脉冲极谱法分为示差脉冲极谱和常规脉冲极谱。
前者是直流线性扫描电压上叠加一个等幅方波脉冲,得到的极谱波呈峰形,后者施加的方波脉冲幅度是随时间线性增加的,得到的每个脉冲的电流-电压曲线与直流极谱的电流-电压曲线相似。
用途
极谱法可用来测定大多数金属离子、许多阴离子和有机化合物(如羰基、硝基、亚硝基化合物,过氧化物、环氧化物,硫醇和共轭双键化合物等)。
此外,在电化学、界面化学、络合物化学和生物化学等方面都有着广泛的应用。