必修2 第六章 第二节化学反应的速率与限度1Word文档格式.docx
《必修2 第六章 第二节化学反应的速率与限度1Word文档格式.docx》由会员分享,可在线阅读,更多相关《必修2 第六章 第二节化学反应的速率与限度1Word文档格式.docx(13页珍藏版)》请在冰豆网上搜索。
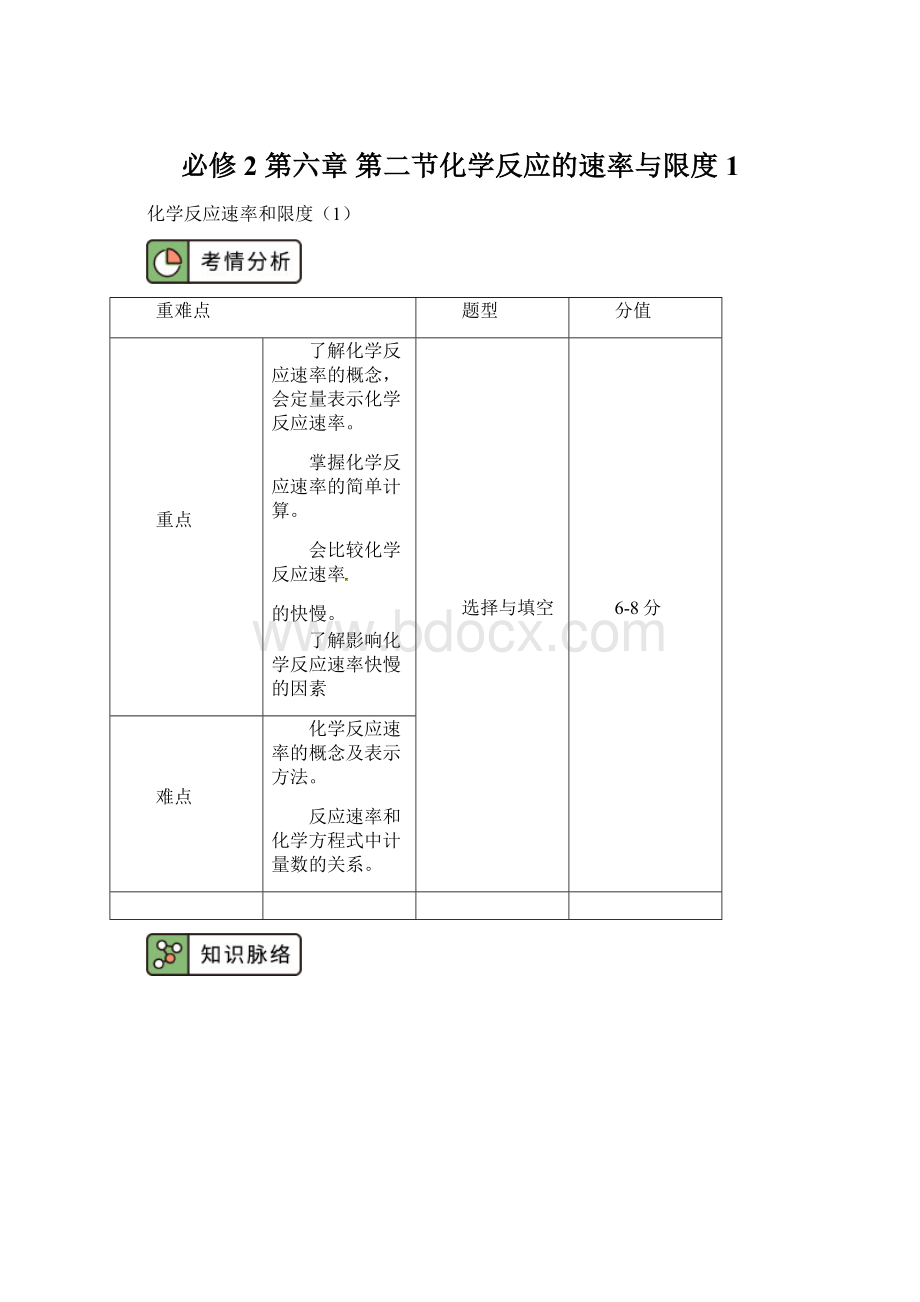
min-1、mol·
h-1。
4.意义
化学反应速率是用来衡量化学反应进行快慢程度的物理量,同一化学反应用不同的物质来表示化学反应速率时,其数值可能不同,但这些数值所表示的意义相同。
5.规律
对于同一反应,用不同的物质来表示反应速率,其比值一定等于化学方程式中相应的化学计量数之比。
如对于反应:
mA(g)+nB(g)⇄pC(g)+qD(g),v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
【思考】
对于反应C(s)+H2O(g)
CO(g)+H2(g),能否用C和H2O来表示该反应的化学反应速率?
【提示】该反应的化学反应速率不能用C表示,可以用H2O(g)表示,固体或纯液体的浓度可视为常数,因此不用固体或纯液体表示化学反应速率。
若反应中水为气体,可以用来表示反应速率,若水为溶剂,则不能用水表示反应速率。
二、化学反应速率的计算与比较
1.化学反应速率的计算方法
(1)定义式法:
根据v(A)=
计算。
(2)化学计量数法:
根据同一化学反应不同物质的速率之比等于化学方程式中的化学计量数之比计算。
(3)“三段式”法
计算原理:
化学反应速率之比=浓度变化量之比=物质的量变化量之比=化学计量数之比
计算模式:
设A、B两种物质的起始浓度分别为amol•L-1、bmol•L-1,反应物A的浓度为mxmol•L-1,反应物B的浓度的变化量为nxmol•L-1则:
2.化学反应速率快慢的比较
(1)定性比较
通过明显的实验现象(如反应的剧烈程度、产生气泡或沉淀的快慢等)来定性判断化学反应速率的快慢。
(2)定量比较
同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,还要进行一定的转化:
归一法:
换算成同一物质、同一单位表示,再比较数值大小。
比值法:
比较化学反应速率与化学计量数的比值。
如反应aA+bB
cC,要比较v(A)与v(B)的相对大小,即比较
与
的相对大小,若
>
,则用v(A)表示的反应速率比用v(B)表示的反应速率大。
核心知识点二:
一、影响化学反应速率的因素
1.内因:
化学反应速率的大小主要取决于反应物本身的性质。
2.外因
(1)温度对化学反应速率影响的探究
实验操作
试管中均为2~3mL相同浓度的滴有FeCl3溶液的H2O2溶液
实验现象
①产生气泡速率最慢
②产生气泡速率较快
③产生气泡速率最快
实验结论
对于反应2H2O2
2H2O+O2↑来说,温度越高,H2O2的分解速率越快,反应越快
(2)浓度对化学反应速率的影响
反应原理:
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
实验编号
加入0.1mol/LNa2S2O3溶液的体积/mL
加入水的体积/mL
加入0.1mol/LH2SO4溶液的体积/mL
出现浑浊的快慢
1
2
快
慢
实验结论:
增加反应物浓度,化学反应速率加快。
(3)压强对化学反应速率的影响
对于气体来说,在相同条件下,压强越大,一定质量气体的体积越小,单位体积内气体的分子数越多。
增加压强(减小容器容积)相当于增大反应物的浓度,化学反应速率增加;
减小压强(增大容器容积)相当于减小反应物的浓度,化学反应速率减小。
(4)催化剂对化学反应速率影响的探究
①有少量气泡出现
②产生大量气泡
③产生大量气泡
MnO2、FeCl3可以使H2O2分解的速率加快
影响化学反应速率的因素除温度和催化剂外,还有反应物的状态、固体表面积、溶剂、光照等许多因素。
人们可以通过这些因素来调控化学反应速率。
【提示】
1.浓度
(1)只适用于有气体参加或在溶液中进行的化学反应。
(2)在一定温度下,固体或纯液态物质的浓度是一个常数,改变其用量,对化学反应速率无影响。
(3)化学反应速率与固体颗粒的大小有关,颗粒越小,表面积越大,化学反应速率越大。
2.温度
(1)对任何化学反应都适用,且不受反应物状态的影响。
(2)不论是吸热反应还是放热反应,升高温度都能增大化学反应速率,降低温度都能减小化学反应速率。
3.压强
(1)压强对化学反应速率的影响实质是通过改变浓度对化学反应速率的影响实现的。
(2)由于固体或液体的体积受压强的影响很小,所以压强只影响有气体参加的化学反应的反应速率。
(3)改变压强必须引起反应物或生成物的浓度改变才能改变化学反应速率,否则,化学反应速率不变。
(4)压强改变的常见方式
①恒温恒容:
充入稀有气体→容器压强增大→各反应物的浓度不变→化学反应速率不变。
②恒温恒压:
充入稀有气体→容器体积增大→各反应物的浓度减小→化学反应速率减小。
③恒温:
缩小容器体积→容器压强增大→反应物浓度增大→化学反应速率增大。
④恒温恒容:
充入一种反应物→增大反应物浓度→化学反应速率增大。
4.催化剂
(1)催化剂参与化学反应,但其化学性质在反应前后保持不变。
(2)催化剂只有在适宜的温度下才能最大限度地显示其催化作用,不同的催化剂所需要的适宜温度不一定相同。
(3)使用催化剂,可逆反应的正、逆反应速率增大的倍数相同。
对于反应CaCO3+2H+=CO2↑+H2O+Ca2+,能否用增加CaCO3的量加快该反应速率?
(不考虑接触面的变化)
否,因为CaCO3为固体,其物质的量浓度视为常数,增加固体物质的量不影响其浓度,化学反应速率不变。
反应:
3A(g)+B(g)
2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为
①v(A)=0.6mol·
min-1
②v(B)=0.45mol·
③v(C)=0.015mol·
④v(D)=0.45mol·
则此反应在不同条件下进行最快的是( )
A.②③ B.①③
C.②④ D.②
【答案】D
【解析】化学反应速率之比等于化学反应方程式中的化学计量数之比,即v(A)∶v(B)∶v(C)∶v(D)=3∶1∶2∶2,则用A表示的化学反应速率分别为①v(A)=0.6mol·
min-1;
②中v(A)=3v(B)=0.45mol·
min-1×
3=1.35mol·
③中v(A)=
v(C)=
×
0.015mol·
min-1=0.0225mol·
④中v(A)=
v(D)=
0.45mol·
min-1=0.675mol·
min-1,所以在不同条件下,进行最快的是②,D项正确。
将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内反应的平均反应速率为___________________________________;
(2)反应前A的物质的量浓度是______________________________________________;
(3)10s末,生成物D的浓度为_____________________________________________;
【答案】
(1)0.04mol·
s-1。
(2)1.5mol·
(3)0.4mol·
【解析】3A(g)+B(g)
2C(g)+2D(g)
初始物质的量/mol 3.0 1.0 0 0
转化物质的量/mol1.20.40.80.8
10s末物质的量/mol1.80.60.80.8
(1)v(C)=
=0.04mol·
(2)c(A)=
=1.5mol·
(3)c(D)=
=0.4mol·
1.将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是()
①使煤充分燃烧,提高煤的利用率②减少SO2的产生,避免造成“酸雨”③减少有毒气体CO的产生,避免污染空气④减少CO2的产生,避免引起“温室效应”
A.①②③
B.②③④
C.①③④
D.①②③④
【答案】A
【解析】①将煤块粉碎,增大与空气的接触面积,能使煤充分燃烧,提高煤的利用率,正确;
②煤中含有硫元素,燃烧时能生成SO2,经脱硫处理可减少SO2的产生,避免造成酸雨,正确;
③在适当过量的空气中燃烧,生成CO2,减少CO的产生,正确;
④题中叙述不能减少CO2的产生,错误。
2.在温度不变的条件下,在恒容密闭容器中进行下列反应:
N2O4(g)
2NO2(g)。
若N2O4的浓度由0.1mol·
L-1降到0.07mol·
L-1需要15s,那么N2O4的浓度由0.07mol·
L-1降到0.05mol·
L-1所需的反应时间( )
A.等于5sB.等于10s
C.大于10sD.小于10s
【答案】C
【解析】N2O4的浓度变化0.03mol·
L-1需要15s,N2O4的浓度由0.07mol·
L-1,N2O4的浓度变化为0.02mol·
L-1,若反应速率不变,则所需时间为
=10s,但随着反应物浓度的减小,反应速率逐渐减小,故所需时间大于10s,C项正确。
3.把在空气中久置的铝片5.0g投入盛有500mL0.5mol·
L-1硫酸的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示。
回答下列问题:
(1)曲线从O→a段不产生氢气的原因是,有关反应的化学方程式为_____________;
(2)曲线从b→c段,产生氢气的速率增加较快的主要原因是____________________;
(3)曲线从c以后,产生氢气的速率逐渐下降的主要原因是_____________________。
(1)硫酸首先和氧化铝反应,不产生H2
Al2O3+3H2O=Al2(SO4)3+3H2O
(2)反应放热,温度是影响反应速率的主要因素,升温使反应速率增大
(3)随着反应的进行,硫酸的浓度逐渐减小,浓度成为影响化学反应速率的主要因素,化学反应速率逐渐减小
【解析】
(1)在空气中久置的铝片表面有氧化铝薄膜,硫酸首先和氧化铝反应,所以O→a段不产生H2。
(2)b→c段,虽然硫酸的浓度减小,但该反应是放热反应,反应进行中体系温度逐渐升高,化学反应速率逐渐加快。
(3)曲线从c以后,硫酸的浓度减小,浓度成为影响化学反应速率的主要因素,故反应速率逐渐下降。
(答题时间:
25分钟)
一、选择题:
1.下列关于化学反应速率的说法不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.在同一个反应中,各物质的反应速率之比等于反应方程式中对应物质的化学计量数之比
D.化学反应速率的常用单位有mol·
s-1和mol·
2.把下列选项中四种X溶液分别加入四个盛有相同温度的10mL2mol·
L-1盐酸的烧杯中,均加水稀释到100mL。
此时,X与盐酸缓缓地进行反应,其中反应速率最大的是( )
A.10℃20mL3mol·
L-1的X溶液
B.20℃30mL2mol·
C.20℃10mL4mol·
D.10℃20mL2mol·
3.在2L密闭容器中,发生以下反应:
2A(g)+B(g)
2C(g)+D(g)。
若最初加入的A和B都是4mol,在前10sA的平均反应速率为0.12mol·
s-1,则10s时,容器中B的物质的量是( )
A.1.6molB.2.8mol
C.2.4molD.1.2mol
4.在一密闭容器中充入1molH2(g)和1molI2(g),压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)⇄2HI(g)。
下列说法正确的是( )
A.保持容器容积不变,向其中加入1molI2(g),化学反应速率不变
B.保持容器容积不变,向其中加入1molHe,化学反应速率加快
C.保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
D.保持容器内气体压强不变,向其中加入1molHe,化学反应速率不变
5.一定能使化学反应速率加快的因素是( )
①扩大容器容积 ②使用正催化剂 ③增大反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大压强
A.②③B.②③④⑥
C.②③④⑤D.②④
6.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
A.反应开始到10s时,用Z表示的反应速率为0.158mol·
s-1
B.反应开始到10s时,X的物质的量浓度减少了0.79mol·
L-1
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)
Z(g)
7.对于反应4NH3+5O2
4NO+6H2O,下列为4种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A.v(NH3)=0.2mol·
L-1·
s-1
B.v(O2)=14mol·
min-1
C.v(H2O)=0.25mol·
D.v(NO)=9mol·
1.【答案】B
【解析】化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示,B项错误。
2.【答案】B
【解析】温度越高,反应速率越大;
浓度越大,反应速率越大。
由于溶液体积均为100mL,则X物质的量越大,浓度越大。
3.【答案】B
【解析】根据化学反应速率之比等于对应物质的化学计量数之比,可得v(B)=0.5v(A)=0.5×
0.12mol·
s-1=0.06mol·
s-1,则Δc(B)=0.06mol·
s-1×
10s=0.6mol·
L-1,Δn(B)=0.6mol·
L-1×
2L=1.2mol,故10s时容器中B的物质的量为4mol-1.2mol=2.8mol。
4.【答案】C
【解析】保持容器容积不变,向其中加入1molI2(g),反应物浓度增大,反应速率加快,A错误;
保持容器容积不变,向其中加入1molHe,参加反应的物质的浓度不变,则反应速率不变,B错误;
保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),因物质的量增大1倍,体积也增大1倍,则浓度不变,反应速率不变,C正确;
保持容器内气体压强不变,向其中加入1molHe,体积增大,参加反应的物质的浓度减小,则反应速率减慢,D错误。
5.【答案】D
【解析】①对于有气体参加的反应,扩大容器容积,会使物质的浓度降低,反应速率减慢,但对无气体参加的反应没有影响,错误;
②使用正催化剂,一定能使化学反应速率加快,正确;
③若反应物是固体或纯液体物质,则增大反应物的物质的量,化学反应速率不变,错误;
④升高温度一定能使化学反应速率加快,正确;
⑤对于有气体参加的反应,缩小容器容积,会导致气体的浓度增大,化学反应速率加快,但对无气体参加的反应没有影响,错误;
⑥若反应无气体参加,则增大压强,化学反应速率不变,错误。
综上所述,符合题意的为②④,D正确。
6.【答案】C
【解析】反应开始到10s时,用Z表示的反应速率为
=0.079mol·
s-1,故A错误;
反应开始到10s时,X的物质的量浓度减少了
=0.395mol·
L-1,故B错误;
反应开始到10s时,Y的转化率为
100%=79.0%。
故C正确;
由图像可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到10s时.Δn(X)=0.79mol,Δn(Y)=0.79mol,Δn(Z)=1.58mol,则Δn(X)∶Δn(Y)∶Δn(Z)=1∶1∶2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的化学方程式为X(g)+Y(g)2Z(g),故D错误。
7.【答案】A
【解析】首先,统一单位,A项v(NH3)=0.2mol·
s-1=12mol·
min-1,C项v(H2O)=0.25mol·
s-1=15mol·
min-1;
其次,物质的化学反应速率与其化学计量数之比越大,则该物质表示的化学反应速率就越大,A、B、C、D四个选项中该比值分别是12÷
4=3,14÷
5=2.8,15÷
6=2.5,9÷
4=2.25,故选A。