鲁科版化学必修1《元素与物质的分类》1Word下载.docx
《鲁科版化学必修1《元素与物质的分类》1Word下载.docx》由会员分享,可在线阅读,更多相关《鲁科版化学必修1《元素与物质的分类》1Word下载.docx(13页珍藏版)》请在冰豆网上搜索。
(二)过程与方法:
探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义
。
(三)情感态度与价值观:
体会分类的重要意义,依据不同的标准对物质进行分类;
让学生树立运用化学知识,使自己生活得更健康。
四.教学准备
(一)学生准备
要求学生复习初中化学中单质、氧化物、酸、碱、盐之间的关系,复习第一章第二节研究物质性质的方法和程序,为学习本节教材做准备。
(二)教师准备
教学媒体及课件;
概念图;
实验探究的药品及仪器。
第1课时
【板书】第1节元素与物质的分类
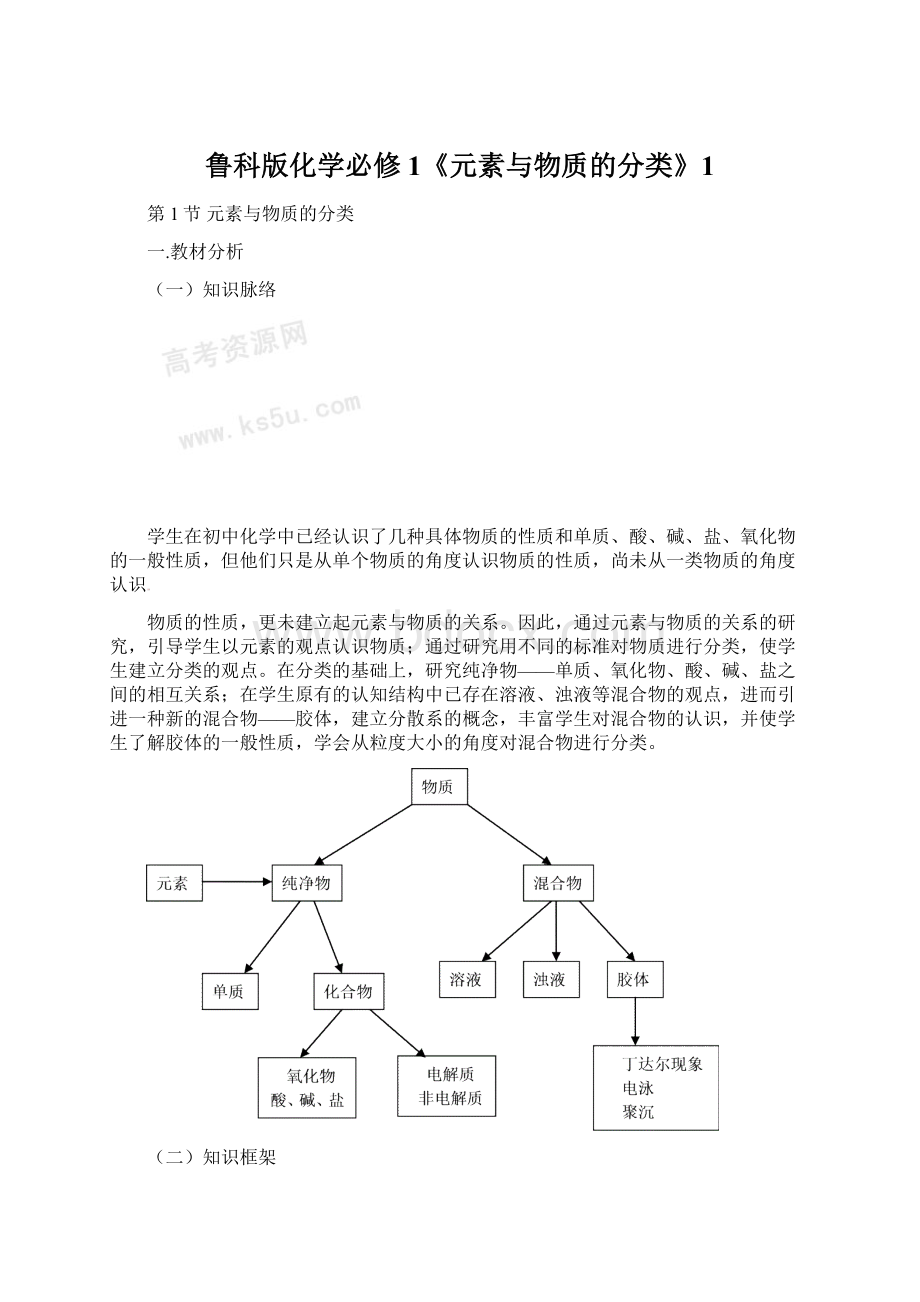
【板书】一.元素与物质的分类
1.联想·
质疑(提出本节教材的核心问题)
(1)110多种元素是如何构成几千万种物质的?
(2)为了更好地研究物质的性质和用途,应怎样对物质进行分类?
用什么样的标准分类?
(3)各类物质之间具有怎样的关系?
2.交流·
研讨(引发学生对于物质与元素之间的已有认识。
通过对熟悉物质的组成元素的分析,逐渐建立起元素与物质的关系。
)
【问题1】
(P30)找出组成元素;
由已找出的元素重新组合成新的物质。
合作学习的实施:
针对课本P30的2个问题,以四人一个小组的形式进
行交流活动,教师下发给学生交流讨论的记录表,按照元素
的化合价规则(正价在前,负价在后)各自填写这些熟悉物质中的元素还能组成物质的化学式(书中已有的化学式不再重写):
(1)若只由一种元素组成,请写出其化学式。
这一类物质属于单质还是属于化合物?
(2)若由两种元素组成化合物,先在下面的两个表格中将能形成化合物的元素画上连线,并请写出其化学式(开展个人和小组比赛,看谁写得又多又准确)。
正价元素
Na(+1)
Mg(+2)
Cu(+1、+2)
Ca(+2)
C(+2、+4)
H(+1)
S(+4、+6)
(3)若由三种元素组成化合物,请写出其化学式。
【问题2】
(P30)含碳物质的研究。
教师要引导学生找出含碳物质中的组成元素,研究含有0、+2、+4的碳元素的物质。
负价
元素
O(—2)
Cl(—1)
S(—2)
(注意:
—4价含碳物质供学有余力的学生研究)
3.得出结论:
(1)元素是物质的基本组成成分,物质都是由元素组成的。
(2)同一种元素可以自身组成纯净物——单质(元素以单质的形式存在的状态称为该元素的游离态)
(3)不同种元素相互之间按照一定的规律可以组成纯净物——化合物(元素以化合物的形式存在的状态称为该元素的化合态);
相同的元素也可组成不同的化合物。
由于元素可以按照一定的规律以不同的种类和不同的方式进行组合,因而110多种元素能够构成庞大繁杂的物质世界(回答联想·
质疑中的第一个问题)。
4.迁移·
应用
(1)丰富已有的元素——纯净物图,展现元素与物质的关系。
①省略号(一类物质)给学生留下了一个再创造的空间。
如含铜物质、含钠物质(金属)、含氢物质、含碳物质、含硫物质(非金属)等均可依下图建立相
应的图示(教师启发,学生演练)。
②化合物中的化学式也给学生留下了一个再创造的空间。
教师引导学生进一步填写学生熟悉物质的化学式,使学生进行知识建网。
(2)迁移应用,培养学生的分类能力和建立元素及其化合物家族的概念。
知识点击:
供学生阅读,使学生了解和建立元素的化合价与物质的关系,为后续学习奠定基础。
课外作业:
P37—1、3题。
第2课时
二.物质的分类
交流·
研讨
学生列举熟悉的物质,写出化学式,根据一定的分类标准进行分类并绘制简图。
教师引例:
学生演练,教师要及时给出鼓励性、发展性评价,使学生的个性得到张扬。
1.物质分类标准的研究
(1)物质是否由同一种分子组成(学生回忆初中化学或科学的内容)——纯净物和混合物。
(2)要根据被分散物质颗粒的大小可将混合物分为溶液、浊液、胶体等。
(3)纯净物是否由同种元素组成——相同元素构成单质(游离态);
不同元素构成化合物(化合态)。
(4)化合物在水溶液中或熔化状态下是否导电——电解质和非电解质。
(5)根据化合物的性质可将它们分为酸、碱、盐、氧化物。
(6)根据反应物在化学反应中的表现,可将反应物分为氧化剂和还原剂。
2.单质、氧化物、酸、碱和盐之间的关系
活动·
探究
(1)探究示例:
反应物
实验现象
结论
类别:
盐
酸
氧化物
碱
单质
锌溶解,有大量气泡冒出
酸能和活泼金属反应放出氢气。
碱溶液由红色变成无色
酸能和碱发生中和反应。
黑色的氧化铜溶解,溶液变蓝色。
酸能和碱性氧化物反应。
产生白色沉淀
酸能和某些盐反应。
(2)学生探究:
将全班学生分为四个小组分别探究以下四种代表物的性质,填写探究报告,然后全班汇报、交流探究结果(探究的目的是让学生尝试探究一类物质的通性,初步体验
研究一
类物质性质的过程和方法)。
①、金属铁(单质)的性质;
②Ca(OH)2(碱)的性质;
③CuSO4(盐)的性质;
④氧化铜(碱性氧化物)的性质。
(3)在活动探
究的基础上,建立单质、酸、碱、盐、氧化物之间的关系图示(学生补充完成P33图2—1—4),并写出相应转化关系的化学方程式。
【点评】科学探究是新课程改革的重要突破口,而“研究物质性质的方法和程序”是“过程与方法”的重要体现。
探究单质、酸、碱、盐、氧化物之间的关系,正是使用了这一重要方法,其中学生主动参与其关系的探究过程,不仅完成了知识上的再发现任务,而且更重要的是在探究过程中能获得一种体验,获得成功感,它对于提高学生的科学素养有着重要的作用。
3.单质、酸、碱、盐、氧化物之间的关系的用途
(1)研究一类物质的性质(完成从单个物质向一类物质的过渡)。
当学生今后再探究陌生物质的性质时,可以先分析该物质的类别,然后预测它可能与哪些物质发生反应。
(2)制备有关物质。
(3)鉴别物质。
(4)提纯物质。
1.按照课本P33图2—1—4的图示,在补充完成单质、酸、碱、盐、氧化物之间的关系图示后,写出相应的化学反应方程式(要求与课堂上的示例不重复)。
2.按照课本P33图2—1—4的图示,按下列要求各举一例,并写出化学方程式。
(1)制备一种物质。
(2)鉴别两种物质。
(4)有两种物质组成的混合物,提纯一种物质。
第3课时
引入新课——
联想·
质疑(提出问题)
在天气晴朗的情况下,当你漫步在茂密的树林里,会看到缕缕霞光穿过林木枝叶铺洒在地面上,你知道这是为什么吗?
在晚上,当你打开手电筒时,会看到一道“光柱”射向天空或射向远方,你知道这是为什么吗?
这些现象与一种特殊的混合物有关。
1.分散质:
被分散成微粒的物质叫分散质。
如食盐溶液中的食盐。
2.分散剂:
分散质分散到另一种物质中,这种物质(另一种物质)叫分散剂。
如食盐溶液中的水。
3.分散系:
由分散质和分散剂构成的混合物统称为分散系。
如食盐溶液就是一种分散系。
教师要求学生列举几种分散系,并指出分散质和分散剂。
4.几种常见的分散系(根据分散系中分散质粒度大小进行分类)
(1)溶液:
分散质是分子或离子,分散质的粒度<1nm(10-9m),具有透明、均匀、稳定的宏观特征。
(2)浊液:
分散质是分子的集合体或离子的集合体,分散质的粒度>100nm(10—7m),具有浑浊、不稳定等宏观特征。
(3)胶体:
分散质的粒度介于1~100nm之间的分散系叫胶体(也称为溶胶)。
【点评】数轴是初一数学中的一个重要内容。
在化学教学中应用数轴将同一类型的不同对象按数量的大小在数轴上进行有序排列,可以使学生建立有序思维。
如物质的溶解性(难溶、微溶、易溶)、同种元素的变价化合物均可用数轴进行排列。
5.胶体的性质
(1)丁达尔现象:
当可见光束通过胶体时,在入射光侧面可观察到明亮的光区,这种现象叫做丁达尔现象或丁达尔效应。
丁达尔现象产生的原因:
胶体中分散质微粒对可见光(波长为40
0~700nm)散射而形成的。
丁达尔现象的应用:
区别溶液和胶体。
实验:
先取一个具有双通性质的纸筒(事先在纸筒的下端钻一个小孔,以让光线通过),将纸筒套在盛在氢氧化铁胶体的烧杯上,再取一只40W的电灯泡,通电后放在纸筒的小孔处,人从纸筒的上端从上往下观察,即可观察到有一条“光亮的通路”的现象。
能同样的办法观察食盐溶液的现象。
(2)电泳:
胶体中的分散质微粒在直流电的作用下产生定向移动的现象叫电泳。
电泳现象说明胶体中的分散质微粒带有电荷。
胶体粒子带
电的经验规律——
带正电荷的胶体粒子:
金属氢氧化物(如氢氧化铝、氢氧化铁胶体);
金属氧化物胶体。
带负电荷的胶体粒子:
非金属氧化物胶体;
金属硫化物胶体;
硅酸胶体;
土壤胶体。
特殊胶体:
AgI胶体粒子随AgNO3和KI的相对量不同可带正电或负电。
若KI过量,则AgI胶体粒子吸附I—而带负电荷;
若AgNO3过量,则AgI胶体粒子吸附Ag+而带正电荷。
(3)聚沉:
向胶体中加入盐时,其中的阳离子或阴离子能中和分散质微粒所带的电荷,从而使分散质聚集成较大的微粒,在重力作用下形成沉淀析出。
这种胶体形成沉淀析出的现象称为胶体的聚沉(适用于液溶胶)。
向氢氧化铁胶体中加入适量的硫酸钠,可观
察到氢氧化铁沉淀析出。
6.胶体的制备
凝聚法:
(1)向沸水中滴加几滴饱和的氯化铁溶液,适当加热即可形成氢氧化铁胶体(注意加热时间不宜过长,否则会形成氢氧化铁沉淀)。
FeCl3+3H2O====Fe(OH)3(胶体)+3HCl
(2)在不断振荡的情况下,向稀KI溶液中加入稀AgNO3溶液,可制得浅黄色的确良AgI胶体。
7.胶体的用途:
(1)盐卤点豆腐;
(2)肥皂的制取和分离;
(3)明矾净水;
(4)FeCl3溶液用于伤口止血。
(5)水泥硬化;
(6)冶金厂大量烟尘用高压电除去。
(7)土壤胶体中离子的吸附和交换过程,保肥作用。
供学生阅读,并可让学生进行家庭小实验,研究胶体提纯的方法——渗析。
家庭小实验——用一个猪膀胱盛食盐溶液和淀粉溶胶,然后将猪膀胱浸泡在蒸馏水中,过一段时间后,用两个试管分别取烧杯中的蒸馏水少许,分别滴加硝酸酸化的AgNO3溶液碘水溶液,分别观察产生的现象,并思考产生这两种现象的原因。
8.三种分散系的比较
分散系
溶液
胶体
浊液
分散质粒子的直径
<1nm
1nm100nm
>100nm
外观
均一、透明
较均一、透明
不均一、不透明
分散质微粒
分子、离子
分子集合体、高分子
大量的分子集合体
能否透过滤纸
能
不能
能否透过半透膜
稳定性
稳定
较稳定
不稳定
【点评】比较法是进行归纳总结的一种重要方法。
它能帮助学生找出不同对象的相同点和不同点,抽象出不同事物的本质特征。
学生自己建立表格进行比较则效果更好。
1.完成P36的知识结构示意图。
2.P37第2题。