完整word版高三化学化工流程题专题练习Word格式文档下载.docx
《完整word版高三化学化工流程题专题练习Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《完整word版高三化学化工流程题专题练习Word格式文档下载.docx(13页珍藏版)》请在冰豆网上搜索。
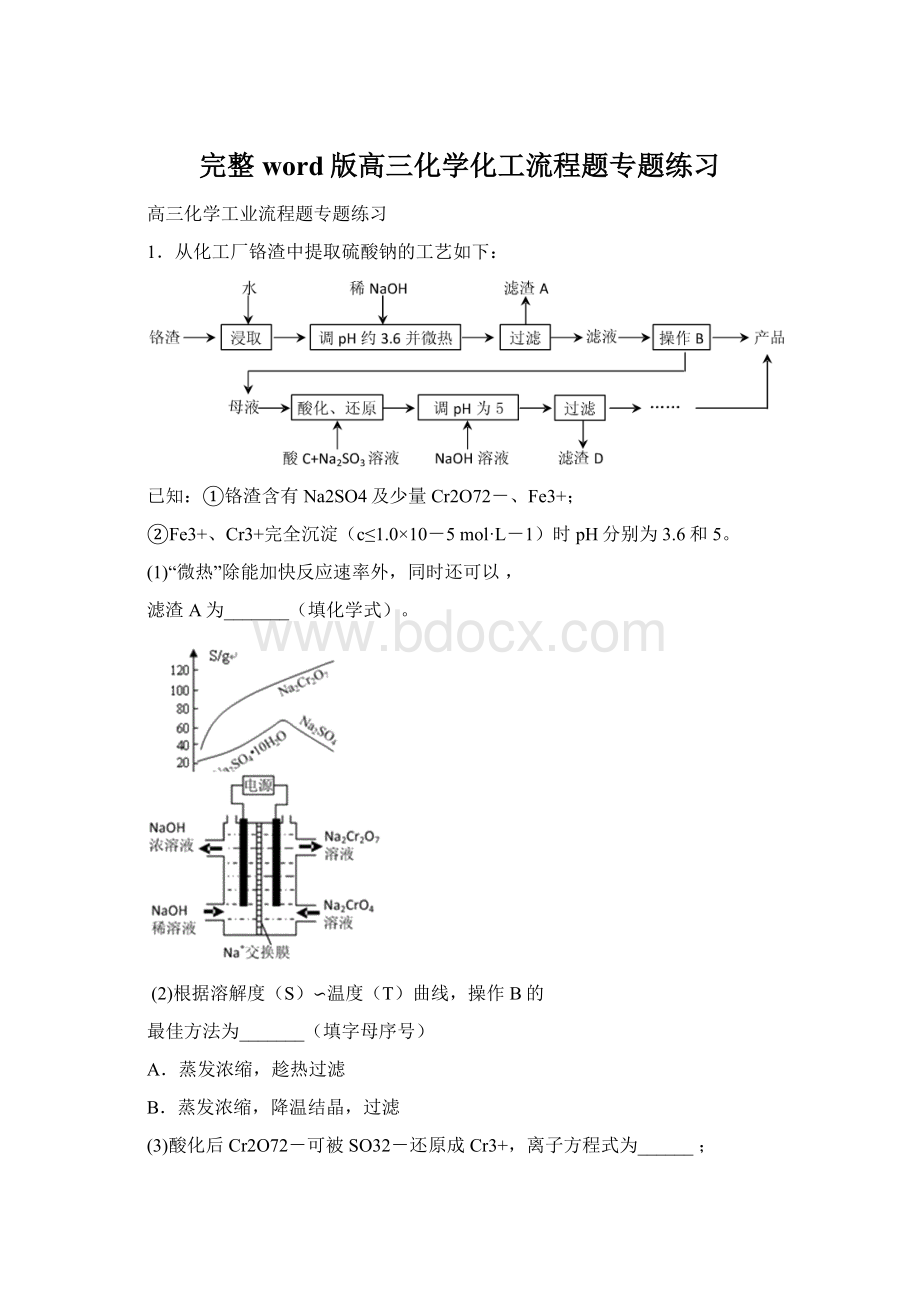
以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质
Mn(OH)2
Co(OH)2
Ni(OH)2
MnS
CoS
NiS
Ksp
2.1×
10-13
3.0×
10-16
5.0×
1.0×
10-11
10-22
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是。
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是。
(4)步骤Ⅳ中,在(填“阴”或“阳”)极析出Mn,电极反应方程式为。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。
进行二级沉降的目的是。
4.回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
根据上图所示步骤并参考表格数据,回答下列问题。
物质
开始沉淀
沉淀完全
Fe(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
8.3
9.8
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。
MnO2与
浓盐酸反应的离子方程方程式:
_。
(2)酸浸时,浸出时间对锰浸出率的影响如右上图所示,工业采用的是浸取60min,其可能原因是。
(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是。
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目是。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为。
(6)工业上利用KOH和MnO2为原料制取KMnO4。
主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;
第二步为电解K2MnO4的浓溶液制取KMnO4。
①第一步反应的化学方程式为。
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为。
5.铬铁矿的主要成分可表示为FeO·
Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程。
已知1:
物质的溶解度(g/100g水)
0℃
40℃
80℃
KCl
28.0
40.1
51.3
NaCl
35.7
36.4
38.0
K2Cr2O7
4.7
26.3
73.0
Na2Cr2O7
163.0
215.0
376.0
已知2:
①焙烧时有Na2CrO4、Fe2O3、NaAlO2等生成。
②Cr2O72-+H2O
2CrO42-+2H+;
Cr2O72-具有很强的氧化性
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有(要求写一条)。
(2)固体b中主要含有(填写化学式)。
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用(填写仪器或用品名称)。
(4)酸化步骤用醋酸调节溶液的pH﹤5,其目的是;
不用盐酸调节溶液pH的原因是。
(5)操作III发生反应的化学方程式是,
要得到K2Cr2O7晶体的操作步骤是蒸发浓缩、冷却结晶、、和干燥。
6.从明矾[KAl(SO4)2·
12H2O]制备Al、K2SO4和H2SO4的流程如下:
明矾焙烧的化学方程式为:
4KAl(SO4)2·
12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
A.粉碎固体混合物 B.降低温度C.不断搅拌 D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:
。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为bg/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为吨(列出计算表达式)。
7.用含有A12O3、SiO2和少量FeO·
xFe2O3的铝灰制备A12(SO4)3·
18H2O。
工艺流程如下:
(一定条件下,MnO4-可与Mn2+反应生成MnO2)
生成氢氧化物沉淀的pH
Al(OH)3
开始沉淀时
3.4
6.3
完全沉淀时
5.2
9.7
3.2
(1)H2SO4溶解A12O3的离子方程式是
(2)检验滤液中还存在Fe2+的方法是______________________________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤,
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的:
;
调节溶液的pH为3.2的目的是。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是,写出其反应方程式:
③Ⅲ中加入MnSO4的目的是。
(4)从多次循环使用后母液中可回收的主要物质是_____________________。
(填化学式)
8.为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
请回答:
(1)绿矾的化学式为。
(2)写出反应①的化学方程式,
反应②生成沉淀的离子反应方程式。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):
。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为;
若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积L。
9.某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。
(写出两个)
(3)物质X的化学式为___________。
“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。
为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·
6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:
_______________________。
10.工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
Ca(IO3)2微溶于水,溶于硝酸;
Ksp(CuI)=1.1×
10-12,Ksp(Cu2S)=2.5×
10-48;
氧化性:
HNO3>
IO3->
H2O2
(1)“还原”过程中主要反应的化学方程式为:
2Na2S2O3+I2=+2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至(填“酸性”或“中性”或“碱性”),原因是。
(5)Ca(IO3)2也可用电化学氧化法制取:
先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。
写出电解时阳极发生的电极反应方程式,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为kg(计算结果保留3位有效数字)。
11.工业上生产高氯酸(沸点:
90°
C)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)实验室进行过滤操作的常用玻璃仪器有。
(2)反应器I中的温度最佳为(填序号);
操作②的名称为。
A.0°
C;
B.20°
C.80°
D.120°
C
(3)反应器II中发生反应的离子方程式为。
2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O
(4)加快反应器II中反应速率的措施有(写出一种措施即可)等。
从反应器II中获得NaClO2粗品的实验操作依次是(填序号,下同),进一步提纯的操作名称为。
A.过滤B.重结晶C.蒸馏D.蒸发浓缩E.蒸干灼烧F.冷却结晶G.萃取分液
(5)上述流程中可循环使用的物质为,副产品除NaClO2、NaHSO4外还有(填化学式)。
12.、磷酸盐骨水泥具有良好的生物相容性和生物活性。
医药工业利用共沉淀原理,通过控制Ca/P物质的量比[n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和1.5]流程如下:
(注:
Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4均难溶于水;
Ca(H2PO4)2溶液pH<
7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:
pH值
6.8
7.2
8.0
9.0
10.0
产率(%)
92.6
95.3
96.7
94.6
95.6
n(Ca)/n(P)
1.51
1.50
1.52
(1)流程中强调“滴加速度100mL/45min”的作用是_________。
流程中调pH选氨水,不选生石灰或石灰乳的理由是____。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为________,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2、CaHPO4和________。
(3)酸性条件下产率偏低的原因是________。
(4)“高温煅烧”滤饼,化学反应方程式为________。
(5)下图是生产羟基磷灰石时得到的实验曲线,依据图信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为____。
参考答案
1.
(1)促进Fe3+水解生成Fe(OH)3而除去;
(2分)Fe(OH)3;
(2分)
(2)A(2分)
(3)3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;
(3分,化学式和配平错误0分)
H2SO4;
(2分)1.0×
10-32mol4·
L-4(2分,不带单位扣1分)
(4)正极,(2分)4OH--4e-=O2↑+2H2O(2分)(无“↑”扣分1分)
2.
(1)FeTiO3+2H+
Fe2++TiO2+H2O(3分)
(2)TiO2+2C+2Cl2
TiCl4+2CO(3分)
(3)Mg2++2e-=Mg(3分)Cl2和Mg(2分)
(4)能;
(1分)钠的还原性比镁强(1分)
(5)HCl(2分)(填写H2SO4、HNO3均可)
3、
(1)MnCO3+H2SO4=MnSO4+CO2↑+H2O(3分)
(2)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(3分)
(3)CoS和NiS(3分,错、漏均扣1分)
(4)阴(1分),Mn2++2e-=Mn(3分)
(5)沉降得到MnS,以进一步去除废水中的Mn2+(3分)
4.
(1)MnO2+4H++C1-=Mn2++C12↑+2H2O(3分)
(2)60min后,再延长浸出时间,增加生产成本,而浸出的量会不明显(2分)
(3)将Fe2+转化为Fe3+(2分)
(4)使Fe3+完全转化为Fe(OH)3沉淀,并防止Mn2+变成Mn(OH)2(2分)
(5)Mn2++H2O2+2OH-=MnO2↓+2H2O(3分)
(6)①2MnO2+4KOH+O2=2K2MnO4+2H2O(2分)②产生无色气泡(2分)
5.
(1)加热;
或研磨;
或搅拌;
(2分)
(2)Al(OH)3(2分);
(3)pH计或精密pH试纸(2分)
(4)使CrO42-转化为Cr2O72-(2分);
Cr2O72-会把盐酸(或氯离子)氧化为氯气(3分)
(5)Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl(3分,没↓或没配平扣1分),过滤、洗涤(2分)
6.
(1)KAl(SO4)2·
12H2O(2分)
(2)AC(2分,多选、错选0分)
(3)蒸发结晶(2分,“蒸发浓缩、冷却结晶”给1分)
(4)
阳极中碳被氧化成CO2(CO)(2分,用化学方程式表示也可,如:
C+O2
CO2或2C+O2
2CO,条件用加热或970℃也可)
(5)NiO(OH)+H2O+e-=Ni(OH)2+OH-(2分)
(6)
或
(3分,不带单位不扣分,化简也可以)
7.
(1)(2分)
(2)取少量滤液,滴加KMnO4溶液(2分),KMnO4溶液褪色(1分)
(3)①将Fe2+氧化为Fe3+,(2分)调节pH值使铁完全沉淀;
②生成有黄绿色气体(2分);
MnO2+4HCl△MnCl2+Cl2↑+2H2O(2分)
③除去过量的MnO4-。
(4)K2SO4。
8.
(1)FeSO4·
7H2O(2分)
(2)2Al+2NaOH+2H2O
2NaAlO2+3H2↑AlO2-+CO2+2H2O
Al(OH)3↓+HCO3-(4分)
(或2AlO2-+CO2+3H2O
2Al(OH)3↓+CO32-)[未写离子方程式扣1分,不配平扣1分,离子符号错0分]
(3)用试管取少量滤液D(1分),向滤液中滴加KSCN(或NaSCN、或NH4SCN)]
溶液无明显现象(1分),再滴入氯水(或双氧水,或通入Cl2)若变成血红色,则溶液则中存在Fe2+(1分)。
(4)铜、铁与稀硫酸形成了原电池(或发生了电化腐蚀,或有电流产生)(2分)
(5)Cu+H2O2+H2SO4
CuSO4+2H2O(2分。
配平1分,化学式错0分)
2(3分)[说明:
反应式为3Cu+2HNO3+3H2SO4
3CuSO4+2NO↑+4H2O]
9.
(1)Al2O3+6H+===2Al3++3H2O;
Fe2O3+6H+===2Fe3++3H2O(4分,每个2分)
(2)盐酸的浓度、反应温度、煤矸石颗粒大小、是否充分搅拌、反应时间(任写两个4分,每个2分)
(3)CO2;
Al(OH)3+OH-=AlO2-+2H2O(4分,每个2分)
(4)加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3(2分)
(5)AlCl3饱和溶液中存在溶解平衡:
AlCl3·
6H2O(s)
Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体(2分)
10.
(1)Na2S4O6(2分)
(2)2CuI(s)+S2-=Cu2S(s)+2I-(3分)
(3)减少氧化过程中生成的氮的氧化物的污染(2分)
(4)中性(2分)Ca(IO3)2在硝酸溶液中溶解,故要中和过量的酸;
在碱性溶液中,会混有微溶的Ca(OH)2造成产品不纯。
(2分)
(5)3H2O+I--6e-=IO3-+6H+(3分);
1.20(2分)
11.
(1)(普通)漏斗、玻璃棒、烧杯(3分,各1分)
(2)C;
蒸馏(各1分)
(3)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O(2分)
(4)适当升高温度(增大NaOH溶液的浓度、增大气体(SO2、ClO2)和NaOH溶液的接触面积等)(2分);
DF(A)(2分);
B(1分)
(5)硫酸;
Na2SO4(各2分)
12.
(1)使反应物充分接触(2分);
若选择生石灰或石灰乳调节pH会改变n(Ca)/n(P)(2分)
(2)7.2(2分);
CaCO3(2分)
(3)酸性条件下,容易造成钙的流失。
(或“酸性条件下,容易造成钙磷流失。
”
或“酸性条件下,难溶产物易溶解转化为易溶物质造成钙磷流失”)
或“酸性条件下,Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4等易转化为可溶的Ca(H2PO4)2,造成钙磷流失”)(2分)
(4)2CaHPO4+CaCO3高温Ca3(PO4)2+H2O+CO2↑
或Ca5(PO4)3OH+CaHPO4高温2Ca3(PO4)2+H2O(2分)
(5)0.056mmol·
L-1·
min-1(3分)