备战中考科学化学计算专项探究系列专题1折线型Word文档下载推荐.docx
《备战中考科学化学计算专项探究系列专题1折线型Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《备战中考科学化学计算专项探究系列专题1折线型Word文档下载推荐.docx(18页珍藏版)》请在冰豆网上搜索。
6.建造军舰的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。
研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验。
取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。
实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
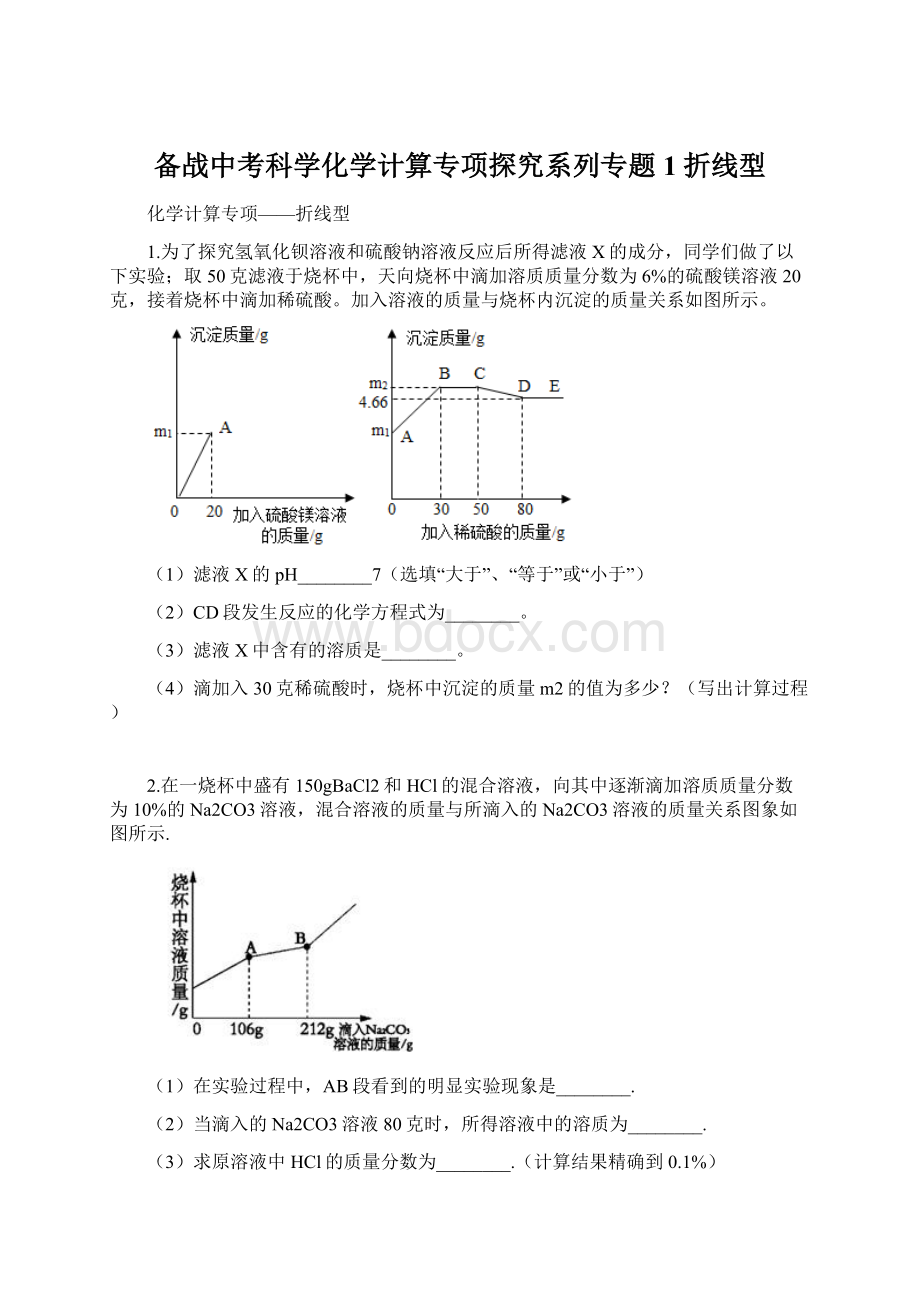
(1)20g赤铁矿石样品中氧化铁的质量为________g;
(2)通过计算说明该赤铁矿石是否属于富铁矿石________。
(写出计算过程)。
(3)求出恰好完全反应时溶液中溶质的质量分数(写出计算过程)。
7.小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定.取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀.继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图像。
(1)滴加的溶液中溶质属于________(选填“盐”或“碱”).
(2)10克碳酸钠溶液中含有的溶质质量是________克.
(3)图象中的a点数值是________.
(4)废液中含有的溶质是________(写化学式).
(5)通过计算说明,图象横坐标中的b点表示的溶液的质量是多少克?
8.称取一定质量的氯酸钾和二氧化锰混合物,放入大试管中加热至质量不再变化为止。
实验测得固体混合物质量随加热时间变化的相关数据如图所示。
请计算:
(1)反应中产生的氧气的质量?
(2)原混合物中氯酸钾的质量?
9.实验室用足量的稀盐酸和大理石反应来制取CO2为了分析反应后滤液的成分,取100g反应后的滤液,逐滴滴入溶质质量分数为10.6%的Na2CO3溶液,测得滴加溶液的质量与产生沉淀的关系如图所示。
(已知CaCl2溶液呈中性)
(1)通过计算求出图中m的大小
(2)随着滴加Na2CO3溶液质量的增加,烧杯中溶液的pH也呈现一定的变化规律。
结合图像判断:
b→c段烧杯中溶液pH如何变化________?
(选填“变大”“变小”或“不变”)
10.在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应。
记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示。
(1)试分析在混合溶液中滴加氢氧化钠时,为什么没有立即产生沉淀?
________。
(2)当滴加50克氢氧化钠溶液时,混合溶液中的溶质是(用化学式表示)________。
(3)200克混合溶液中,硫酸的溶质质量分数为________。
(4)完全反应时,所得溶液中的溶质质量分数为________。
11.在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:
是否可以测得实验所用的石灰石中碳酸钙的含量呢?
小明又进行了如下实验:
①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣.
②向滤渣中滴加稀盐酸,无明显的现象.
③将滤渣干燥后称量,质量为0.5g.
④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如图所示的图象.根据小明的实验过程回答下列问题.(假设石灰石中的其余杂质不与稀盐酸反应)
(1)第②步中小明向滤渣中加入稀盐酸的目的是为了________.
(2)第①步中如果在过滤时没有用蒸馏水多次洗涤,则测得碳酸钙的含量将________.(选填“偏大”、“不变”或“偏小”)
(3)石灰石中碳酸钙的含量
12.为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验;
取50克滤液于烧杯中,向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着烧杯中滴加稀硫酸。
13.已知:
①NaHCO3固体受热分解2NaHCO3
Na2CO3+CO2↑+H2O;
②Na2CO3受热不分解。
回答下列问题:
(1)关于Na2CO3固体的叙述错误的是_______(填标号)。
A.
俗称小苏打
B.
难溶于水
C.
可与稀盐酸发生反应
D.
侯氏制碱法可以制得
(2)欲测定某NaHCO3固体样品(只含Na2CO3杂质且分布均匀)中NaHCO3的质量分数,将5.0g该样品加热至质量不再改变,测得剩余固体的质量、生成CO2的质量随时间变化如图所示。
①NaOH溶液的pH________7(填“>”、“=”或“<”),用该溶液将生成的CO2完全吸收,发生反应的化学方程式为________。
②由图中数据可知,上述5.0gNaHCO3样品完全分解产生CO2的质量为________g,产生H2O的质量是________g。
③计算该样品中NaHCO3的质量分数(根据化学方程式写出完整的计算步骤)________。
14.有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动。
【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
【活动与探究】取一定量上述固体粉末,加足量水溶解。
(1)
【现象与结论】经上述操作,得到蓝色澄清溶液,则原固体粉末中一定没有________和________(填化学式)。
(2)
【探索与拓展】为进一步确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2g该粉末,溶于水配成174.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。
据图回答:
①计算产生最大沉淀量时所加NaOH溶液的质量。
②通过计算确定46.2g固体粉末的组成。
(回答出物质名称和其质量)
15.BaCl2是一种重金属盐,其水溶液具有很强的毒性,若误服了BaCl2溶液,可立即服用MgSO4溶液解毒,为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答:
(1)P点时溶液的溶质名称是________;
(2)反应生成沉淀的最大质量为________克;
(3)求原BaCl2溶液的溶质质量分数。
16.敞口放置的氢氧化钠溶液易吸收二氧化碳而变质。
现有部分变质的氢氧化钠溶液100克,向该溶液中逐滴加入10%的盐酸,反应过程中溶液的质量随加入盐酸质量的变化而变化的情况如图所示。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaOH+HCl=NaCl+H2O
(1)出现冒气泡的是________(填“AB”或“BC”)段。
(2)原溶液中氢氧化钠的质量多少克?
(3)当滴入盐酸滴加至图中C点时,该溶液中溶质有________(填写化学式)
(4)计算C点时烧杯中(不饱和溶液)溶质的质量分数。
(保留到0.1%)
17.实验要求,实验废液不能直接倾倒入排污管,必须回收处理。
某兴趣小组从实验室收集
到含有碳酸钠和氢氧化钠的混合废液5.44千克,现用溶质质量分数为19.6%的稀硫酸来处理,并回收处理后的溶液.他们向废液中加入稀硫酸时,所得溶液pH与加入的稀硫酸质量的关系曲线如图所示.求:
(1)据如图可知,当反应到A点时,溶液中含有的溶质是________。
(2)当向混合液中加入稀硫酸至N点时,加入的稀硫酸质量为10千克,此时溶液总质量为15千克.求此时所得溶液中溶质的质量分数(计算结果保留到0.1%).
(3)求混合废液中氢氧化钠的质量.
18.为了测定石灰石样品中碳酸钙的含量,某同学在15g样品中加入足量的稀盐酸进行实验(杂质不溶于水且不与酸反应,不考虑稀盐酸挥发)。
实验装置和有关数据如下:
当A装置中不再有气体产生时测得B装置的质量增加了4.6g;
C装置的质量没有发生变化且无明显现象。
请回答:
(1)石灰石样品中碳酸钙的质量为________g。
(2)15g样品最多能生成二氧化碳气体的质量为________g。
(3)请分析碱石灰的增重大于二氧化碳质量的原因________。
(4)所用稀盐酸的溶质质量分数是多少?
19.某化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:
取25.0g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。
求:
(1)产生CO2的总质量为________g。
(2)鸡蛋壳中碳酸钙的质量分数。
(3)所用盐酸的质量分数(保留1位小数)。
答案解析部分
一、解答题
1.【答案】
(1)大于
(2)Mg(OH)2+H2SO4=MgSO4+2H20
(3)Ba(OH)2和NaOH
(4)解:
设加入20克硫酸镁溶液时,生成Mg(OH)2沉淀的质量为x。
Ba(OH)2+
MgSO4=BaSO4↓+
Mg(OH)2↓
120
58
20克×
6%
x
120:
58=1.2克:
x
解得x=0.58克
M2=4.66克+0.58克=5.24克
3.【答案】
(1)产生白色沉淀
(2)BaCl2、NaCl、HCl
(3)4.9%
(4)当滴入Na2CO3溶液至图中B点时,氯化钡盐酸刚好与碳酸钠完全反应,所得溶液为氯化钠溶液
设盐酸反应产生氯化钠质量为a,产生二氧化碳质量为b
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106
117
44
10.6g
a
b
a=11.7g
b=4.4g
与氯化钡反应的碳酸钠质量为(212g-106g)×
10%=10.6g,设氯化钡反应产生氯化钠质量为m,产生碳酸钡沉淀质量为n
BaCl2+Na2CO3=BaCO3↓+2NaCl
106
197
117
10.6g
m
n
m=19.7g
n=11.7g
则所得不饱和溶液中溶质质量分数为
4.【答案】
(1)19.8;
0.6
(2)49%
(3)7.2
(4)Fe2O3
5.【答案】
(1)2.2;
NaCl、NaOH、Na2CO3
(2)69.4%
(3)CD
6.【答案】
(1)混合物
(2)35%
(3)根据图像可知,锌的质量为20g-7g=13g,
设生成的硫酸锌的质量为x,生成的氢气的质量为y。
Zn
+
H2SO4
=
ZnSO4
H2↑
65
161
2
13g
x
y
;
解得:
x=32.2g,y=0.4g;
恰好完全反应时,所得溶液中溶质的质量分数是
。
7.【答案】
(1)16
(2)该样品中铁元素的质量:
16g×
=11.2g
该样品中铁元素的质量分数为:
×
100%=56%,由此判断出该赤铁矿石属于富铁矿石。
(3)Fe2O3+6HCl═2FeCl3+3H2O,
x=32.5
氯化铁的质量分数:
32.5g/(16g+150g)=19.6%
8.【答案】
(1)盐
(2)2.65
(3)1.1
(4)HCl、CaCl2
(5)设与氯化钙反应的碳酸钠溶液中溶质质量为y,
CaCl2+Na2CO3=2NaCl+CaCO3↓
100
y
5g
y=5.3g
与氯化钙反应的碳酸钠溶液质量是:
5.3g÷
26.5%=20g;
b点溶液质量:
20g+10g=30g。
9.【答案】
(1)4.8克
(2)解:
设原混合物中氯酸钾的质量为x
2KClO3
2KCl+
3O2↑
245
96
4.8g
=
=12.25g
10.【答案】
(1)设与氯化钙反应的碳酸钠质量为x。
CaCl2+Na2CO3=CaCO3↓+2NaCl
100
x
10g
x=10.6g;
与氯化钙反应的碳酸钠溶液的质量为:
10.6g÷
10.6%=100g;
那么图中:
m=10g+100g=110g;
(2)不变
11.【答案】
(1)氢氧化钠与硫酸发生中和反应
(2)Na2SO4,CuSO4
(3)9.8%
(4)26.2%
12.【答案】
(1)检验滤渣中是否还有剩余的CaCO3
(2)偏小
(3)石灰石中碳酸钙的含量为80%
13.【答案】
(1)大于
(2)Mg(OH)2+H2SO4=MgSO4+2H2O
(3)Ba(OH)2、NaOH
(4)设加入20g硫酸镁生成的氢氧化镁的质量为x
MgSO4=
Mg(OH)2+↓+BaSO4↓
20g×
x=0.58g
m2的值为4.66g+0.58g=5.24g
14.【答案】
(1)A,B
(2)>;
CO2+2NaOH=Na2CO3+H2O;
1.1;
0.45;
设该样品中NaHCO3的质量分数为x。
16844
5xg1.1g
x=84%
答:
该样品中NaHCO3的质量分数为84%
15.【答案】
(1)碳酸钠;
碳酸钙
(2)①设硫酸铜的质量为x,氢氧化钠的质量为y,
由图中数据可知,产生最大沉淀量是19.6g,
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,
160
80
98
19.6g
x=32g,y=16g;
产生最大沉淀量时所加NaOH溶液的质量为:
16g÷
8%=200g;
②46.2g固体中含有硫酸铜32g,含有硫酸钠的质量为:
46.2g-32g=14.2g。
16.【答案】
(1)氯化镁
(2)23.3
(3)设氯化钡质量为x
BaCl2+MgSO4═
BaSO4↓+MgCl2
208
233
23.3g
x=20.8g,
原BaCl2溶液的溶质质量分数为:
100%=20.8%
原BaCl2溶液的溶质质量分数为20.8%
17.【答案】
(1)BC
(2)设原溶液中氢氧化钠的质量为x
NaOH+
HCl=NaCl+H2O
40
36.5
73×
10%
X=8g
(3)NaCl
(4)设C点时烧杯中(不饱和溶液)溶质NaCl的质量为x,
HCl=
NaCl+H2O
58.5
X=11.7g
Na2CO3+
2HCl=
2NaCl+H2O+
CO2↑
117
44
(109.5-73)×
y
X=11.7g;
y=4.4g
溶质质量分数=
=11.4%
18.【答案】
(1)碳酸钠和硫酸钠
(2)由反应的化学方程式;
H2SO4+2NaOH═Na2SO4+2H2O;
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
得到:
H2SO4~Na2SO4
142
10kg×
19.6%
x
x=2.84kg;
所得溶液中溶质的质量分数为:
(3)生成二氧化碳质量为:
5.44kg+10kg-15kg=0.44kg;
设参加与碳酸钠反应的硫酸质量为m
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
m×
0.44kg
解得:
m=5kg;
所以与氢氧化钠反应的硫酸质量为:
10kg-5Kg=5kg;
混合物中含有氢氧化钠质量为n
H2SO4+2NaOH═Na2SO4+2H2O
98
80
5kg×
n
n=0.8kg。
19.【答案】
(1)10g
(2)4.4g
(3)碳酸钙与盐酸反应会生成二氧化碳,同时还会带出部分水蒸气,因而从A装置中出来的二氧化碳和水蒸气同时被B装置吸收
(4)设与10g碳酸钙恰好完全反应时消耗盐酸的溶质质量为m
CaCO3+
2HCl=CaCl2+H2O+CO2↑
73
m
m=7.3g
稀盐酸=110.4g-15g+4.6g=100g
HCl%=
=7.3%
所用稀盐酸的溶质质量分数是7.3%。
20.【答案】
(1)9.9
(2)设鸡蛋壳中碳酸钙的质量是x,100克盐酸中含HCl的质量为y。
CaCO3+
2HCl=CaCl2+
CO2↑+H2O
9.9g
=
x=22.5g
y=16.4g
鸡蛋壳中碳酸钙的质量分数=
100%=90%
(3)所用盐酸的质量分数=
100%=16.4%