高考化学冲刺专题4物质结构与元素周期律Word+解析文档格式.docx
《高考化学冲刺专题4物质结构与元素周期律Word+解析文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学冲刺专题4物质结构与元素周期律Word+解析文档格式.docx(25页珍藏版)》请在冰豆网上搜索。
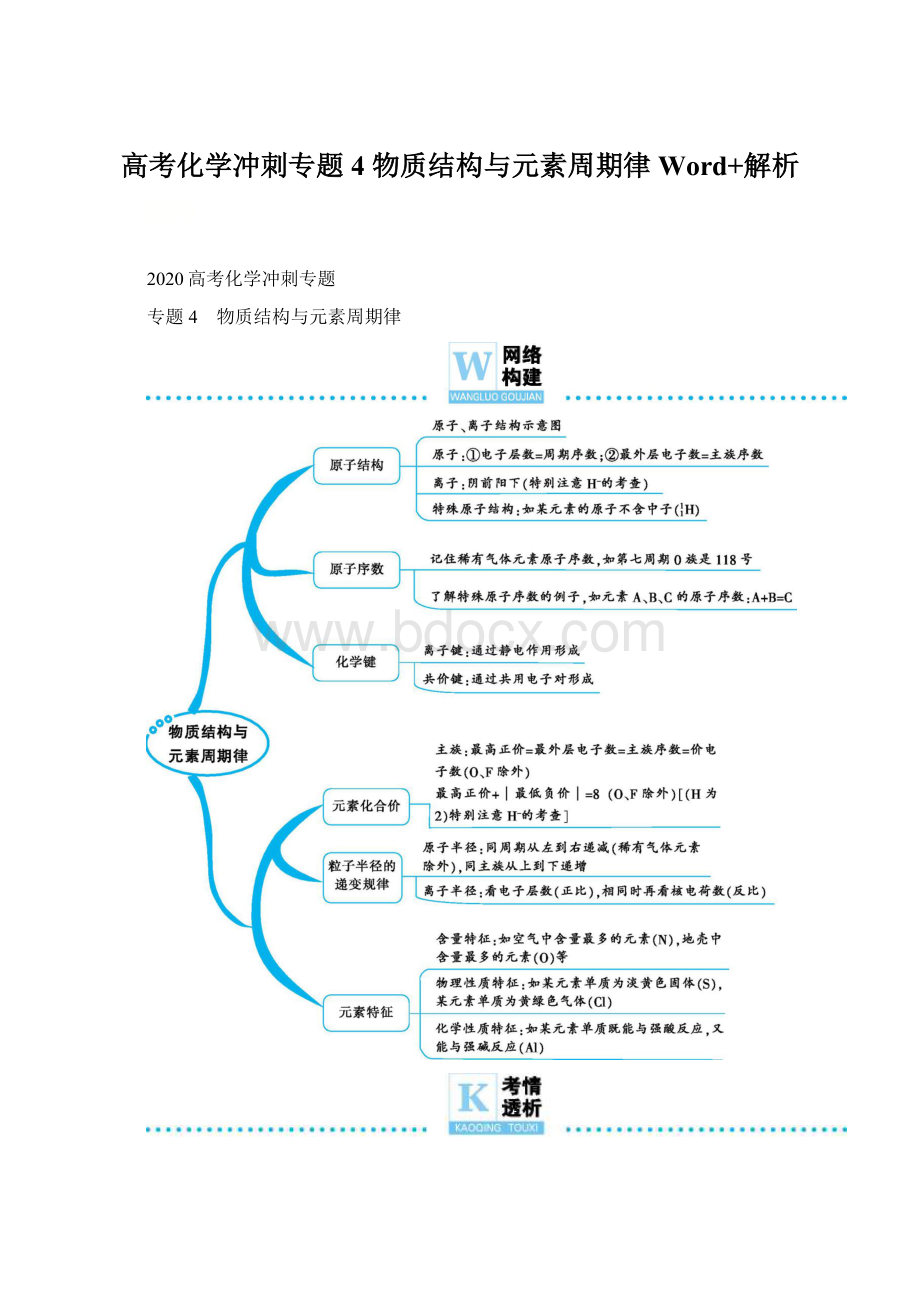
r(Na+)。
(2)“二看”核电荷数。
当电子层数相同时,核电荷核数越大,半径越小。
例如,r(Na)>
r(Mg)>
r(Al)>
r(Si)>
r(P)>
r(S)>
r(Cl);
r(O2-)>
r(F-)>
r(Na+)>
r(Mg2+)>
r(Al3+)。
(3)“三看”核外电子数。
当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
例如,r(Cl-)>
r(Fe2+)>
r(Fe3+)。
2.元素金属性、非金属性强弱判断
考点1
▶ 元素周期表的应用
1.(改编)2019年是“国际化学元素周期表年”。
下列有关说法不正确的是( )。
A.元素周期表中含元素种类最多的族是第ⅢB族
B.新发现的115号元素(Mc)位于元素周期表第ⅢA族
C.元素周期表中第14列元素所形成的化合物种类最多
D.在元素周期表的金属与非金属分界线附近寻找半导体材料
解析▶ 元素周期表中第ⅢB族包括镧系元素、锕系元素,共32种元素,在所有族中所含元素种类最多,A项正确;
115号元素(Mc)位于元素周期表第ⅤA族,B项错误;
第14列为碳族元素,C元素可以形成有机物,故该列元素形成化合物的种类最多,C项正确;
金属元素与非金属元素分界线附近往往可以寻找作半导体材料的元素,如硅,D项正确。
答案▶ B
1.(原创)2019年1月29日联合国教科文组织启动了“化学元素周期表国际年”系列活动。
下列说法正确的是( )。
A.元素周期表中第ⅠA族的元素均为碱金属元素
B.位于第四周期ⅤA族的元素为非金属元素
C.短周期元素的正化合价数值和其族序数相同
D.自然界中的元素是取之不尽、用之不竭的
解析▶ 元素周期表第ⅠA族的元素中除H元素外都是碱金属元素,A项错误;
位于第四周期ⅤA族的元素是砷(As)元素,为非金属元素,B项正确;
短周期元素最高正化合价的数值和其族序数相同(O、F除外),C项错误;
有些元素具有放射性,存在时间很短暂,不是取之不尽、用之不竭的,D项错误。
1.元素周期表中,元素种类最多的是第ⅢB族,形成化合物种类最多的是第ⅣA族。
2.现行的元素周期表不是按照相对原子质量排列的,而是按照原子序数排列的。
3.描述元素在周期表中的位置时,族序数要用罗马数字表示,分清罗马数字的4(Ⅳ)和6(Ⅵ)。
4.短周期中两元素原子序数相差8,它们不一定位于同一主族(如H和F)。
5.元素活泼,其单质不一定活泼。
如N元素,因为N2形成了三键。
考点2
▶ 元素周期律的应用
2.(2019年四川成都第七中学模拟)W、X、Y、Z为四种短周期主族元素且其中只有一种是金属元素。
它们在元素周期表中的相对位置如图所示。
X
W
Y
Z
A.X、Y、Z中Y单质与氢气化合最容易
B.W的氢化物具有较强的还原性
C.元素Y和Z在自然界中均存在游离态
D.X的氢化物的沸点一定小于Y的氢化物
解析▶ 由各元素在元素周期表中的相对位置可知,W为Al元素,X为C元素,Y为Si元素,Z为P元素。
元素的非金属性越强,越容易与氢气化合,X、Y、Z中P的非金属性最强,则Z单质与氢气化合最容易,A项错误;
W为Al元素,W的氢化物中H为-1价,具有较强的还原性,B项正确;
硅为亲氧元素,在自然界中只能以化合态存在,C项错误;
C的氢化物很多,当C原子数较多时,形成的烃可能为固体,X的氢化物的沸点不一定小于Y的氢化物,D项错误。
2.(2019年全国Ⅱ卷,9改编)今年是门捷列夫发现元素周期律150周年。
下表是元素周期表的一部分,W、X、Y、Z均为短周期主族元素,Z的质子数是W的质子数的2倍。
下列说法错误的是( )。
A.简单离子半径:
W>
B.常温常压下,Y单质为固体
C.气态氢化物的热稳定性:
Z<
D.X的最高价氧化物对应的水化物是强碱
解析▶ W、X、Y、Z均为短周期主族元素,Z的质子数是W的质子数的2倍,推出Z为S元素,W为O元素,X为Al元素,Y为Si元素。
O2-和Al3+具有相同的电子层结构,简单离子半径O2->
Al3+,A项正确;
Si单质在常温常压下为固体,B项正确;
非金属性O>
S,故气态氢化物的热稳定性H2O>
H2S,C项正确;
氢氧化铝是两性氢氧化物,碱性较弱,D项错误。
答案▶ D
1.氢元素不一定显+1价。
一般氢化物中氢元素为+1价,但在金属氢化物中氢元素为-1价,如NaH、CaH2等。
2.氧元素能与大多数元素形成多种化合物。
如H、N、C、Na、S、Cl等,都有两种或两种以上氧化物。
3.氧化物所对应水化物的酸性或碱性越强,其非金属性或金属性不一定越强,而是要求“最高价”。
也不能根据氢化物的酸性来比较元素的非金属性,如酸性HCl>
H2S,并不能说明Cl的非金属性强于S。
反例,非金属性F>
Cl,但酸性HF<
HCl。
4.难失电子的粒子不一定易得电子。
如稀有气体原子。
5.对主族元素来说,最高正价+|最低负价|不一定等于8。
例如,对于H,最高正价+|最低负价|=2,而O、F没有最高正价。
6.最高正价=|最低负价|,除第ⅣA族元素满足外,H元素也满足。
7.原电池中负极材料的金属性不一定强于正极材料的金属性。
还要注意介质对电极反应的影响。
如Al-Mg-NaOH溶液形成原电池时,Al为负极;
Al-Mg-HNO3(浓)溶液形成原电池时,Al为正极。
09 元素推断的解题技巧
一、元素推断常用的两个关系
1.原子或离子中基本微粒间的关系
(1)质子数=核电荷数=原子的核外电子数=原子序数。
(2)质量数=质子数+中子数。
(3)质子数=阳离子的核外电子数+阳离子所带电荷数。
(4)质子数=阴离子的核外电子数-阴离子所带电荷数。
2.化合物与化学键的关系
二、元素推断常用的五个方法
1.根据原子中几个重要关系推断
(1)电子层数=周期序数。
(2)质子数=原子序数。
(3)最外层电子数=主族序数。
2.根据原子或离子结构特征推断
(1)次外层电子数是2的元素在第二周期;
次外层电子数是8的元素在第三周期或第四周期的ⅠA族、ⅡA族。
(2)某元素阴离子的最外层电子数与次外层电子数相同时,该元素位于第三周期;
若为阳离子,则对应元素位于第四周期ⅠA族、ⅡA族。
(3)电子层结构相同的离子。
阴离子对应的元素在具有相同电子层结构的稀有气体元素的前面,阳离子对应的元素在具有相同电子层结构的稀有气体元素的下一周期的左边位置,简称“阴前阳下”。
3.根据元素化合价的特征关系推断
主族元素的最高正价=主族序数(O、F除外);
最低负价=主族序数-8(或2)。
4.根据原子半径的递变规律推断
同周期元素从左到右,原子半径递减;
同主族元素从上到下,原子半径递增。
5.根据元素的性质来推断元素的位置
如根据“形成化合物种类最多的元素(C)”“空气中含量最多的元素(N)”“地壳中含量最多的元素(O)”等特征来推断。
▶ 根据微粒结构特点推断
1.(2019年全国Ⅰ卷,13)
科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。
下列叙述正确的是( )。
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>
Y>
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
解析▶ 本题主要考查元素的推断与元素周期律的应用,侧重考查考生解决和分析化学问题的能力。
据题意知,W、X、Y、Z分别为Na、Si、P、Cl。
NaCl溶液呈中性,A项错误;
非金属性Cl>
P>
Si,B项错误;
H3PO4是中强酸,C项正确;
P原子与2个Si原子形成2对共用电子对,再得到1个电子后最外层满足8电子稳定结构,D项错误。
答案▶ C
1.(2019年山东青岛第二次模拟)已知前20号元素X、Y、Z、W、R原子序数依次增大,其中X、Z、R原子最外层电子数相等,且X与Z、R均可形成离子化合物;
Y、W同主族,Y原子最外层电子数是内层电子数的3倍。
A.元素原子半径大小顺序为W>
Z>
B.X与Y、Z、W形成的最简单化合物都属于电解质
C.Y与Z、R形成的化合物中均只含有离子键
D.Y与X、Z、W均可形成具有漂白性的化合物,且漂白原理相同
解析▶ 根据题意可知,X是H元素,Y是O元素,Z是Na元素,W是S元素,R是K元素。
同周期元素从左向右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径Z(Na)>
W(S)>
Y(O),A项错误;
X与Y、Z、W形成的最简单化合物依次为H2O、NaH、H2S,这几种物质都属于电解质,B项正确;
Y与Z、R形成的化合物有氧化钠、过氧化钠、氧化钾等,而过氧化钠中含有离子键、共价键,C项错误;
Y分别与X、Z、W可形成具有漂白性的化合物H2O2、Na2O2、SO2,前两者利用其强氧化性进行漂白,而SO2利用与有机色质化合为不稳定的无色物质进行漂白,漂白原理不同,D项错误。
1.常见的“10电子”“18电子”微粒
(1)常见的“10电子”微粒
(2)常见的“18电子”微粒
2.短周期元素中常见原子的核外电子排布规律
(1)原子核中无中子的原子
H。
(2)原子最外层有1个电子的元素:
H、Li、Na。
(3)原子最外层有2个电子的元素:
Be、Mg、He。
(4)原子最外层电子数等于次外层电子数的元素:
Be、Ar。
(5)原子最外层电子数是次外层电子数2倍的元素:
C;
是次外层电子数3倍的元素:
O;
是次外层电子数4倍的元素:
Ne。
(6)原子电子层数与最外层电子数相等的元素:
H、Be、Al。
(7)原子电子总数为最外层电子数2倍的元素:
Be。
(8)原子次外层电子数是最外层电子数2倍的元素:
Li、Si。
(9)原子内层电子总数是最外层电子数2倍的元素:
Li、P。
▶ 根据元素及其化合物的性质推断
2.(2019年辽宁沈阳东北育才中学高三一模)X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z的原子序数之和是Y、W原子序数之和的
。
甲、乙、丙、丁是由这些元素组成的二元化合物,M是Y元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,常温下化合物N是具有漂白性的气体。
上述物质间的转化关系如图所示(部分反应物和生成物省略)。
A.原子半径:
r(Y)>
r(Z)>
r(W)
B.化合物N与乙烯均能使溴水褪色,且原理相同
C.含W元素的盐溶液可能呈酸性、中性或碱性
D.Z分别与X、Y、W形成的化合物中,各元素均满足8电子结构
解析▶ 乙是一种“绿色氧化剂”,即乙为H2O2;
乙和丁的组成元素相同,则丁为H2O;
常温下化合物N是具有漂白性的气体,则N为SO2。
根据转化关系,M是单质,H2O2分解成O2和H2O,即M为O2,甲在酸中生成丙,丙为二元化合物,且含有S元素,即丙为H2S,四种元素原子序数依次增大,且都为短周期元素,X为H元素,Y为O元素,如果W为S元素,X、Z的原子序数之和是Y、W原子序数之和的
则Z为Na元素,如果Z为S元素,则W不符合要求。
同周期从左到右,元素原子半径逐渐减小,同主族从上到下,元素原子半径逐渐增大,原子半径大小顺序是r(Na)>
r(O),A项错误;
SO2能使溴水褪色,发生反应SO2+Br2+2H2O
2HBr+H2SO4,利用的是SO2的还原性,乙烯和溴水反应,发生的是加成反应,B项错误;
含S元素的盐溶液,若是Na2SO4,则溶液呈中性,若是NaHSO4,则溶液呈酸性,若是Na2SO3,则溶液呈碱性,C项正确;
形成的化合物分别是NaH、Na2O/Na2O2、Na2S,NaH中H原子最外层只有2个电子,不满足8电子结构,D项错误。
2.(2019年四川绵阳第三次诊断性考试)2019年是元素周期表诞生的第150周年,联合国大会宣布2019年是“国际化学元素周期表年”。
W、X、Y和Z为原子序数依次增大的四种短周期主族元素。
W的一种核素可用于文物年代的测定,X与W同周期且相邻,Y为金属元素,Z的单质为黄绿色气体。
下列叙述不正确的是( )。
A.W的最简单氢化物呈正四面体结构
B.Z的最高价氧化物对应的水化物为强酸
C.X与Y形成的化合物可发生水解反应
D.电解Y与Z形成的化合物的熔融物一定得金属单质
解析▶ 由题意可知,W为C元素,X为N元素,Y为Na(或Mg、Al)元素,Z为Cl元素。
W的最简单氢化物为甲烷,甲烷呈正四面体结构,A项正确;
Z的最高价氧化物对应的水化物为高氯酸,B项正确;
X与Y形成的化合物为氮化钠、氮化镁或氮化铝,均可发生水解反应,如氮化钠水解生成氨气和氢氧化钠,氮化镁水解生成氨气和氢氧化镁,氮化铝水解生成氨气和氢氧化铝,C项正确;
Y与Z的化合物可能为氯化铝,熔融状态不能导电,电解不能得到铝单质,D项错误。
1.形成化合物种类最多的元素,单质是自然界中硬度最大的物质,气态氢化物中氢的质量分数最高的元素:
C。
2.空气中含量最多的元素,气态氢化物的水溶液呈碱性的元素:
N。
3.地壳中含量最多的元素,氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:
O。
4.单质最轻的元素:
H;
单质最轻的金属元素:
Li。
5.单质在常温下呈液态的非金属元素:
Br;
单质在常温下呈液态的金属元素:
Hg。
6.最高价氧化物及其对应的水化物既能与强酸反应,又能与强碱反应的元素:
Al。
7.气态氢化物和最高价氧化物对应的水化物能发生化合反应的元素:
N,能发生氧化还原反应的元素:
S。
8.单质在常温下能与水反应放出气体的短周期元素:
Li、Na、F。
9.最活泼的非金属元素(或无正价的元素,无含氧酸的非金属元素,其无氧酸可腐蚀玻璃的元素,其气态氢化物最稳定的元素,阴离子的还原性最弱的元素):
F。
考点3
▶ 根据位置关系推断
3.(2019年安徽合肥高三第三次教学质量检测)X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,其在元素周期表中的位置如图所示。
A.X、Y、W三种元素最简单氢化物的沸点依次升高
B.Z、X、W三种元素氧化物对应水化物的酸性依次增强
C.由X、W和氢三种元素形成的化合物中只含共价键
D.X、Z形成的二元化合物是一种新型无机非金属材料
解析▶ 根据短周期中X、Y、Z、W的位置可知,X和Y位于第二周期,Z和W位于第三周期,设Z元素原子的最外层电子数为a,则X、Y、W原子的最外层电子数分别为a+1、a+2、a+3;
有a+a+1+a+2+a+3=22,得a=4,Z的最外层电子数为4,Z为Si元素,则X、Y、W分别为N、O、Cl元素。
X、Y、W三种元素最简单氢化物分别为NH3、H2O、HCl,由于NH3、H2O分子间存在氢键,沸点会更高,因此沸点最高的是H2O,最低的是HCl,A项错误;
Z、X、W三种元素的氧化物对应水化物的酸性不一定依次增强,如Cl的含氧酸中HClO为弱酸,其酸性比N的最高价氧化物对应的水化物HNO3弱,B项错误;
X、W和H三种元素形成的化合物可能为NH4Cl,NH4Cl为离子化合物,其中既存在离子键又存在共价键,C项错误;
Z和X形成的二元化合物为氮化硅,氮化硅是一种重要的结构陶瓷材料,它是一种新型无机非金属材料,D项正确。
3.(2019年湖南怀化第二次模拟)短周期元素T、X、Y、Z、W在元素周期表中的相对位置如图所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列说法正确的是( )。
A.X、Y的氧化物均可作耐火材料
B.最简单气态氢化物的热稳定性:
W<
C.1molTW2分子中含有2NA对共用电子对
D.最高价氧化物对应水化物的碱性:
X<
解析 由题意可推知,T是C元素,X是Mg元素,Y是Al元素,Z是P元素,W是S元素。
MgO、Al2O3均可作耐火材料,A项正确;
元素的非金属性越强,其相应的最简单气态氢化物的稳定性就越强,元素的非金属性W>
Z,所以最简单气态氢化物的稳定性W>
Z,B项错误;
CS2分子中存在两个碳硫双键,硫原子和碳原子最外层都达到8电子稳定结构,其电子式为
1molTW2分子中含有N4A对共用电子对,C项错误;
元素的金属性越强,其最高价氧化物对应水化物的碱性越强,金属性X>
Y,它们的最高价氧化物对应水化物的碱性X>
Y,D项错误。
答案▶ A
原子的最外层电子数规律
最外层电
子数(N)
3≤N<
8
N=1或2
N>
次外层
电子数
元素在周期
表中的位置
主族
ⅠA族、ⅡA族、
Ⅷ族、副族、
0族元素氦
第二周期
1.(2019年河南郑州一模)X、Y、Z、W是原子序数依次增大的四种短周期元素,X、W同主族,Y、Z、W同周期,其中只有Y为金属元素,W元素最高正价与最低负价的代数和为4。
下列说法不正确的是( )。
B.Y与X形成的化合物不可能含有共价键
C.简单氢化物的稳定性:
X>
D.Z与X形成的化合物能与NaOH溶液反应
解析▶ X位于第二周期,其原子半径最小,Y、Z、W同周期,同周期元素原子序数越大,原子半径越小,则原子半径大小为Y>
X,A项正确;
由题意可知,W元素为S元素,X为O元素,Y可能为Na、Mg或Al元素,其中Na与O形成的过氧化钠中含有共价键,故B项不正确;
非金属性越强,简单氢化物的稳定性越强,非金属性X>
Z,则简单氢化物的稳定性X>
Z,C项正确;
Z可能为Si元素或P元素,Si元素和P元素的氧化物均为酸性氧化物,能与氢氧化钠溶液反应,D项正确。
2.(2019年重庆第一中学月考改编)短周期主族元素X、Y、Z、M的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,Y2+电子层结构与氖原子相同,室温下Z单质为淡黄色固体。
M>
B.4种元素中Z的非金属性最强
C.Z的氧化物对应的水化物一定是强酸
D.化合物XM4可在光照下生成
解析▶ 短周期主族元素X、Y、Z、M的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,则X是C元素;
Y2+电子层结构与氖原子相同,则Y是Mg元素;
室温下Z单质为淡黄色固体,Z是S元素;
M是Cl元素。
原子核外电子层数越多,原子半径越大;
同一周期的元素,原子序数越大,原子半径就越小,所以原子半径Y>
X,A项错误。
元素的最高价含氧酸的酸性越强,其非金属性就越强,由于高氯酸的酸性最强,因此在这四种元素中非金属性最强的是M,B项错误。
Z是S元素,Z的氧化物对应的水化物也可能是H2SO3,H2SO3属于弱酸,C项错误。
化合物XM4是CCl4,CCl4是甲烷和氯气在光照下发生取代反应生成的,D项正确。
3.(2019年河北衡水中学二模)几种短周期元素的原子半径及主要化合价如表所示:
元素符号
原子半
径/nm
0.160
0.143
0.070
0.066
主要化
合价
+2
+3
+3,+5,
-3
-2
下列有关叙述正确的是( )。
A.四种元素位于元素周期表的同一周期
B.电解X的氯化物的水溶液可以得到单质X
C.Y的最高价氧化物对应的水化物既能溶解在盐酸中,又能溶解在氨水中
D.W、Z的氢化物均多于1种
解析▶ 根据原子半径及主要化合价的变化规律可知,X、Y、Z、W分别为Mg、Al、N、O元素。
四种元素不在同一周期,A项错误;
电解氯化镁溶液得到氢氧化镁沉淀,得不到镁单质,制备镁单质需电解熔融的氯化镁,B项错误;
Y的最高价氧化物对应的水化物是氢氧化铝,其不溶于氨水,C项错误;
O的氢化物有H2O和H2O2,N的氢化物有NH3和N2H4,氢化物均多于1种,D项正确。
4.(2019年河北示范性高中4月联考)四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,X原子的内层电子数与最外层电子数之比为2∶5,Z和W位于同一周期。
Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解熔融的该化合物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子数与阳离子数之比均为1∶2。
A.四种元素中至少有两种金属元素
B.四种元素的常见氢化物中熔点最高的是Z的氢化物
C.四种元素形成的简单离子中,离子半径最小的是元素Y形成的离子
D.常温下,X、Y、Z三种元素形成的化合物的水溶液的pH小于7
解析▶ 根据题意可知,X、Y、Z、W分别为N、O、Na、Cl元素。
四种元素中只有钠元素为金属元素,A项错误;
氢化钠为离子化合物,四种元素的常见氢化物中熔点最高的是Z的氢化物,B项正确;
四种元素形成的简单离子中,离子半径最小的是元素Z形成的Na+,C项错误;
X、Y、Z三种元素形成的化合物为NaNO3或NaNO2,若为NaNO3溶液,则呈中性,pH等于7,若为NaNO2溶液,则N
水解溶液呈碱性,pH大于7,D项错误。
5.(2019年福建厦门第二次质量检查)主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。
W、X、Z原子的最外层电子数之和为9;
W与Y同族;
W与Z形成的离子化合物可与水反应,其生成的气体可使酸性高锰酸钾溶液褪色。
A.生物分子是以W为骨架构成的
B.X的氧化物常用于焊接钢轨
C.Z的硫化物常用于点豆腐
D.Y的氧化物是常见的半导体材料
解析▶ 由已知条件可知,W为C元素,X为Al元素,Y为Si元素,Z为Ca元素。
生物分子是以碳链为骨架构成的分子,A项正确;
X的氧化物为氧化铝,不能用于焊接钢轨,B项错误;
一般选硫酸钙点豆腐,C项错误;
硅单质是常见的半导体材料,D项错误。
6.(2019年武汉武昌5月调研)W、X、Y和Z为原子序数依次增大的四种短周期元素,它们的原子最外层电子数之和为20。
W与Y元素同主族,且形成的化合物可用于漂白织物。
下列说法正确