版导与练一轮复习化学习题第四章 非金属及其化合物 第13讲 富集在海水中的元素Word文件下载.docx
《版导与练一轮复习化学习题第四章 非金属及其化合物 第13讲 富集在海水中的元素Word文件下载.docx》由会员分享,可在线阅读,更多相关《版导与练一轮复习化学习题第四章 非金属及其化合物 第13讲 富集在海水中的元素Word文件下载.docx(12页珍藏版)》请在冰豆网上搜索。
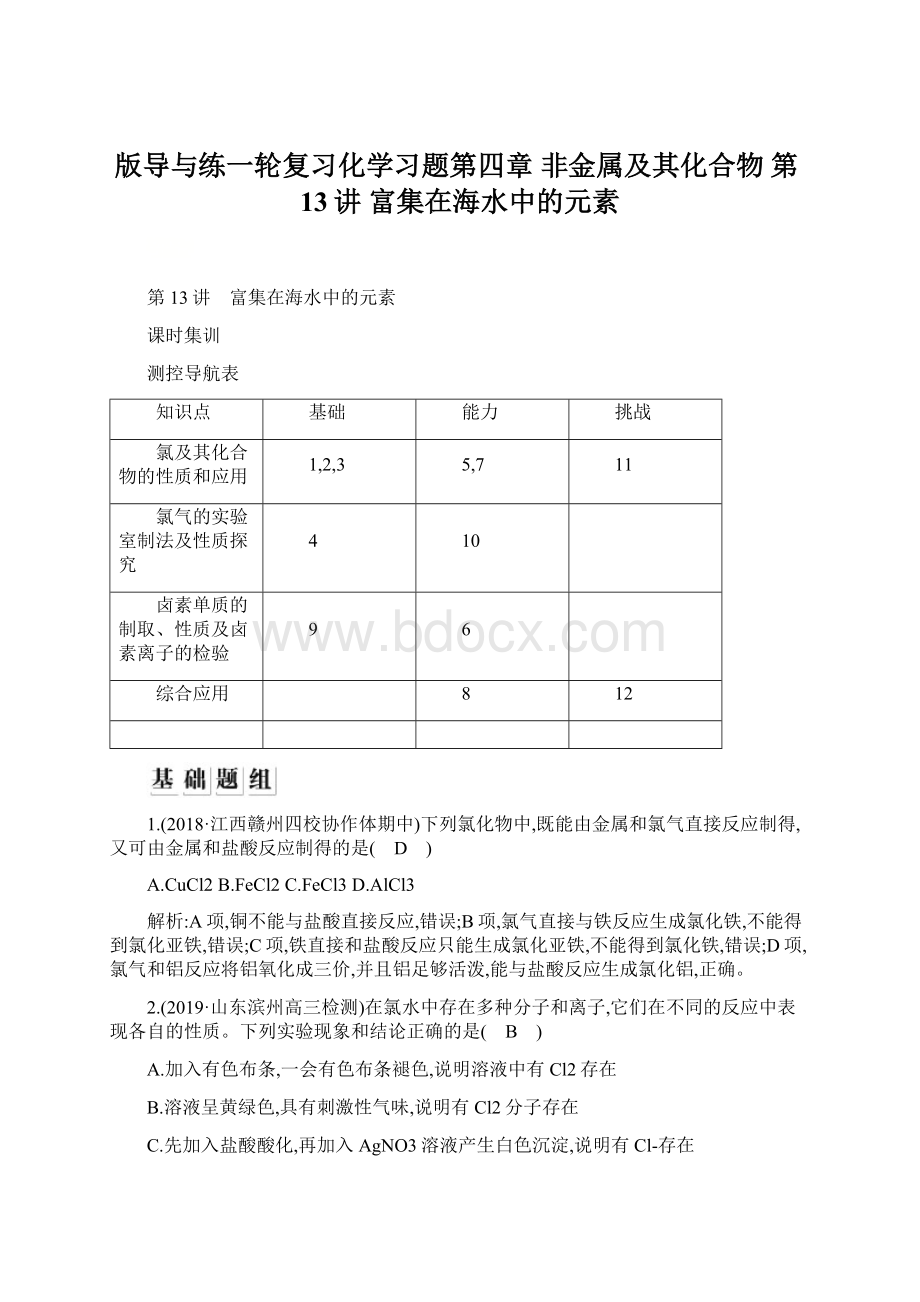
A.加入有色布条,一会有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,具有刺激性气味,说明有Cl2分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
向氯水中加入有色布条,一会有色布条褪色,说明溶液中有HClO存在,故A错误;
氯气是黄绿色有刺激性气味的气体,氯水呈黄绿色,且有刺激性气味,说明有Cl2分子存在,故B正确;
盐酸中含有氯离子,向氯水中加入盐酸后再加入硝酸银溶液一定会生成氯化银白色沉淀,但不能说明氯水中含有氯离子,故C错误;
Cl2+H2O
HCl+HClO是可逆反应,向氯水中加入氢氧化钠溶液,盐酸和次氯酸均可与NaOH反应,不能证明含有HClO,故D错误。
3.(2018·
辽宁师范大学附属中学期中)向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( A )
A.碳酸钙粉末B.稀硫酸
C.氯化钙溶液D.二氧化硫水溶液
氯水中存在反应:
H++Cl-+HClO,若要增强溶液漂白能力,则需使溶液中HClO浓度增大。
A项,加入碳酸钙粉末,发生反应:
2H++CaCO3
Ca2++H2O+CO2↑,使上述可逆反应平衡向右移动,c(HClO)增大,故可以;
B项,加入稀硫酸,溶液中c(H+)增大,上述可逆反应平衡向左移动,c(HClO)减小,故不可以;
C项,加入氯化钙溶液,溶液中c(Cl-)增大,上述可逆反应平衡向左移动,c(HClO)减小,故不可以;
D项,加入二氧化硫水溶液,二氧化硫具有还原性,能被氯气氧化且生成H2SO4,电离出大量H+,使上述可逆反应平衡向左移动,c(HClO)减小,故不可以。
4.(2018·
江西南昌模拟)如图是实验室制备氯气并进行一系列相关实验的装置(夹持装置已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,则相关反应的化学方程式为
。
(2)装置B中饱和食盐水的作用是 ;
同时装置B也是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象:
。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入 (填字母)。
a
b
c
d
Ⅰ
干燥的有色布条
干燥的有色布条
湿润的有色布条
Ⅱ
碱石灰
硅胶
浓硫酸
无水氯化钙
Ⅲ
湿润的有色布条
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。
当向D装置中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为 色,说明氯的非金属性强于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡后静置。
观察到的现象是
(1)根据氧化还原反应的规律,次氯酸钙与浓盐酸反应生成氯化钙、氯气与水,反应的化学方程式为Ca(ClO)2+4HCl(浓)
CaCl2+2Cl2↑+2H2O。
(2)浓盐酸易挥发,反应制取的氯气中含有HCl,装置B中饱和食盐水的作用是除去Cl2中的HCl;
若装置C发生堵塞,装置B中的压强会增大,长颈漏斗中液面上升,形成水柱。
(3)验证氯气是否具有漂白性,要对比验证干燥氯气和湿润氯气有无漂白性,因此Ⅰ处应为湿润的有色布条,Ⅱ处应为干燥剂,Ⅲ处应为干燥的有色布条,U形管中应用固体干燥剂。
(4)当向装置D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为棕黄色,发生反应:
Cl2+2NaBr
2NaCl+Br2。
(5)打开活塞,将装置D中含Br2的少量溶液加入装置E中,发生反应:
Br2+2KI
2KBr+I2,碘单质溶于苯呈紫红色,振荡后静置,观察到的现象是装置E中溶液分为两层,上层(苯层)为紫红色。
答案:
(1)Ca(ClO)2+4HCl(浓)
CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl 长颈漏斗中液面上升,形成水柱
(3)d
(4)棕黄
(5)装置E中溶液分为两层,上层(苯层)为紫红色
5.(2018·
天津高三检测)在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( C )
A.再通入少量氯气,
减小
B.通入少量SO2,溶液漂白性增强
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强
D.光照过程中,有气泡冒出,溶液的导电性减弱
饱和氯水不能再溶解氯气,各成分的浓度不变,A项错误;
SO2+Cl2+2H2O
2HCl+H2SO4,Cl2+H2O
H++Cl-+HClO的平衡左移,HClO的浓度减小,漂白性减弱,B项错误;
加入少量的碳酸钠粉末,消耗H+,使上述平衡正向移动,HClO的浓度增大,C项正确;
光照过程中,HClO分解,生成O2和HCl,溶液中的离子浓度增大,导电性增强,D项错误。
6.(2018·
山东济南第一中学期中)反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应,下列说法正确的是( D )
①2NaI+MnO2+3H2SO4
2NaHSO4+MnSO4+2H2O+I2;
②2NaIO3+5NaHSO3
2Na2SO4+3NaHSO4+H2O+I2
A.两个反应中NaHSO4均为氧化产物
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:
MnO2>
S
>
I
I2
D.反应①、②中生成等量的I2时转移电子数比为1∶5
分别对反应①②进行分析,反应①为
反应②为
。
A项,反应①中S元素的化合价没有变化,错误;
B项,碘元素在反应①中化合价升高被氧化,在反应②中化合价降低被还原,错误;
C项,根据同一氧化还原反应中,氧化性:
氧化剂>
氧化产物,由反应①得出氧化性:
I2,由反应②得出氧化性:
I
错误;
D项,反应①中生成1molI2转移2mol电子,反应②中生成1molI2转移10mol电子,则反应①②中生成等量I2,转移电子数之比为1∶5,正确。
7.(2018·
甘肃兰州第一中学期中)常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/LNaOH溶液,整个过程中溶液pH的变化如图所示。
下列有关叙述正确的是( C )
A.溶液中c(HClO)的大小关系:
①处大于②处
B.可依据②处数据计算所溶解的n(Cl2)
C.曲线③④段有离子反应:
HClO+OH-
ClO-+H2O
D.③处表示氯水与氢氧化钠溶液恰好反应完全
②点之前Cl2与H2O反应生成HCl和HClO,②点时氯气的溶解达到饱和,即氯气与水反应生成的次氯酸最多,所以溶液中c(HClO)的大小关系:
①处小于②处,故A错误;
②点处Cl2溶于水达到饱和,由②处的pH可求出氢离子的浓度,但氯气溶于水并不是全部与水反应,所以无法计算所溶解的n(Cl2),故B错误;
由题图看出③处pH=7,此时溶液中溶质为NaCl、NaClO、HClO,所以③④段有化学反应:
HClO+NaOH
NaClO+H2O发生,其离子方程式为HClO+OH-
H2O+ClO-,故C正确;
Cl2与NaOH恰好完全反应时产物为NaCl、NaClO,溶液显碱性,pH不等于7,故D错误。
8.(2018·
河北衡水检测)已知BrCl能发生下列反应:
nBrCl+2M
MCln+MBrn(M为+n价的金属元素),BrCl+H2O
HCl+HBrO,以下推论不正确的是( D )
A.BrCl具有和卤素单质相似的化学性质
B.BrCl和M反应时,BrCl只作氧化剂
C.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐
D.将BrCl跟FeSO4溶液反应,溶液会变成无色
依据题目所给两个反应,可以推出“BrCl具有和卤素单质相似的化学性质”——与金属单质反应得到盐、与H2O反应得到HCl和HBrO。
但反应方程式相似的背后,卤素互化物BrCl又与卤素单质有区别——BrCl中Br呈+1价、Cl呈-1价,所以当BrCl与金属M反应时,BrCl只作氧化剂。
BrCl跟硫酸亚铁溶液反应时,会将二价铁离子氧化为三价铁离子,故溶液会变为棕黄色,D不正确。
9.(2018·
北京石景山区一模)从某含Br-废水中提取Br2的过程包括:
过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。
已知:
物质
Br2
CCl4
正十二烷
密度/(g·
cm-3)
3.119
1.595
0.753
沸点/℃
58.76
76.8
215~217
下列说法不正确的是( C )
A.甲装置中Br-发生的反应为2Br-+Cl2
Br2+2Cl-
B.甲装置中NaOH溶液每吸收0.1molCl2,转移0.1mole-
C.用乙装置进行萃取,溶解Br2的有机层在下层
D.用丙装置进行蒸馏,先收集到的是Br2
氯气的氧化性大于溴,所以2Br-+Cl2
Br2+2Cl-,A正确;
1molCl2与足量的碱液反应转移1mol电子,甲装置中NaOH溶液每吸收0.1molCl2,转移0.1mole-,B正确;
用正十二烷进行萃取溴,由于正十二烷密度小于水,所以溶解Br2的有机层在上层,C不正确;
无论正十二烷还是CCl4的沸点均大于溴的沸点,所以用丙装置进行蒸馏,先收集到的是Br2,D正确。
10.某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备氯气,并对氯气的性质进行探究。
(1)写出实验室制氯气的化学方程式:
欲制取并收集一瓶干燥的氯气,则“制取→收集”的实验装置连接顺序为 →c→d→ →i→j→k。
(2)装置C中饱和食盐水的作用是 。
(3)该小组同学对氯气性质进行如下探究:
实验步骤
实验结论
①将氯气通入NaCl溶液中,再加入1mLCCl4振荡,静置,观察四氯化碳层颜色
氧化性从强到弱的顺序:
氯、溴、碘
②将氯气通入KBr溶液中,再加入1mLCCl4振荡,静置,观察四氯化碳层颜色
③将氯气通入KI溶液中,再加入1mLCCl4振荡,静置,观察四氧化碳层颜色
该小组的实验设计缺陷是 ,
改进的办法是
(4)常温下,高锰酸钾固体和浓盐酸反应也可制得氯气,该反应的离子方程式为
(5)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与Cl
的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的质量之比为 。
(3)该实验能证明氯气的氧化性大于溴、碘,但不能证明溴的氧化性大于碘,要想探究卤素单质的氧化性强弱还需要补充一个实验:
KI溶液+溴水+1mLCCl4,振荡,静置,观察四氯化碳层颜色。
(5)Cl2生成ClO-与Cl
是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO-与Cl
的物质的量浓度之比为1∶3,则可设ClO-为1mol,Cl
为3mol,被氧化的Cl共为4mol,失去电子的总物质的量为1mol×
(1-0)+3mol×
(5-0)=16mol,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,Cl2生成NaCl是被还原的过程,化合价由0价降低为-1价,则得到电子的物质的量也应为16mol,则被还原的Cl的物质的量为16mol,所以被还原的Cl和被氧化的Cl的物质的量之比为16mol∶4mol=4∶1。
(1)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
b g→h
(2)除去Cl2中的HCl杂质
(3)不能证明溴的氧化性强于碘 再做一组实验,步骤为:
KI溶液中,加入溴水,再加入1mLCCl4振荡,静置,观察CCl4层颜色
(4)2Mn
+16H++10Cl-
2Mn2++5Cl2↑+8H2O
(5)4∶1
11.(2018·
河北衡水中学二调)已知:
将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且
的值与温度高低有关。
当n(KOH)=amol时,下列说法不正确的是( B )
A.参加反应的氯气的物质的量等于
amol
B.改变温度,产物中KClO3的最大理论产量为
C.改变温度,反应中转移电子的物质的量n(e-)的范围为
amol≤n(e-)≤
D.若某温度下,反应后
=11,则溶液中
=
根据原子守恒n(KOH)=amol=n(K)=n(Cl)=2n(Cl2),则n(Cl2)=
amol,A正确;
改变温度,产物中KClO3的最大理论产量即无KClO生成,发生如下反应:
3Cl2+6KOH
5KCl+KClO3+3H2O,则KClO3的物质的量为
amol,B不正确;
当全部生成KCl、KClO时发生的反应为Cl2+2KOH
KCl+KClO+H2O,则n(e-)=
amol,同理,当全部生成KCl、KClO3时发生的反应为3Cl2+6KOH
5KCl+KClO3+3H2O,则n(e-)=
amol,综上可得改变温度,反应中转移电子的物质的量n(e-)的范围:
amol,C正确;
若反应后
=11,令KCl、KClO分别为11mol、1mol,据得失电子守恒可得KClO3为2mol,则溶液中
D正确。
12.(2018·
辽宁沈阳东北育才学校模拟)卤族元素在化学中有着极为广泛的应用。
Ⅰ.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异。
(1)化学家研究发现,SbF5能与[MnF6]2-反应得到MnF4,SbF5转化成稳定离子[SbF6]-的盐。
而MnF4很不稳定,受热易分解为MnF3和F2。
根据以上研究写出以K2MnF6和SbF5为原料,在423K的温度下制备F2的化学方程式:
(2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是
(3)HF的水溶液是氢氟酸,能用于蚀刻玻璃,其化学反应方程式为
Ⅱ.实验室常用高锰酸钾固体与浓盐酸反应制备氯气。
将0.08molKMnO4固体加热一段时间后,收集到amolO2;
向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请根据上述描述写出K2MnO4与浓盐酸反应制氯气的离子反应方程式:
(2)通过上述文字中提供的数据计算出a+b的范围为 。
Ⅲ.ClO2可替代Cl2作为自来水消毒剂。
常用“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:
每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
则ClO2的有效氯含量为 。
(计算结果保留两位小数)
Ⅰ.
(1)根据题意可知化学方程式为K2MnF6+2SbF5
2KSbF6+MnF4,2MnF4
2MnF3+F2↑,MnF4不稳定,则在423K下制备F2的化学方程式为2K2MnF6+4SbF5
4KSbF6+2MnF3+F2↑。
(2)氢气与氟气能发生剧烈反应,发生爆炸,所以电解制氟时,要用镍铜合金隔板将两种气体产物严格分开。
(3)玻璃的主要成分为SiO2,SiO2与HF反应的化学方程式为SiO2+4HF
SiF4↑+2H2O。
Ⅱ.
(1)KMnO4受热分解生成K2MnO4、MnO2和O2,根据题意K2MnO4与浓盐酸反应产生Cl2,K2MnO4被还原成Mn2+,反应可写成:
Mn
+Cl-+H+
Mn2++Cl2↑+H2O,Mn元素的化合价由+6价降至+2价,Cl元素的化合价由-1价升至0价,根据得失电子守恒配平方程式,Mn
+4Cl-+H+
Mn2++2Cl2↑+H2O,结合原子守恒和电荷守恒,写出离子方程式为Mn
+8H++4Cl-
Mn2++2Cl2↑+4H2O。
(2)在整个过程中KMnO4中所有Mn元素的化合价都由+7价降为+2价,分解过程中的氧化产物为O2,与浓盐酸反应的氧化产物为Cl2,根据得失电子守恒,0.08mol×
5=4n(O2)+2n(Cl2),4a+2b=0.4。
若KMnO4没有分解,a=0,b=0.2,a+b=0.2;
若KMnO4完全分解,根据方程式:
2KMnO4
K2MnO4+MnO2+O2↑,a取最大值0.04,则b=0.12,a+b=0.16,则a+b的取值范围为0.16≤a+b<
0.2。
Ⅲ.由ClO2
Cl-可知,1gClO2得到电子物质的量为
×
5,根据“有效氯含量”的定义,
2=
5,解得:
m(Cl2)=2.63g,则ClO2的有效氯含量为2.63。
Ⅰ.
(1)2K2MnF6+4SbF5
4KSbF6+2MnF3+F2↑
(2)氟气和氢气能发生剧烈反应,引发爆炸
(3)SiO2+4HF
SiF4↑+2H2O
Ⅱ.
(1)Mn
+8H++4Cl-
Mn2++2Cl2↑+4H2O
(2)0.16≤a+b<
0.2
Ⅲ.2.63