浙江高考一轮 专题7 第2单元 化学反应的方向和限度文档格式.docx
《浙江高考一轮 专题7 第2单元 化学反应的方向和限度文档格式.docx》由会员分享,可在线阅读,更多相关《浙江高考一轮 专题7 第2单元 化学反应的方向和限度文档格式.docx(20页珍藏版)》请在冰豆网上搜索。
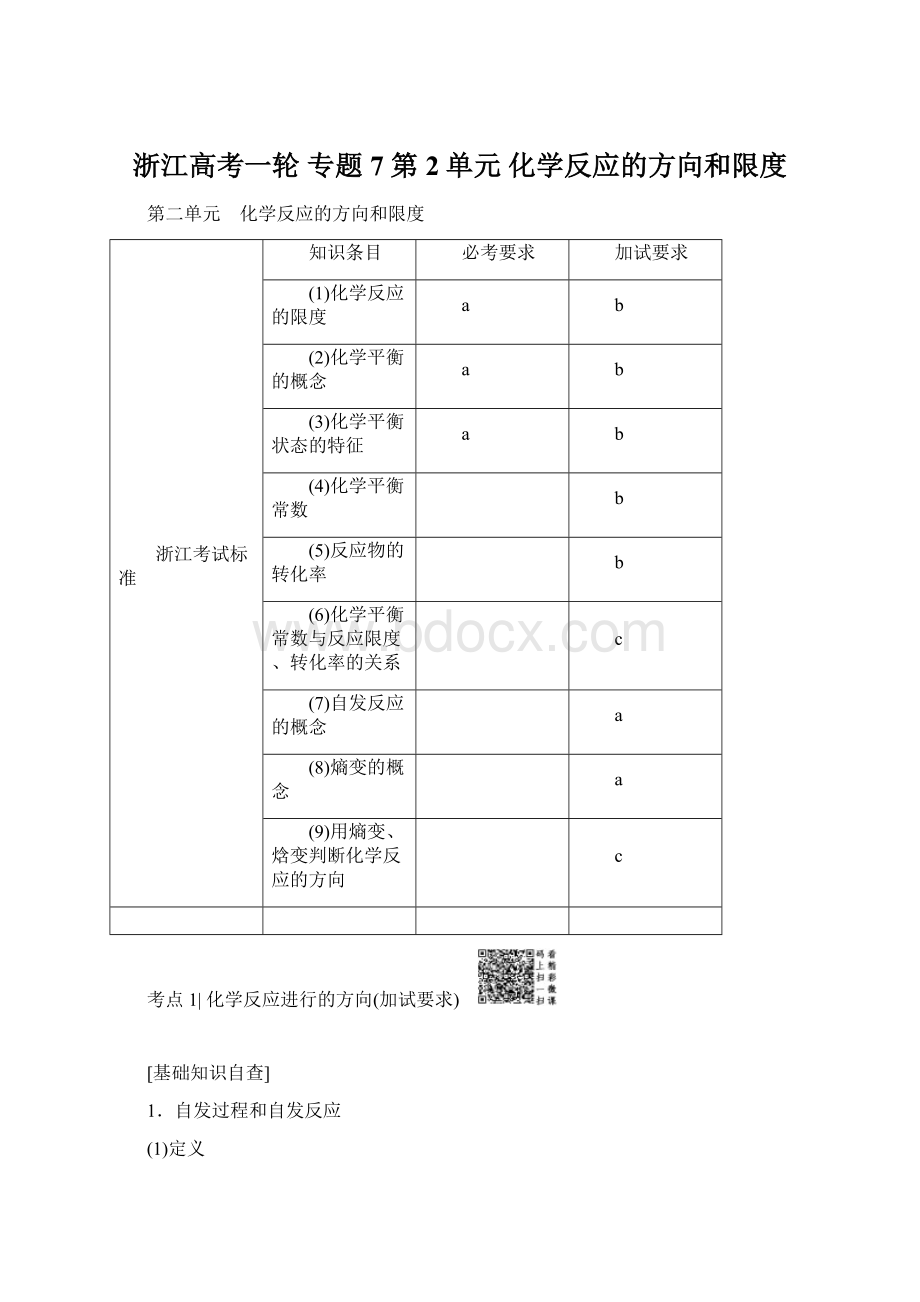
S(l)>
S(s)。
(3)熵变与化学反应方向的关系:
化学反应的ΔS越大,越有利于反应自发进行。
4.焓变与熵变对化学反应方向的共同影响
体系能量降低和混乱度增大都有促使反应自发进行的倾向。
判断反应的自发性必须综合考虑反应的焓变和熵变。
在恒温、恒压时,
(1)ΔH<
0,ΔS>
0,则反应一定能自发进行;
(2)ΔH>
0,ΔS<
0,则反应一定不能自发进行;
(3)ΔH<
0或ΔH>
0,反应可能自发进行,也可能不自发进行,与反应的温度有关。
[核心要点提升]
化学反应方向的综合判据(加试内容)
影响反应自发性的因素是焓变(ΔH)、熵变(ΔS)和温度(T)。
要正确判断一个化学反应能否自发进行,必须综合考虑ΔH、ΔS和T这三个因素。
在恒温恒压时,有如下判据:
具体可表示为:
类型
ΔH
ΔS
反应的自发性
1
<
>
一定能自发进行(ΔH-TΔS<
0)
2
一定不能自发进行(ΔH-TΔS>
3
反应的自发性随温度的变化而改变。
ΔH<
0、ΔS<
0的反应通常在低温下自发进行(此时ΔH-TΔS<
0),ΔH>
0、ΔS>
0的反应通常在高温下自发进行(此时ΔH-TΔS<
4
这个判据用文字可表述为:
在温度、压强一定的条件下,自发反应总是向ΔH-TΔS<
0的方向进行,直到达到平衡状态。
【特别提醒】
(1)反应能否自发进行需综合考虑焓变和熵变对反应的影响。
(2)化学反应方向的判据指出的仅仅是在一定条件下化学反应自发进行的趋势,并不能说明在该条件下反应一定能实际发生,还要考虑化学反应的快慢问题。
[典型例题讲解]
已知:
(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=74.9kJ·
mol-1,下列说法中正确的是( )
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于0
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定能自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
【解析】 (NH4)2CO3自发分解是因为体系生成氨气使熵增大。
吸热反应焓变大于零,熵增加反应熵变大于零,则ΔH-TΔS不一定小于零,因此吸热的熵增加反应不一定能自发进行。
焓变不是决定反应方向的唯一因素,能自发进行的反应不一定是放热反应,不能自发进行的反应也不一定是吸热反应。
【答案】 B
[题组对点训练]
1.下列关于化学反应焓变的叙述中,正确的是( )
A.化学反应的焓变与反应的方向性无关
B.化学反应的焓变直接决定了反应的方向
C.焓变为正的反应都是吸热反应
D.焓变为正的反应都能自发进行
C [反应能否自发进行(方向性)是由ΔH-TΔS决定的,与ΔH、ΔS和T都有关。
焓变只表达化学反应是释放能量还是吸收能量,不能用来独立判断反应的自发性。
]
2.下列说法中不正确的是( )
A.体系有序性越高,熵值就越低
B.自发过程可能导致体系的熵增大
C.吸热反应不可以自发进行
D.同种物质气态时熵值最大
C [反应能否自发进行,主要由自由能来决定,从公式ΔG=ΔH-TΔS可知ΔG<
0(为负值)时,反应能自发进行;
如果是吸热反应,ΔH为正值,ΔG的正负取决于TΔS的大小。
3.已知反应FeO(s)+CO(g)===CO2(g)+Fe(s)的ΔH为正,ΔS为正(假定它们都不会随温度的改变而改变),下列叙述中正确的是( )
A.低温下为自发过程,高温下为非自发过程
B.低温下为非自发过程,高温下为自发过程
C.任何温度下均为非自发过程
D.任何温度下均为自发过程
B [该反应ΔH>
0,根据化学反应方向的判据ΔH-TΔS<
0可知,ΔH-TΔS与0的大小关系受温度影响,T越大,ΔH-TΔS越小,因此该反应低温下为非自发反应,高温下为自发反应。
4.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)===N2(g)+2CO2(g)。
由此可知,下列说法中正确的是( )
A.该反应是熵增大的反应
B.该反应不能自发进行,因此需要合适的催化剂
C.该反应常温下能自发进行,催化剂条件只是加快反应的速率
D.该反应常温下能自发进行,因为正反应是吸热反应
C [只使用催化剂便可使尾气发生转化,故此反应能自发进行。
因反应是气体物质的量减小的反应,故熵减小。
因熵减小不利于反应自发,故自发进行的原因是反应放热。
考点2|可逆反应 化学平衡状态
1.可逆反应
2.化学平衡状态
(1)概念
一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的浓度保持不变的状态。
(2)建立过程
从正反应开始建立 从逆反应开始建立
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。
反应过程如下:
(3)特点
[核心要点提升]
判断可逆反应是否达到化学平衡状态,主要抓住两个标志,即化学平衡的两个特征——“等”和“定”。
1.“等”——v正=v逆。
指的是用同一物质表示的正、逆反应速率相等。
2.“定”——即达到平衡状态时,反应混合物中各组分的百分含量一定。
“百分含量”可能会被“物质的量”“物质的量浓度”“密度”“压强”“平均相对分子质量”“温度”“颜色”等代替。
以mA(g)+nB(g)pC(g)+qD(g)为例列表分析如下:
【特别提醒】 判断可逆反应是否达到平衡状态的物理量有很多,只要抓住“变量不变”即可——如果所给的那个物理量随着反应的进行是一个变量,在某时间段不变,就可以说明反应达到平衡状态;
如果该物理量始终是一个定值,就不能作为判断的依据。
(2016·
浙江10月选考试题)在一定条件下,可逆反应X(g)+2Y(g)2Z(g) ΔH=-akJ·
mol-1达到化学平衡时,下列说法一定正确的是
( )
A.反应放出akJ热量
B.X和Y的物质的量之比为1∶2
C.反应物和生成物的浓度都不再发生变化
D.X的正反应速率等于Z的逆反应速率
【解析】 不能确定参加反应的反应物的量多少,无法确定反应放出热量的多少,A错误;
没有指明投料的量,不能确定二者含有的物质的量的关系,B错误;
可逆反应达到平衡时反应体系的各物质的浓度都不会发生变化,C正确;
反应达到平衡时X的正反应速率与Z的逆反应速率的比是1∶2,D错误。
【答案】 C
(1)化学反应达到化学平衡状态的正逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等。
(2)化学反应达平衡状态时,各组分的浓度、百分含量保持不变,但不一定相等。
在密闭容器中进行反应:
X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·
L-1、0.3mol·
L-1、0.2mol·
L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
【导学号:
81640102】
A.Z为0.3mol·
L-1 B.Y2为0.4mol·
L-1
C.X2为0.2mol·
L-1D.Z为0.4mol·
【解析】 假设反应正向进行到底:
X2(g)+Y2(g)2Z(g)
起始浓度(mol·
L-1)0.10.30.2
改变浓度(mol·
L-1)0.10.10.2
终态浓度(mol·
L-1)00.20.4
假设反应逆向进行到底:
L-1)0.20.40
平衡体系中各物质的浓度范围为0<
X2<
0.2,0.2<
Y2<
0.4,0<
Z<
0.4。
【答案】 A
极端假设法确定各物质物理量的范围
可逆反应中各物质的物理量(浓度、物质的量、体积、质量等),可运用极端假设法判断:
假设反应正向或逆向进行彻底,求出各物质物理量的极大值和极小值,从而确定它们有关物理量的范围。
注意:
反应物物理量范围的最小值对应生成物的最大值;
反应物物理量范围的最大值对应生成物的最小值。
1.(2017·
浙江嘉兴一中月考)可逆反应在一定条件下达到化学平衡时,下列说法正确的是( )
A.正反应速率等于逆反应速率,且都为零
B.反应物和生成物的浓度相等
C.反应体系中混合物的组成保持不变
D.断开化学键吸收的能量等于形成化学键所放出的能量
C [化学平衡是动态平衡,达到平衡时正反应速率等于逆反应速率,且都不等于零,A错误;
反应物和生成物的浓度不变,但不一定相等,B错误;
反应体系中混合物的组成保持不变,表示达到化学平衡状态,C正确;
化学反应中一定存在热量的变化,断开化学键吸收的能量一定不等于形成化学键所放出的能量,D错误。
2.在2L密闭容器中充入2molSO2和一定量O2,发生反应2SO2(g)+O2(g)2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为( )
A.1.6molB.1.2mol
C.大于1.6molD.小于1.2mol
D [已知条件下,4min时n(SO2)=0.4mol,是反应消耗之后剩余的SO2的量,而反应消耗的n消(SO2)=(2-0.4)mol=1.6mol。
从0min至4min时,速率是变化的,开始时反应物的浓度较大,随着反应进行,反应物的浓度逐渐变小,因此从0min至4min时,前2min的反应速率比后2min的大,前2min消耗SO2的量大于0.8mol,因此反应进行到2min时容器中SO2剩余的量小于1.2mol。
3.(2017·
浙江杭州学军中学月考)一定温度下,在一固定体积的密闭容器中,可逆反应A(s)+3B(g)2C(g)达到平衡时,下列说法中正确的是( )
①C的生成速率与C的分解速率相等;
②单位时间内生成amolA,同时消耗3amolB;
③容器中气体的密度不再变化;
④混合气体的总压强不再发生变化;
⑤A、B、C的物质的量之比为1∶3∶2;
⑥混合气体的平均相对分子质量不再发生变化。
A.②④⑤ B.①②③④⑥
C.①②④⑥D.①②③④⑤
B [①是化学平衡状态的本质;
②在任何状态下都成立;
③达到平衡时,气体的总质量不变,恒容时气体密度不变;
④达到平衡状态时,压强不变,说明气体的总物质的量不变;
⑤A、B、C三种物质的量之比与起始投料比有关,平衡时不一定是1∶3∶2;
⑥根据M=
,平衡时m(气)、n(气)不变,平均相对分子质量不变。
4.(2017·
浙江温州质检)可逆反应:
2NO22NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤D.全部
A [①中单位时间内生成nmolO2的同时生成2nmolNO2,生成O2描述的是v正,生成NO2描述的是v逆,并且速率之比等于化学计量数之比,依据v正=v逆≠0,可判断达到平衡状态,所以正确。
②中生成O2和生成NO描述的均是v正,无法判断反应是否达到平衡,所以错误。
③中无论反应是否达到平衡,均有此关系,所以错误。
④中NO2为有颜色的气体(红棕色),混合气体的颜色不再改变能说明反应体系中NO2浓度不变,可判断已达到化学平衡状态,所以正确。
⑤中因ρ=
,反应前后m、V均不变,ρ也不变,不能说明反应达到平衡,所以错误。
⑥中压强不变表示浓度不变,这是一个反应前后气体体积不相等的反应,可判断反应已达到平衡状态,所以正确。
⑦中
=
,m始终不变,若
不变,则表示混合气体的总物质的量保持不变,可判断已达到平衡状态,所以正确。
综上所述,A选项正确。
5.在两个恒温、恒容的密闭容器中进行下列两个可逆反应,甲:
2X(g)Y(g)+Z(s),乙:
A(g)+B(g)C(g)+D(g),当下列物理量不再发生变化时,
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比
④混合气体的压强
⑤混合气体的总物质的量
其中能表明甲达到化学平衡状态的是________;
能表明乙达到化学平衡状态的是________。
【解析】 甲反应有固体物质生成。
①中平衡向右移时,固体质量增加,气体质量减小,混合气体的密度减小;
当密度不变时,X、Y的浓度不变,达到化学平衡状态。
②中Y的百分含量不变,达到化学平衡状态。
③中正、逆反应速率相等,达到化学平衡状态。
④中平衡右移时,混合气体的压强减小,压强不变,说明X、Y的量不变,达到化学平衡状态。
⑤中平衡右移时,气体的总物质的量减小;
气体的总物质的量不变,达到化学平衡状态。
乙反应中都是气体,且反应前后气体化学计量数之和相等。
①中不论反应是否达到平衡,密度均不变,不能做判断标准。
②中生成物的百分含量不变,达到化学平衡状态。
③中说明正、逆反应速率相等,达到化学平衡状态。
④中无论反应是否达到化学平衡状态,气体的压强均不变,不能做判断标准。
⑤中无论反应是否达到化学平衡状态,气体的总物质的量均不变,不能做判断标准。
【答案】 ①②③④⑤ ②③
考点3|化学平衡常数,化学平衡相关计算(加试要求)
1.化学平衡常数
(1)概念:
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。
(2)表达式:
对于反应mA(g)+nB(g)pC(g)+qD(g),K=
。
(3)意义:
化学平衡常数的大小反映了化学反应进行的程度。
一般地说,当K>
105时,就认为反应基本进行完全了,当K<
10-5时,认为反应很难进行。
(4)影响因素:
K只受温度影响,与浓度变化无关。
对于吸热反应,升高温度K增大,对于放热反应,升高温度K减小。
2.平衡转化率
对于反应A(g)+B(g)C(g),A(g)的平衡转化率表示为:
α(A)=
×
100%。
[c0(A)代表A的初始浓度,c(A)代表A的平衡浓度]。
1.化学平衡常数的理解
(1)化学平衡常数只与温度有关,与浓度、压强和催化剂等均无关。
(2)在平衡常数表达式中:
水(l)的浓度、固体物质的浓度均不写,但是水蒸气的浓度要写。
(3)平衡常数表达式中各物质的浓度为平衡时的浓度,其书写形式与化学方程式的书写有关。
N2+3H22NH3 K=a,则有2NH3N2+3H2
K′=1/a;
N2+
H2NH3 K″=
2.化学平衡常数的应用
(1)判断、比较可逆反应进行的程度。
一般来说,一定温度下的一个具体的可逆反应:
K值
正反应进行
的程度
平衡时生成
物浓度
平衡时反
应物浓度
反应物
转化率
越大
越小
越高
越低
(2)判断反应的热效应。
(3)计算反应物的转化率。
3.化学平衡计算的方法——“三段式”
“三段式”法是有效解答化学平衡计算题的“万能钥匙”。
解题时,要注意清楚条理地列出起始量、转化量、平衡量,按题目要求进行计算,同时还要注意单位的统一。
(1)计算步骤:
(2)具体方法:
可按下列模式进行计算:
如mA(g)+nB(g)pC(g)+qD(g),令A、B起始物质的量浓度分别为amol·
L-1、bmol·
L-1,达到平衡后消耗A的物质的量浓度为mxmol·
L-1。
mA(g)+nB(g)pC(g)+qD(g)
起始(mol·
L-1) a b 0 0
变化(mol·
L-1)mxnxpxqx
平衡(mol·
L-1)a-mxb-nxpxqx
相关计算:
①平衡常数:
K=
②A的平衡转化率:
α(A)平=
③A的物质的量分数:
w(A)=
④混合气体的密度:
ρ混=
⑤混合气体的平均相对分子质量:
【易错警示】
(1)稀水溶液中进行的反应,虽然H2O参与反应,但是H2O只作为溶剂,不能代入平衡常数表达式。
如NH4Cl+H2ONH3·
H2O+HCl的平衡常数表达式为K=
(2)化学平衡发生移动,反应物的转化率发生变化,平衡常数不一定发生变化。
但是若平衡常数发生变化,则平衡一定发生移动。
(3)同一化学反应,可以用不同的化学方程式表示,每个化学方程式都有自己的平衡常数表达式及相应的平衡常数。
因此,要注意使用与反应方程式相对应的平衡常教。
(2017·
浙江杭州七校质检)已知反应①CO(g)+CuO(s)CO2(g)+Cu(s)和反应②H2(g)+CuO(s)Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。
则下列说法正确的是( )
81640103】
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2的浓度减小,则该反应为吸热反应
D.对于反应③,恒温恒容下,增大压强,H2的浓度一定增大
【解析】 反应①的平衡常数K1=
,故A错误;
反应①的平衡常数K1=
,反应②的平衡常数K2=
,反应③的平衡常数K=
,故B正确;
对于反应③,恒容时,温度升高,H2的浓度减小,说明升高温度平衡向逆反应方向移动,正反应为放热反应,故C错误;
对于反应③,恒温恒容下,通入稀有气体而使压强增大,平衡不移动,H2的浓度不变,故D错误。
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:
C(s)+CO2(g)2CO(g)。
平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:
气体分压(p分)=气体总压(p总)×
体积分数。
下列说法正确的是( )
A.550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
【解析】 A.550℃时,若充入惰性气体,v正、v逆均减小,由于保持了压强不变,相当于扩大了体积,平衡正向移动,A项错误。
B.根据图示可知,在650℃时,CO的体积分数为40%,根据反应方程式:
C(s)+CO2(g)2CO(g),设开始加入1molCO2,反应掉了xmolCO2,则有:
C(s)+CO2(g)2CO(g)
始态:
1mol 0
变化:
xmol2xmol
平衡:
(1-x)mol2xmol
因此有:
100%=40%,解得x=0.25,则CO2的平衡转化率为
100%=25%,故B项正确。
C.若再充入等体积CO2和CO,体积分数约为50%,平衡不移动,C项错误。
D.925℃时,CO的体积分数为96%,故Kp=
=23.04p总,D项错误。
有关化学平衡计算的三点注意事项
(1)注意反应物和生成物的浓度关系:
反应物:
c(平)=c(始)-c(变);
生成物:
c(平)=c(始)+c(变)。
(2)利用
混=
和
计算时要注意m总应为气体的质量,V应为反应容器的体积,n总应为气体的物质的量。
(3)起始浓度、平衡浓度不一定呈现化学计量数比,但物质之间是按化学计量数反应和生成的,故各物质的浓度变化之比一定等于化学计量数之比,这是计算的关键。
1.在某温度下,可逆反应mA+nBpC+qD的平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变
D.K随温度和压强的改变而改变
A [K是生成物浓度幂之积与反应物浓度幂之积的比值,显然,K越大,反应进行的程度越大,但反应物的转化率不一定越大,A项正确、B项错误;
K只受温度的影响,故C、D项错误。
2.对于可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是( )
A.平衡常数的表达式K=
B.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡
C.若平衡时两种反应物的转化率相等,则起始投入时n(NH3)∶n(O2)=5∶4
D.反应达到平衡后,恒容条件下只调节NH3和NO的量,可保持原平衡状态
D [根据平衡常数的定义和反应的特点,H2O(g)也应计入平衡常数中,即K=
,A项错误;
根据K的表达式可知D项正确;
B项中的关系式在任何时刻都成立,B项错误;
C项中起始投入时n(NH3)∶n(O2)应为4∶5,C项错误。
3.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g) ΔH<
0,一段时间后达到平衡。
反应过程中测定的数据如表所示:
t/min
7
9
n(Y)/mo