届甘肃省中考化学考点复习训练题15Word下载.docx
《届甘肃省中考化学考点复习训练题15Word下载.docx》由会员分享,可在线阅读,更多相关《届甘肃省中考化学考点复习训练题15Word下载.docx(15页珍藏版)》请在冰豆网上搜索。
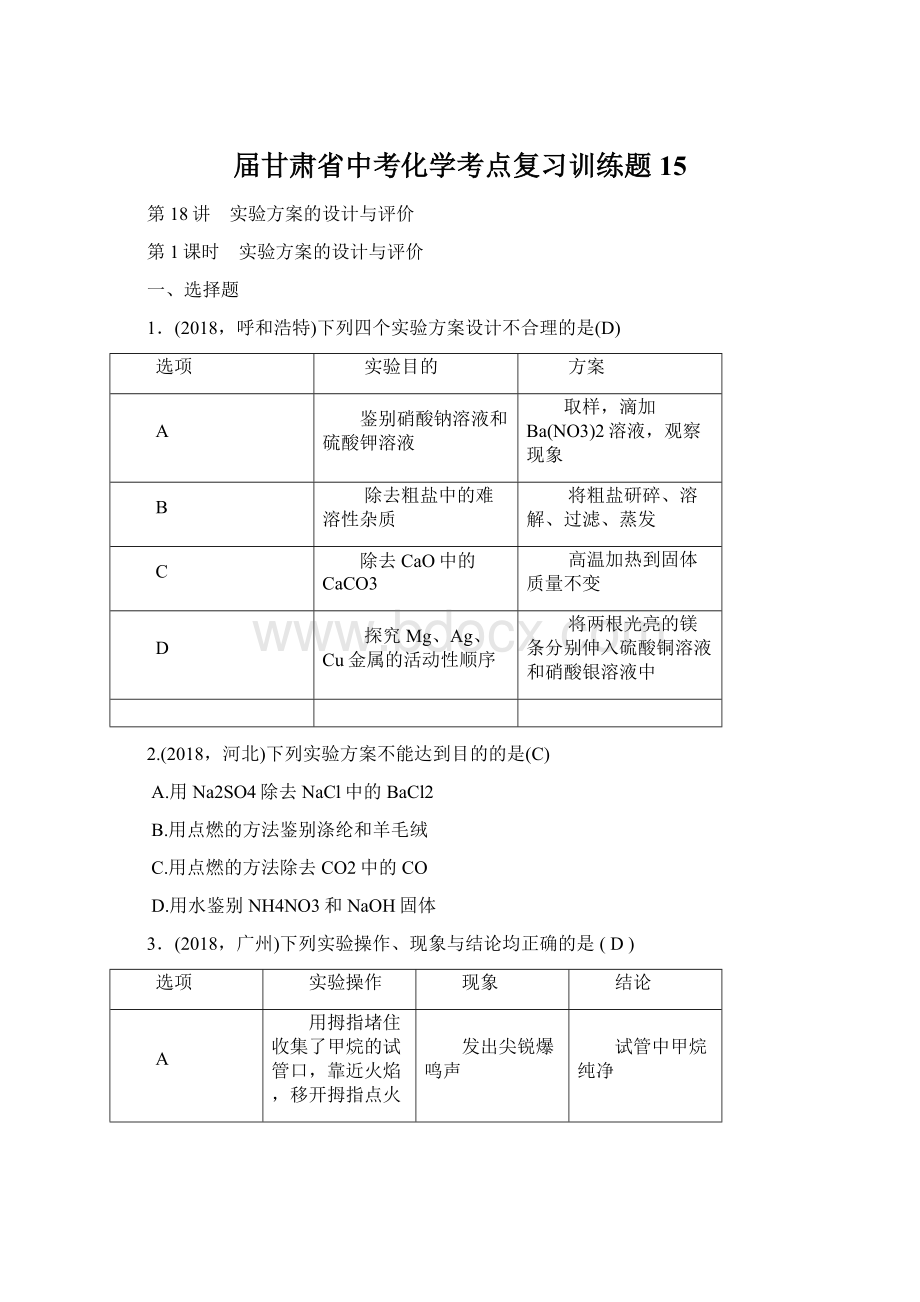
C
把燃着的木条插入某瓶无色气体中
木条熄灭
该瓶中气体一定是二氧化碳
在燃烧匙里放入少量硫,加热,直到燃烧,然后把它伸进充满氧气的集气瓶中
硫在空气中燃烧发出淡蓝色火焰,而在氧气中燃烧更旺,发出紫蓝色火焰
氧气的浓度越大,燃烧越剧烈
4.(2018,南京)除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案可行的是(D)
A.木炭粉(CuO)——在空气中灼烧
B.KCl溶液(CaCl2)——通入过量的CO2气体,过滤
C.NaCl溶液(Na2CO3)——加入适量的澄清石灰水,过滤
D.H2气体(HCl气体)——依次通过足量的NaOH溶液和浓硫酸
5.(2018,陕西)下列实验所对应的两种方案均正确的是(C)
目的
方案一
方案二
除去木炭粉
中的氧化铜
加足量稀盐酸,
过滤
在空气中
充分灼烧
分离NaCl和CaCO3
的混合物
溶解,过滤,
蒸发滤液
加足量稀
盐酸,蒸发
检验稀盐酸和
稀氢氧化钠溶液
分别测溶
液的pH
取样,加
FeCl3溶液
鉴别化肥NH4Cl和
NH4NO3
取样,加水溶
解,观察
取样,加熟
石灰研磨
6.(2018,雅安)通过下列实验操作和现象能得出相应结论的是(D)
实验操作
现象
向收集满CO2的软塑料瓶中加入等体积的食盐水,旋紧瓶盖,振荡
塑料瓶变瘪
CO2能与食盐反应
点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯
烧杯内壁有无色液滴产生
被点燃的气体一定是H2
C
某溶液中加入BaCl2溶液和稀硝酸
有白色沉淀产生
溶液中一定含有硫酸根离子
D
将白磷浸没在热水中,再向热水中的白磷通氧气
通氧气前白磷不燃烧,通氧气后白磷燃烧
氧气是可燃物燃烧的条件之一
7.(2018,泰安)化学兴趣小组的同学利用废铜制取硫酸铜,设计了如下两个方案:
方案一:
Cu
CuO
CuSO4
方案二:
CuSO4 [Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O]
比较上述两个方案,你认为方案一的优点是(A)
①节约能源 ②不产生污染大气的二氧化硫
③提高硫酸的利用率 ④提高铜的利用率
A.②③ B.①②③
C.①③④ D.①②③④
8.(2018,苏州)通过下列图示实验得出的结论中正确的是(B)
A.图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素
B.图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧
C.图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的
D.图4所示实验既可探究可燃物的燃烧条件,又说明红磷不是可燃物
二、填空题
9.(2018,德州)正确选择实验仪器是实验成功的重要保证,如图是实验室中常见的仪器,请用所提供仪器的序号进行填空。
(1)常用于保存液体药品的是⑤;
用作反应容器且能够直接加热的是①。
(2)配制一定溶质质量分数的氯化钠溶液所需的玻璃仪器有②③⑩;
实验室制取二氧化碳的发生装置所需仪器有①⑧⑨。
10.(2018,德州)将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示。
(1)在滴加的过程中,烧杯中溶液的pH逐渐减小(填“增大”“减小”或“不变”)。
(2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是放热(填“放热”或“吸热”)反应。
(3)图中B点时,溶液中的溶质是NaCl(填化学式)。
三、实验探究题
11.(2018,重庆)硫酸厂的废水中因含硫酸而显酸性,需要处理呈中性后才能排放。
某兴趣小组的同学取少量废水按下列步骤进行实验。
第一步:
验证废水酸性,往废水中滴加石蕊试液,石蕊变红,说明废水呈酸性。
第二步:
处理废水,该小组同学设计了以下两个方案。
用熟石灰处理废水,其反应的化学方程式为Ca(OH)2+H2SO4===CaSO4+2H2O;
用BaCl2处理废水,观察到废水中出现白色沉淀。
经过分析,同学们认为方案二没有达到处理废水的目的,因为处理后的废水中含有较多的HCl。
12.(2018,江西)实验中,小红误将氢氧化钠溶液当酸滴加到金属铝中,结果发现也有气泡产生,为了解该气体的成分,实验小组进行了以下探究活动:
【提出猜想】小红猜想是氧气;
小敏猜想是氢气;
小雨猜想是二氧化碳。
其他同学认为小雨猜想是错误的,理由是化学反应前后元素的种类不变,反应前无碳元素,反应后也无碳元素。
【进行实验】利用图Ⅰ所示装置分别进行实验:
(1)小红:
反应一段时间后,将带火星的木条放在a处,观察到带火星的木条不复燃则她的猜想是错误的。
(2)小敏:
①用图Ⅱ所示装置干燥从a导管出来的气体,将管口a与c(填“b”或“c”)端管口连接;
②反应一段时间后,点燃干燥后的气体,通过对现象的分析,得出他的猜想正确。
【得出结论】铝、氢氧化钠和水反应生成氢气和偏铝酸钠(NaAlO2),反应的化学方程式为2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
【交流讨论】有同学认为,小敏的实验方案有欠缺,步骤②存在安全隐患。
理由是氢气具有可燃性,点燃时应先检验纯度。
【反思提升】许多重大科学发现,源自对实验中异常现象的大胆质疑,深入研究。
下列科学成果中,有两项是通过对异常现象研究得出的。
它们是AC(填字母)。
A.波义耳不慎将浓盐酸溅到花瓣上从而发现了酸碱指示剂
B.侯德榜潜心研究制碱技术发明了联合制碱法
C.拉瓦锡深入研究前人忽视的异常现象发现了氧气
D.张青莲主持测定了多种元素相对原子质量的新值
第2课时 科学探究
1.(2018,江西)实验室加热高锰酸钾制氧气,可直接采用的发生装置是(C)
2.(2018,兰州)在下列各项“家庭小实验”中,不能达到预期目的的是(B)
A.品尝——厨房中鉴别白糖和食盐
B.观察——鉴别黄铜和黄金
C.闻气味——鉴别酒精与白醋
D.点燃——鉴别羊毛和涤纶
3.(2018,江西)下列探究燃烧条件的实验中,只能得出燃烧需要氧气结论的是(A)
4.(2018,青岛)控制变量法是实验探究的重要方法。
利用如图所示的实验不能实现的探究目的是(A)
A.甲图中①②对比可探究铁的锈蚀与植物油是否有关
B.甲图中①③对比可探究铁的锈蚀与水是否有关
C.乙可探究可燃物的燃烧是否需要达到一定温度
D.乙可探究可燃物的燃烧是否需要与氧气接触
5.(2018,绵阳)下列实验目的、操作、现象、结论都正确的是(B)
选项
实验目的
实验操作
实验现象
实验结论
测定溶
液pH
用玻璃棒蘸取
待测液滴在用
蒸馏水润湿的
pH试纸上
试纸变为
浅红色
溶液pH
为2
鉴别
NaOH和
在装有等量水
的试管中分别
加入a、b固体
加a的试
管水温升
高,加b的
试管水温
降低
a是
NaOH,
b是
验证燃
烧是否
需要O2
做白磷是否燃
烧的对比实验
前者不燃
烧,后者
燃烧
燃烧需
要O2
比较Al、
Cu的活
泼性
将未经打磨的Al
条放入CuSO4溶
液中
无明显
Al的活
泼性低
于Cu
6.(2018,江西)下列实验方案的设计中,没有正确体现对比这种科学思想的是(D)
比较二氧化碳的含量
研究二氧化锰的催化作用
区分硬水和软水
配制氯化钠溶液
7.(2018,东营)下列实验装置进行的相应实验,达不到实验目的的是(A)
A.用图1所示装置除去CO2中含有的少量HCl气体
B.用图2所示的装置加热蒸发NaCl饱和溶液制备NaCl晶体
C.用图3所示装置制取少量CO2气体
D.在实验室中,用图4所示装置除去少量黄河水中的泥沙
8.(2018,连云港)下列实验中利用提供的方案不能达到目的是(A)
实验目的
实验方案
除去铁粉中混有的少量银粉
用足量稀盐酸溶解后过滤
鉴别纯羊毛织品和涤纶织品
取样灼烧后闻气味
证明分子在不断运动
将一滴红墨水滴入一杯纯净水中
收集二氧化碳时,检验集气瓶是否集满
用一根燃着的木条放在集气瓶口
二、实验探究题
9.(2018,泰安)化学实验是科学探究的重要途径。
请根据下列实验图示回答相关问题:
(1)A是实验室制备气体的发生与收集装置。
用过氧化氢溶液与二氧化锰制取氧气的化学方程式为2H2O2
2H2O+O2↑,制取氧气、二氧化碳可用同样的发生装置,原因是反应物状态及反应条件相同(或都是固体与液体反应,且不需加热),选择收集装置的依据是气体的密度和溶解性;
(2)B实验中设计合理的是①(填“①”或“②”),另一装置设计中存在的问题是②中装置不密闭,生成的二氧化碳逸散空气中,没有称量计入反应后的总质量;
(3)C是定量实验,选择仪器不恰当或操作不规范都会导致实验结果有误差。
实验时选择量筒规格应为50_mL(填“50mL”或“100mL”),称量时砝码与药品位置放反了(1g以下使用游码),所得溶液的质量分数小于(填“小于”“等于”或“大于”)15%。
10.(2018,南充)某校化学兴趣小组同学探究发现:
铜绿[Cu2(OH)2CO3]受热分解后,除生成CO2和水蒸气外,试管中还有一些黑色粉末状固体。
请回答下列问题:
(1)写出标号a的仪器名称集气瓶。
(2)实验室分解铜绿选用的发生装置为B(填序号)。
初中实验室收集CO2也可用E(长进短出),试分析其原因:
二氧化碳的密度比空气大。
(3)若向澄清石灰水中通入少量CO2,可观察到的现象:
澄清石灰水变浑浊。
用化学方程式表达:
Ca(OH)2+CO2===CaCO3↓+H2O。
(4)充分反应后,兴趣小组对试管中的黑色粉末状固体进一步探究。
【提出问题】黑色固体是什么?
【猜想与假设】黑色固体可能是:
Ⅰ.氧化铜;
Ⅱ.炭粉;
Ⅲ.氧化铜与炭粉。
【查阅资料】炭粉和氧化铜均为黑色固体。
炭粉不与稀酸反应,也不溶于稀酸,而氧化铜可与稀酸反应而溶解。
【设计实验方案】向试管中的黑色固体滴加足量的试剂为A(填字母)。
A.H2SO4 B.NaOH C.NaCl D.H2O
完成下列实验报告:
实验现象
黑色固体全部溶解,溶液呈蓝色
猜想Ⅰ正确
黑色固体不溶解,溶液为无色
猜想Ⅱ正确
黑色固体部分溶解,溶液呈蓝色
猜想Ⅲ正确
如果猜想Ⅰ正确,猜想Ⅰ所发生反应的化学方程式为H2SO4+CuO===CuSO4+H2O。
11.(2018,衡阳)“侯氏制碱法”首先得到的是碳酸氢钠,然后将碳酸氢钠加热分解得到产品碳酸钠:
2NaHCO3
Na2CO3+CO2↑+H2O。
碳酸钠露置在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:
Na2CO3+CO2+H2O===2NaHCO3。
某中学化学研究性学习小组对一瓶开启后久置的碳酸钠是否变质及变质程度进行探究。
【提出假设】假设Ⅰ:
完全变质;
Ⅱ没有变质;
假设Ⅲ:
部分变质。
【实验探究】实验一:
取少量样品于试管中,加水溶解后再加入少量CaCl2溶液,产生白色沉淀,说明假设Ⅰ不成立。
反应的化学方程式为Na2CO3+CaCl2===CaCO3↓+2NaCl。
实验二:
取少量样品于试管中,用导管连接后固定在铁架台上,导管的另一端插入澄清石灰水中。
加热样品,有气体产生,澄清石灰水变浑浊,说明假设Ⅱ不成立。
【实验结论】假设Ⅲ成立,样品的成分是NaHCO3和Na2CO3。
【交流反思】欲除去Na2CO3变质后的杂质,最合适的方法是加热。
12.(2018,济宁)
(1)实验室可用草酸(H2C2O4)在浓硫酸的作用下分解制得一氧化碳和二氧化碳(化学方程式为:
H2C2O4
CO2↑+CO↑+H2O)。
用的实验装置如下图所示:
若分别收集一氧化碳和二氧化碳,请回答:
①装置A中,盛放浓硫酸的仪器名称是分液漏斗;
②收集一氧化碳时,打开a、b,关闭c,装置B的作用是吸收混合气体中的二氧化碳。
由于一氧化碳有毒,多余的气体应点燃处理(或用气囊收集)(填写具体处理办法);
③关闭b、打开c,释放出二氧化碳,并通过装置C、D可收集到干燥的二氧化碳气体。
(2)在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水。
哪些因素还影响着过氧化氢分解的速率?
课外活动小组就此进行了更深入的探究。
探究实验一:
浓度对化学反应速率的影响
实验步骤
现象
结论
取一支试管加入3~5mL5%的过氧化氢溶液,然后加入少量二氧化锰
缓慢有少量气泡冒出
另取一支试管加入3~5mL15%的过氧化氢溶液,然后加入少量二氧化锰
迅速有大量气泡冒出
浓度越大,过氧化氢分解的速率越快
请你设计:
实验用品:
试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:
温度对化学反应速率的影响
实验步骤
取一支试管加入3~5_mL_15%的过氧化氢溶液,然后把试管放入盛有冷水的烧杯中
取一支试管加入3~5_mL_15%的过氧化氢溶液,然后把试管放入盛有热水的烧杯中
温度越高,过氧化氢分解的速率越大
13.(2018,北京)众所周知,酚酞溶液遇NaOH溶液变红。
但是,在分组实验中(如下图所示),出现了意想不到的现象:
有的溶液变红后褪色;
有的出现白色浑浊物。
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与溶液和空气中的CO2反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
实验
实验现象
1
向盛有2mLNa2CO3溶液的试管中滴加5滴0.5%的酚酞溶液
溶液变红
2
1号试管0.1min红色褪去;
2号试管5min红色褪去;
3号试管30min红色明显变浅;
4号试管120min红色无明显变化
3
取3支试管,分别加入2mL水,……
酚酞溶液
浓度/%
浑浊程度
5
大量浑浊物
少量浑浊物
0.5
无浑浊物
【解释与结论】
(1)NaOH与CO2反应的化学方程式为2NaOH+CO2===Na2CO3+H2O。
(2)实验1的现象表明,猜想与假设Ⅰ不成立(填“成立”或“不成立”)。
(3)由实验2得出结论:
出现“溶液变红后褪色”现象的原因是与NaOH浓度有关,浓度过高会使酚酞褪色。
(4)实验3的操作步骤:
取3支试管,分别加入2mL水,再分别滴加5滴5%、2%、0.5%的酚酞溶液。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为0.5%。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是没有考虑NaOH的影响。