广东各地市模拟试题汇编 化学实验设计Word格式文档下载.docx
《广东各地市模拟试题汇编 化学实验设计Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《广东各地市模拟试题汇编 化学实验设计Word格式文档下载.docx(41页珍藏版)》请在冰豆网上搜索。
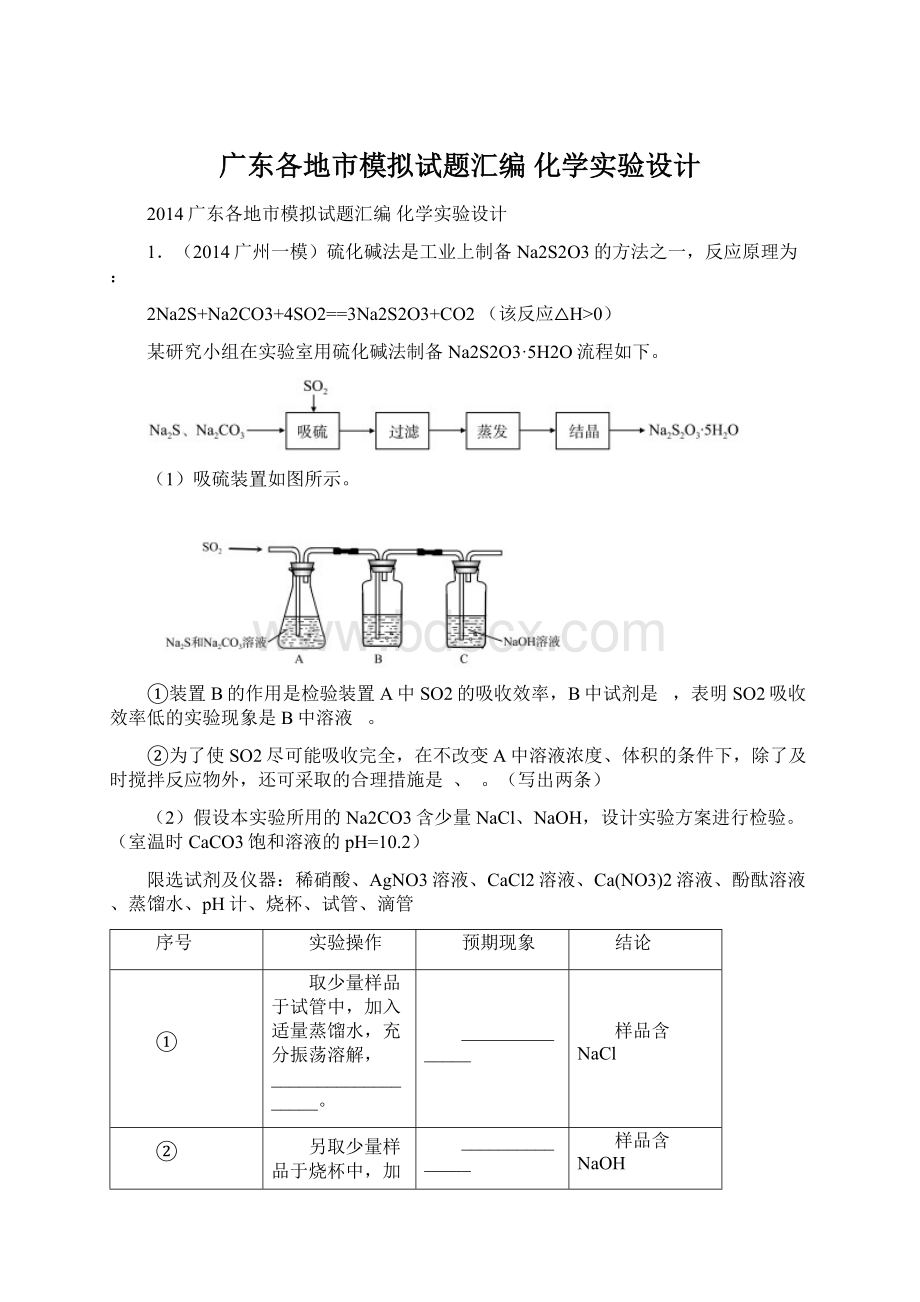
预期现象
结论
①
取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。
_______________
样品含NaCl
②
另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。
样品含NaOH
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
准确称取agKIO3(化学式量:
214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。
则c(Na2S2O3)=_________________________mol·
L-1。
(只列出算式,不作运算)
已知:
Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O2S2O32-+I2===S4O62-+2I-
2.(2014广州二模)
(1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:
图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。
白烟的成分是___________(填化学式)。
②NO2的吸收:
如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是___________________。
图a图b
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式_______________________________________。
②参照示例完成下表实验方案的设计。
限选材料:
0.05mol•L-1Fe(NO3)3、0.5mol•L-1Fe(NO3)3、1.0mol•L-1HNO3、1.0mol•L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;
pH计及其他常见仪器。
可能影响因素
预期现象和结论
溶液的酸碱性
取少量0.5mol•L-1Fe(NO3)3于试管中,加入几滴1mol•L-1HNO3。
棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。
盐的浓度
___________________________
__________
3.(2014潮州二模)为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。
为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。
可选用试剂:
KSCN溶液、NaOH溶液、氯水、KMnO4溶液。
⑴请完成下表:
操作
现象
取少量除尽Ag+后的溶液于试管中,
加入,振荡
存在Fe3+
加入1~2滴KMnO4溶液,振荡
存在Fe2+
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束以后,试管中残留固体为黑色。
⑵装置B的作用是。
⑶经小组讨论并验证该无色气体为O2,其验证方法是。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;
Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:
Ag;
Ag2O;
Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
实验编号
a
加入足量氨水,振荡
黑色固体不溶解
b
加入足量稀硝酸,振荡
黑色固体溶解,并有气体产生
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为
。
【实验拓展】测得两组数据:
①取2.0gAgNO3样品充分受热分解,收集到气体体积为56mL;
②取2.0gAgNO3样品充分受热分解,完全分解后测得残留固体产物质量为1.2g;
请你选择其中一组数据,计算样品中AgNO3的百分含量为。
4.(2014东莞一模)
某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
请回答下列问题:
(1)写出仪器A的名称:
;
(2)实验记录如下:
步骤
实验现象
实验结论
Ⅰ
打开活塞a,逐滴加入H2SO3溶液至过量
烧瓶内溶液
Br2的氧化性大于H2SO3
Ⅱ
向步骤Ⅰ所得溶液中逐滴加入H2O2溶液
刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色
(3)步骤Ⅱ中,开始时颜色无明显变化的原因是(写出一条):
写出步骤Ⅱ中反应的离子方程式;
(4)实验室常用Cl2通入NaBr溶液中制得单质溴,工业上常用电解饱和食盐水制备Cl2,装置如下图所示,利用该装置,工业上除得到氯气外,还可以得到(填化学式);
装置中的离子交换膜Na+可以通过而OH-不能通过,的目的是。
5.(2014佛山一模)
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。
(1)D中的实验现象是,C、E中溶液都褪色,
分别体现SO2、性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是,形成该沉淀的反应方程式有:
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。
研究小组改进A装置(如右图),再进行实验,B中没有出现浑浊。
下列气体可作为X气体的是(填序号,不定项选择)
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
①沉淀洗涤要干净,检验洗涤已经干净的实验操作是
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。
6.(2014佛山二模)
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。
以木炭,浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下嵊所示。
室温下,①2NO+Na2O2=2NaNO2
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+,
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O
(1)A中观察到的现象是
(2)装置B中反应的离子方程式有
、 。
(3) 装置C的作用是 ,装置F的作用是
(4) 若无装置D,则E中产物除亚硝酸钠外还含有副产物 。
(填化学式)
(5)NaNO2像食盐一样的咸味,但能引起中毒。
已知亚硝酸钠能发生如下反应:
2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。
进行实验时,必须选用的物质有 。
A、自来水 B、碘化钾淀粉试液 C、淀粉 D、白糖 E、食醋 F、白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。
称取E中固体2g,完全溶解配制成溶液100mL,取出25mL溶液用0.100mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:
NaNO2摩尔质量为60g/mol)
7.(2014惠州一模)
工业上用铁屑还原法制备碘化钠的主要流程如下图:
③
(1)碘元素位于周期表中第周期,第族;
(2)反应①的化学方程式;
(3)判断反应①中碘是否已完全反应的操作是;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确。
已知:
IO3-十5I-+6H+=3I2+3H2O;
NaIO3水溶液呈中性。
限选试剂:
lmol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水。
其它仪器和用品自选。
实验方案
将白色晶体溶于水,并滴2滴淀粉溶液
得到无色溶液
取少量溶液液于试管A中,
.
溶液显蓝色
溶液中含IO3一
另取少量溶液液于试管B中,
溶液中含大量0H一
要得到更纯的NaI,还需进一步的操作是(填操作名称)
8.(2014惠州二模)
牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成。
某小组对几种牙膏中摩擦剂成分及其含量进行探究:
(1)根据上述信息,推测摩擦剂应具备的性质有
A.易溶于水B.难溶于水C.颗粒较大D.颗粒较小
(2)已知A牌牙膏的摩擦剂是Al(OH)3,取少量牙膏样品,加水充分搅拌、过滤:
①往滤渣中加入过量NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式______。
②往①所得滤液先通入过量CO2,再加入过量稀盐酸,观察到的现象是。
(3)已知B牌牙膏中摩擦剂可能含有一或两种物质,将此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。
①对B品牌牙膏摩擦剂的成分提出合理假设:
假设1:
只有SiO2假设2:
可能有SiO2和CaCO3
假设3:
可能有_______________