微专题5元素化合物的综合应用二化学工艺流程题文档格式.docx
《微专题5元素化合物的综合应用二化学工艺流程题文档格式.docx》由会员分享,可在线阅读,更多相关《微专题5元素化合物的综合应用二化学工艺流程题文档格式.docx(32页珍藏版)》请在冰豆网上搜索。
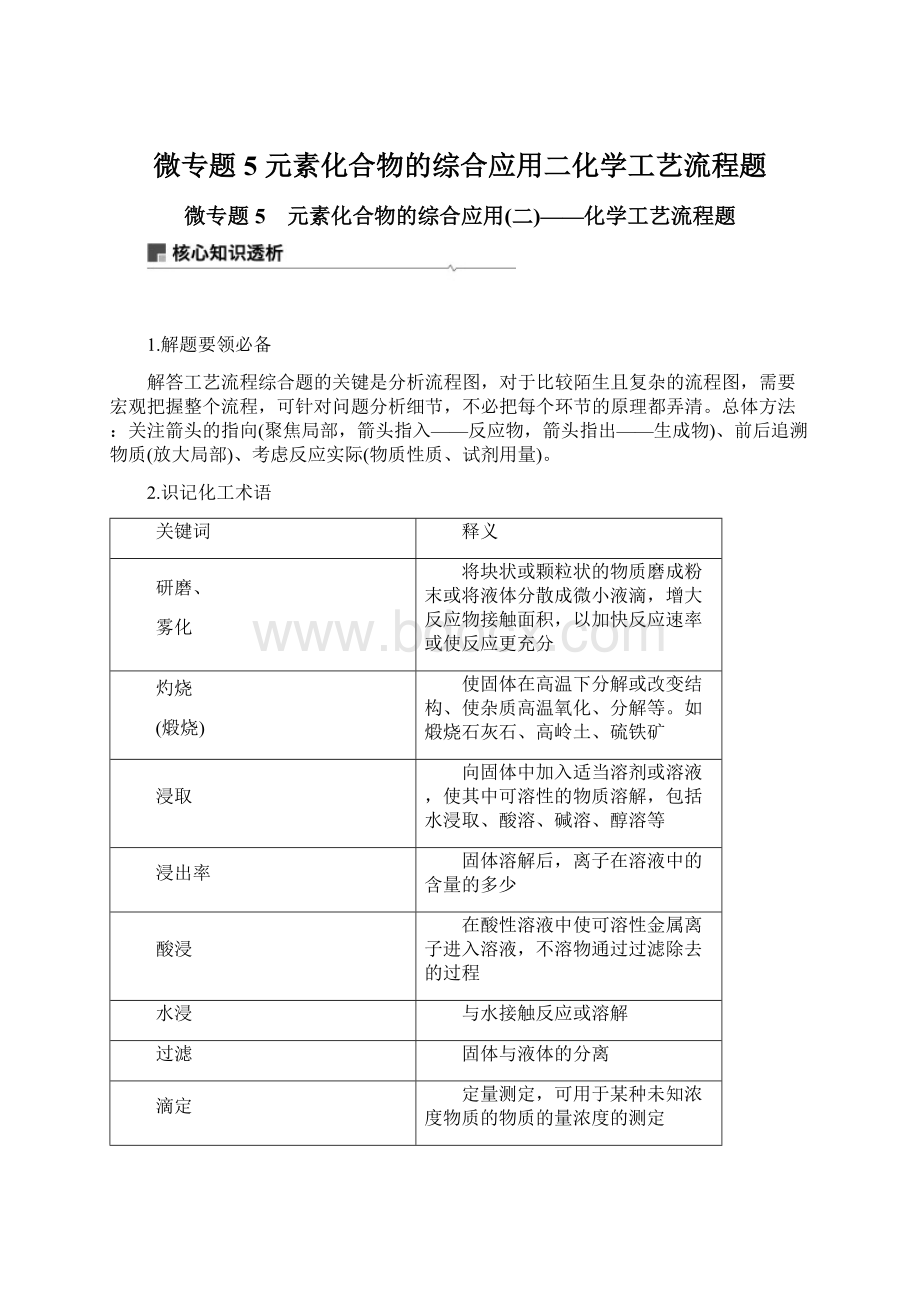
固体溶解后,离子在溶液中的含量的多少
酸浸
在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程
水浸
与水接触反应或溶解
过滤
固体与液体的分离
滴定
定量测定,可用于某种未知浓度物质的物质的量浓度的测定
蒸发
结晶
蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出
浓缩
蒸发除去部分溶剂,提高溶液的浓度
水洗
用水洗去可溶性杂质,类似的还有酸洗、醇洗等
酸作用
溶解、去氧化物(膜)、抑制某些金属离子的水解、除去杂质离子等
碱作用
去油污、去铝片氧化膜,溶解铝、二氧化硅,调节pH、促进水解(沉淀)
3.常见操作的答题考虑角度
常见的操作
答题要考虑的角度
分离、提纯
过滤、蒸发、萃取、分液、蒸馏等常规操作;
从溶液中得到晶体的方法:
蒸发浓缩—冷却结晶—过滤—(洗涤、干燥)
提高原子
利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
在空气中或在
其他气体中进行
的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应或能否达到隔绝空气,防氧化、水解、潮解等目的
判断沉淀
是否洗涤干净
取最后洗涤液少量,检验其中是否还有某种离子存在等
控制溶液的pH
①调节溶液的酸碱性,抑制水解(或使其中某些金属离子形成氢氧化物沉淀)
②“酸作用”还可除去氧化物(膜)
③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等
④特定的氧化还原反应需要的酸性条件(或碱性条件)
控制温度
(常用水浴、
冰浴或油浴)
①防止副反应的发生
②使化学平衡移动;
控制化学反应的方向
③控制固体的溶解与结晶
④控制反应速率:
使催化剂达到最大活性
⑤升温:
促进溶液中的气体逸出,使某物质达到沸点挥发
⑥加热煮沸:
促进水解,聚沉后利于过滤分离
⑦趁热过滤:
减少因降温而析出的溶质的量
⑧降温:
防止物质高温分解或挥发;
降温(或减压)可以减少能源成本,降低对设备的要求
洗涤晶体
①水洗:
通常是为了除去晶体表面水溶性的杂质
②“冰水洗涤”:
能洗去晶体表面的杂质离子,且防止晶体在洗涤过程中的溶解损耗
③用特定的有机试剂清洗晶体:
洗去晶体表面的杂质,降低晶体的溶解度有利于析出,减少损耗等
④洗涤沉淀方法:
往漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次
表面处理
用水洗除去表面可溶性杂质,金属晶体可用机械法(打磨)或化学法除去表面氧化物、提高光洁度等
1.[2018·
全国卷Ⅰ,27
(1)
(2)]焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。
写出该过程的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
①pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是
答案
(1)2NaHSO3===Na2S2O5+H2O
(2)①NaHSO3 ②得到NaHSO3过饱和溶液
解析
(1)根据题给信息,将NaHSO3过饱和溶液结晶脱水可得到Na2S2O5,则化学方程式为2NaHSO3===Na2S2O5+H2O。
(2)①酸性条件下,SO2与Na2CO3溶液反应生成NaHSO3。
②工艺中加入Na2CO3固体并再次通入SO2,其目的是得到NaHSO3过饱和溶液。
2.(2018·
全国卷Ⅱ,26)我国是世界上最早制得和使用金属锌的国家。
一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1mol·
L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
(1)焙烧过程中主要反应的化学方程式为______________________。
(2)滤渣1的主要成分除SiO2外还有________;
氧化除杂工序中ZnO的作用是________________________________________________________________________,
若不通入氧气,其后果是__________________________________________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为________________________________________________________________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________________________;
沉积锌后的电解液可返回________工序继续使用。
答案
(1)2ZnS+3O2
2ZnO+2SO2
(2)PbSO4 调节溶液的pH 无法除去杂质Fe2+
(3)Cd2++Zn===Cd+Zn2+ (4)Zn2++2e-===Zn 溶浸
解析
(1)闪锌矿的主要成分是ZnS,所以高温焙烧过程中主要反应的化学方程式为2ZnS+3O2
2ZnO+2SO2。
(2)闪锌矿焙烧后的主要成分变为ZnO,还存在少量SiO2、Fe2O3、CdO、PbO,加稀H2SO4后,发生一系列化学反应:
ZnO+H2SO4===ZnSO4+H2O、Fe2O3+3H2SO4===Fe2(SO4)3+3H2O、CdO+H2SO4===CdSO4+H2O、PbO+H2SO4===PbSO4+H2O。
其中SiO2和PbSO4不溶于水,以沉淀的形式沉降下来,所以滤渣1的主要成分是SiO2和PbSO4。
氧化除杂工序中ZnO的作用是调节溶液的pH在2.8~6.2,使Fe3+完全转变为Fe(OH)3沉淀;
通入O2的目的是使溶液中的Fe2+转化为Fe3+,有利于除杂,若不通入O2,无法除去溶液中的杂质Fe2+。
(3)溶液中的Cd2+与加入的Zn粉反应而被除去,反应的离子方程式为Zn+Cd2+===Zn2++Cd。
(4)电解ZnSO4溶液制备单质Zn时,阴极放电的是Zn2+和H+。
因为溶液中的Zn2+浓度较大,所以阴极电极反应式应该是Zn2++2e-===Zn,阳极放电的是OH-,电极反应式是4OH--4e-===2H2O+O2↑。
沉积锌后的溶液应该是ZnSO4和稀H2SO4,可返回到溶浸工序循环使用。
3.[2018·
全国卷Ⅲ,27
(1)
(2)]KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。
(1)KIO3的化学名称是________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。
“逐Cl2”采用的方法是__________________。
“滤液”中的溶质主要是__________。
“调pH”中发生反应的化学方程式为__________________。
答案
(1)碘酸钾
(2)加热 KCl KH(IO3)2+KOH===2KIO3+H2O(或HIO3+KOH===KIO3+H2O)
解析
(2)Cl2的溶解度随温度的升高而降低,所以可以用加热的方法来达到“逐Cl2”的目的;
KH(IO3)2和KCl的分离可以根据溶解度的不同,采用结晶法分离,滤液中的溶质主要是KCl,要使KH(IO3)2转化为KIO3,可以加入KOH调节pH。
发生反应:
KH(IO3)2+KOH===2KIO3+H2O或HIO3+KOH===KIO3+H2O,从而避免引入新的杂质离子。
4.(2017·
全国卷Ⅰ,27)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为70%时,所采用的实验条件为________________________________________________________________
(2)“酸浸”后,钛主要以TiOCl
形式存在,写出相应反应的离子方程式:
(3)TiO2·
xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·
xH2O转化率/%
92
95
97
93
88
分析40℃时TiO2·
xH2O转化率最高的原因:
_______________________________________
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________________。
(5)若“滤液②”中c(Mg2+)=0.02mol·
L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×
10-5mol·
L-1,此时是否有Mg3(PO4)2沉淀生成?
_________________________________________________________________(列式计算)。
FeP