大学化学教程课后习题参考答案Word文档下载推荐.docx
《大学化学教程课后习题参考答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《大学化学教程课后习题参考答案Word文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
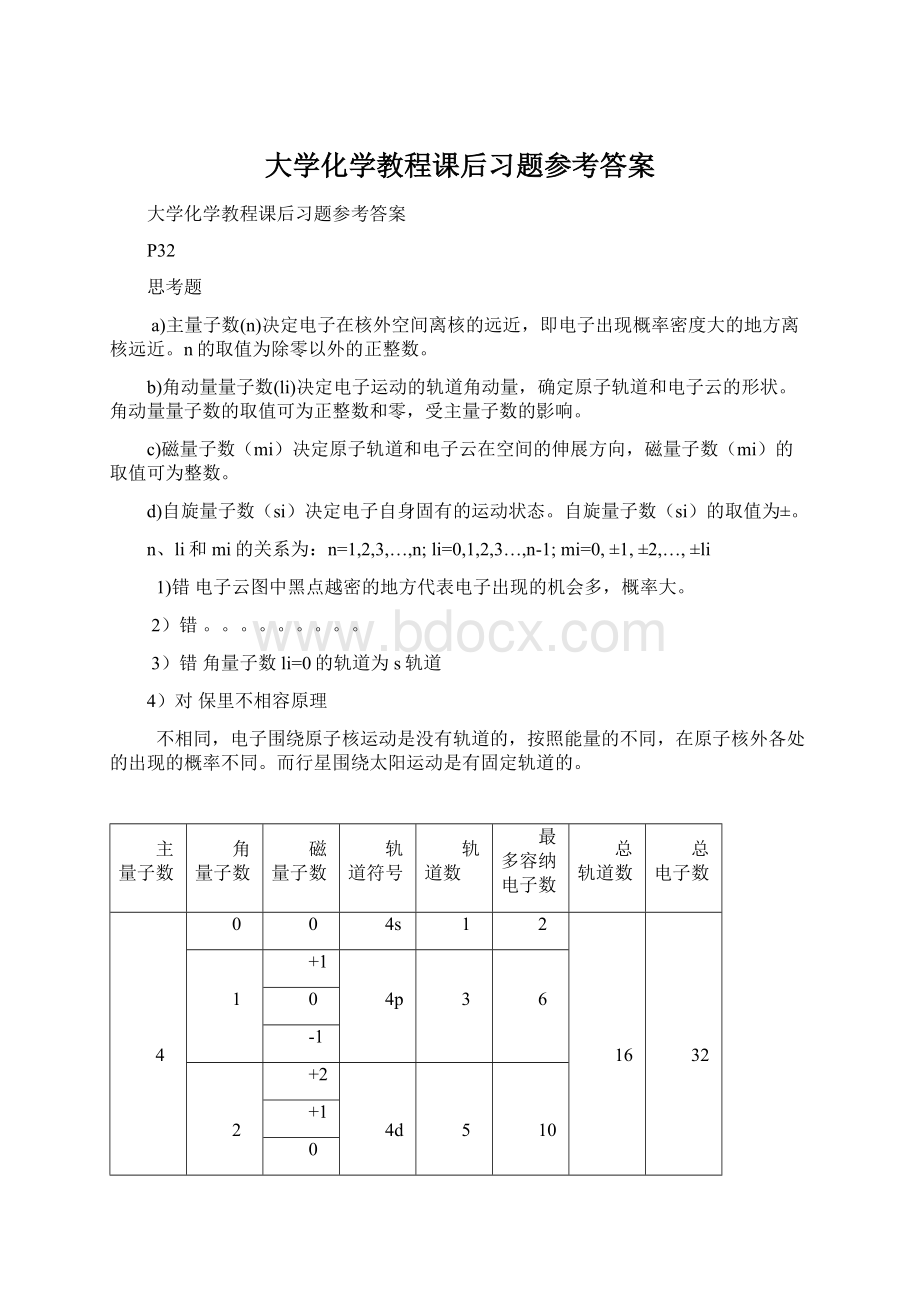
轨道符号
轨道数
最多容纳电子数
总轨道数
总电子数
4
4s
1
2
16
32
+1
4p
3
6
-1
+2
4d
5
10
-2
+3
4f
7
14
-3
(1)p区元素
(2)Fe(3)Cu
(1)4s
(2)3p(3)3d(4)3d(5)3s
能量由高到低:
(1)﹥
(2)﹥(3)=(4)﹥(5)
元素的电负性指的是原子在分子中吸引电子的能力,电负性越大说明原子在分子中得到电子的能力越强。
习题
(1)2sn=2li=0,1mi=0,±
1存在2s,2p轨道,轨道数3个
(2)3fn=3li=0,1,2mi=0,±
1,±
2存在3s,3p,3d轨道,不存在3f轨道
(3)1pn=1li=0mi=0故只存在1s轨道,不存在1p轨道
(4)5dn=5li=0,1,2,3,4mi=0,±
2,±
3,±
4故存在5s,5p,5d,5f轨道,轨道数为9个
(5)4fn=4li=0,1,2,3mi=0,±
3故存在4s,4p,4d,4f轨道,轨道数7个
(6)3pn=3li=0,1,2mi=0,±
2存在3s,3p,3d轨道,轨道数为5个
(1)(3,2,2,1/2)存在
(2)(3,0,-1,1/2)不存在,若li=0则mi=0,不可能为-1
(3)(2,2,2,2)不存在,若n=2则li=0,1
(4)(1,0,0,0)不存在,自旋量子数(si)的取值为±
(5)(2,-1,0,1/2)不存在,li的取值为零和正整数
(6)(2,0,-2,1/2)不存在,若li=0则mi=0,不可能为-2
(1)硼1s22s3违背保里不相容原理,每个轨道最多容纳2个电子,正确的为1s22s22p1
(2)氮1s22s22px32py1违背洪德规则,正确的为1s22s22p3
(3)铍1s22p2违背能量最低原理,正确的为1s22s2
周期区族号
20Ca[Ar]4s104sⅡA
35Br[Ar]3d104s24p55pⅦA
42Mo[Kr]4d55s15dⅥB
47Ag[Kr]4d105s15dsⅠB
80Hg[Xe]4f145d106s26dsⅡB
(1)Be>Mg>Ca
(2)Ge>
Ga>
In(3)He>
Ne>
Ar(4)N>
O>
C>
Be>
B
得电子:
O,I,S
失电子:
Na,B,Sr,Al,Cs,Ba,Se
最高氧化态最低氧化态
cl1s22s22p63s23p5+7-1
Mn[Ar]3d54s2+7-3
P54
(1)ZnO>
ZnS
(2)HF>
Hcl>
HBr>
HI(3)H2S>
H2Se>
H2Te
(4)NH3<
HF(5)F2O<
H2O
(1)SiH4sp3杂化
(2)Hgcl2sp杂化
(3)Bcl3sp2杂化(4)CS2sp杂化(5)Ncl3sp3杂化
(1)SiF4等性sp3杂化
(2)Pcl3不等性sp3杂化
(3)CHcl3不等性sp3杂化(4)H2S不等性sp3杂化
(5)CCl2F2等性sp3杂化
几何构型杂化轨道偶极距
SiCl4正四面体sp30
H2Tev形sp3不等于0
Bcl3平面三角形sp20
BeCl2直线sp0
PBr3三角锥形sp3不等于0
BBr3中心原子B的外围电子构型为1s22s22p1,故BBr3应为sp2杂化,几何构型为平面三角形,Ncl3中心原子N的外围电子构型为1s22s22p3,故Ncl3应为不等性sp3杂化,几何构型为三角锥形
(1)由非极性键组成的分子不一定为非极性分子,如O3为极性分子,反之极性键形成的分子不一定是极性分子,如CO2,O=C=0,是非极性分子
(2)色散力存在于极性分子、分极性分子以及极性分子和非极性分子之间。
(3)诱导力存在于极性分子以及极性分子和非极性分子之间
(1)F2、Cl2、Br2、I2分子间的色散力随相对分子质量的增加而逐渐增加,熔点、沸点也增加,同时也影响着物质的物理性质的变化。
(2)HCL、HBr、HI分子间的色散力随相对分子质量的增加而逐渐增加,从而熔点、沸点也逐渐增加。
(1)液态水取向力、诱导力、色散力
(2)氨水取向力、诱导力、色散力
(3)酒精水溶液取向力、诱导力、色散力
(4)碘的四氯化碳溶液色散力
因为乙醇分子间可以形成氢键,而二甲醚则不能形成,所以乙醇的沸点较二甲醚的高
(1)CH4<
CCl4<
CBr4<
CI4
(2)H2O>
H2S(3)CH4<
SiH4<
GeH4
(4)He<
Ne<
Ar<
Kr
非极性分子:
He,F2,CS2,CCL4,BBr3
极性分子:
HCl,AsH3,H2S,CHCl3
①
②
③
④
⑤
⑥
⑦
(1)(3)(4);
;
(2)(5)
Li-Cl>
Be-Cl=Al-Cl>
H-CL>
S-Cl>
N-CL>
O-Cl
SiHCl3正四面体
NF3三角锥
PH3三角锥
(1)H2S取向力、诱导力、色散力
(2)Ne与H20诱导力、色散力
(3)NH3取向力、诱导力、色散力
(4)Br2与CCl4色散力
(1)H2色散力
(2)SiH4色散力
(3)CH3COOH氢键,色散力,取向力,诱导力
(4)HCHO色散力,取向力,诱导力
P69
与非晶体相比,晶体具有以下宏观性质:
(1)完整晶体具有固定外形;
(2)晶体具有固定熔点;
(3)晶体具有各向异性。
晶体的基本类型有:
离子晶体、原子晶体、分子晶体、金属晶体和混合晶体。
(1)稀有气体固化后属于分子晶体,它们之间结合靠的是微弱的范德华力而不是以共价键结合,只是组成晶体的粒子为单原子分子。
(2)溶于水能导电的晶体为离子晶体或分子晶体,分子晶体中的电解质(如酸和部分非金属气态氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电。
原子晶体中,晶格节点上是中性原子,原子与原子间是以共价键结合,不断向周围延伸,形成一个巨大的分子。
而分子晶体中,分子晶格节点上是电中性分子,晶格节点间以微弱的范德华力相结合,所以分子晶体和原子晶体的性质有很大的区别。
体心立方堆积、面心立方堆积、六方最密堆积
离子键特点无饱和性和方向性。
离子在空间各个方向的静电作用是相同的,正负离子可以在空间的任何方向和电荷相反的离子相互吸引,所以离子键无方向性;
只要空间允许,一个正负离子可以同时与几个电荷相反的离子相互吸引,并不受离子本身所带电荷的限制。
形成液态晶的有机分子是具有刚性结构的分子,相对分子质量在200-500,长度达几个纳米,长宽比在4-8之间。
晶体的缺陷对晶体的物理性质和化学性质均有影响,晶体缺陷可能导致晶体物理性质的变化如导电性,硬度等,有些缺陷还会导致晶体与原晶体呈现出不同的颜色。
(1)O2分子晶体
(2)H2S分子晶体(3)Pt金属晶体(4)KCL离子晶体(5)Ge金属晶体
金刚石是典型的原子晶体,晶体中每个C原子以sp3杂化轨道分别与四个相邻的碳原子形成的共价键;
石墨是典型的层状混合型晶体,层内的碳原子以共价键结合,层间的碳原子以范德华力相结合。
有些结构为棒状、盘状或板状的分子在变成液体后,虽然分子的位置无序,但分子的取向仍保持着长程有序,成为兼具部分晶体和液体性质的过渡状态。
P116
反应进度为
转化速率为单位时间内的反应进度,而恒容条件下的反应速率常表示为单位时间内B的物质的量的浓度变化除以其计量数;
反应速率为单位体积内的转化速率。
D
B
活化能Ea=mol
Kθ=
pH=
有Mg(OH)2生成
先生成PbSO4沉淀
配合物
中心离子配位数
配体
配位原子
命名
【PtCl2(NH3)2】
NH3
N
二氯二氨合铂
[Ni(en)2]Cl2
en
二氯二乙氨合镍
Na3[Ag(S203)2]
S2O3-
S
二硫代硫酸合银酸钠
K4[Fe(CN)6]
CN-
六氰合铁酸钾
配离子的稳定常数和不稳定常数互为倒数,配离子的不稳定性常数越大表示配离子的离解倾向越大,配离子越不稳定。
Ag+的浓度为×
10-10mol/l
会有AgI沉淀生成
(1)电池反应式:
CO+Cl2=CO2++2Cl-
(2)
(3)P(Cl2)增大时,电池电动势增大
反应进度为l
(1)△rHmθ=Mol
(2)△rHmθ=Mol
(3)△rHmθ=Mol(3)△rHmθ=-714KJ/Mol
(1)Kθ=
(2)Kθ=[P(CO2)]
(3)Kθ=
(4)Kθ=[OH-]2[Ca2+]
(1)a:
降低反应温度改变Kθ
b:
增大体系压强不改变Kθ
c:
增大SO2或O2浓度或减小SO3浓度不改变Kθ
(2)a:
升高反应温度改变Kθ
b:
减小体系压强不改变Kθ
增大CO2浓度或减小CO浓度不改变Kθ
Kθ=×
1022
H+浓度为×
10-4
氨水的浓度为l
能够抵消外来少量酸碱作用或稀释的影响,而仍能维持pH值不变的溶液成为缓冲溶液。
凡是弱酸或弱碱及其盐组成的溶液都是缓冲溶液。
(4)、(5)、(6)能形成缓冲溶液
(1)PbSO4的溶解度为×
10-4mol/l
PbI2的溶解度为×
10-3
(2)Pb2+浓度为×
10-7
会生成Mn(OH)2沉淀
K2[Zn(CN)4]溶液中存在:
K+、Zn(CN)42-、Zn(CN)3-、
Zn(CN)2、ZnCN+、CN-,存在最多的为K+,K不稳=
K稳=1/K不稳
4.12
(1)正极反应:
Sn4+(aq)+2e-=Sn2+(aq)
负极反应:
Ni(S)-2e-=Ni2+(aq)
电池符号:
(-)Ni|Ni2+(C1)||Sn4+(C2),Sn2+(C3)|Pt(+)
E