化学实验高考化学真题分类汇编Word格式文档下载.docx
《化学实验高考化学真题分类汇编Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《化学实验高考化学真题分类汇编Word格式文档下载.docx(18页珍藏版)》请在冰豆网上搜索。
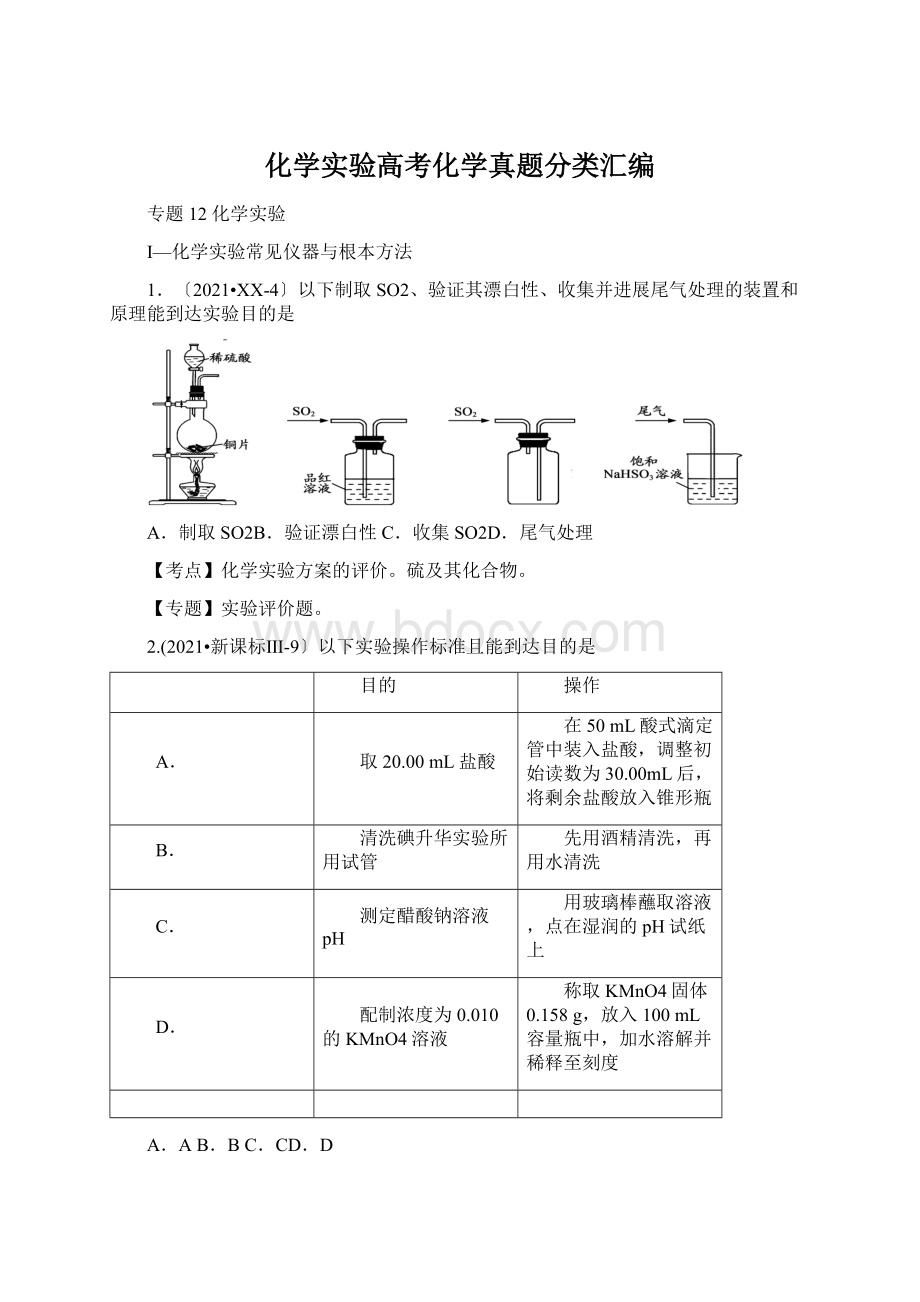
3.〔15分〕〔2021•新课标Ⅱ-28〕水中溶解氧是水生生物生存不可缺少的条件。
某课外小组采用碘量法测定学校周边河水中的溶解氧。
实验步骤及测定原理如下:
Ⅰ.取样、氧的固定:
用溶解氧瓶采集水样。
记录大气压及水体温度。
将水样与Mn(OH)2碱性悬浊液〔含有KI〕混合,反响生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化,滴定:
将固氧后的水样酸化,MnO(OH)2被I—复原为Mn2+,在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2〔2S2O32—+I2=2I—+S4O62—〕。
答复以下问题:
〔1〕取水样时应尽量防止扰动水体外表,这样操作的主要目的是
。
〔2〕"
氧的固定〞中发生反响的化学方程式为。
〔3〕Na2S2O3溶液不稳定,使用前需标定。
配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和;
蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除及二氧化碳。
〔4〕取100.00mL水样经固氧、酸化后,用amol•L﹣1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;
假设消耗Na2S2O3溶液的体积为bmL,那么水样中溶解氧的含量为mg•L﹣1。
〔5〕上述滴定完成后,假设滴定管尖嘴处留有气泡会导致测量结果偏。
〔填"
高〞或"
低〞〕
【考点】探究物质的组成或测量物质的含量。
【专题】化学实验根本操作;
定量测定与误差分析。
4.(2021•XX-22)1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm—3。
实验室制备少量1﹣溴丙烷的主要步骤如下:
步骤1:
在仪器A中参加搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢参加28mL浓H2SO4;
冷却至室温,搅拌下参加24gNaBr.
步骤2:
如下列图搭建实验装置,缓慢加热,直到无油状物馏出为止.
步骤3:
将馏出液转入分液漏斗,分出有机相.
步骤4:
将分出的有机相转入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷.
〔1〕仪器A的名称是;
参加搅拌磁子的目的是搅拌和。
〔2〕反响时生成的主要有机副产物有2﹣溴丙烷和。
〔3〕步骤2中需向承受瓶内参加少量冰水并置于冰水浴中的目的是。
〔4〕步骤2中需缓慢加热使反响和蒸馏平稳进展,目的是。
〔5〕步骤4中用5%Na2CO3溶液洗涤有机相的操作:
向分液漏斗中小心参加12mL5%Na2CO3溶液,振荡,,静置,分液。
【考点】制备实验方案的设计;
卤代烃的性质;
醇的性质;
萃取的操作;
蒸馏的操作;
【专题】有机实验综合
5.〔18分〕〔2021•XX-9〕用沉淀滴定法快速测定NaI等碘化物溶液中c(I﹣),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ准备标准溶液
a.准确称取AgNO3基准物4.2468g〔0.0250mol〕后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol•L﹣1NH4S标准溶液,备用。
Ⅱ滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.参加25.00mL0.1000mol•L﹣1AgNO3溶液(过量),使I﹣完全转化为AgI沉淀。
c.参加NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol•L﹣1NH4S溶液滴定过量的Ag+,使其恰好完全转化为AgS沉淀后,体系出现淡红色,停顿滴定。
e.重复上述操作两次.三次测定数据如下表:
实验序号
1
2
3
消耗NH4S标准溶液体积/mL
10.24
10.02
9.98
f.数据处理
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有
〔2〕AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是。
〔3〕滴定应在pH<0.5的条件下进展,其原因是
〔4〕b和c两步操作是否可以颠倒,说明理由
〔5〕所消耗的NH4S标准溶液平均体积为mL,测得c(I﹣)=mol•L﹣1。
〔6〕在滴定管中装入NH4S标准溶液的前一步,应进展的操作为
〔7〕判断以下操作对c(I﹣)测定结果的影响〔填"
偏高〞、"
偏低〞或"
无影响〞〕
①假设在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,那么测定结果。
②假设在滴定终点读取滴定管刻度时,俯视标准液液面,那么测定结果。
【考点】化学实验根本操作;
铁盐的的水解知识;
卤化银的性质;
探究物质的组成或测量物质的含量
【专题】定量测定与误差分析
6.〔15分〕〔2021•新课标Ⅰ-26〕凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如下列图装置处理铵盐,然后通过滴定测量。
:
;
〔1〕a的作用是。
〔2〕b中放入少量碎瓷片的目的是。
f的名称是。
〔3〕清洗仪器:
中加蒸馏水;
翻开
,关闭
,加热
,蒸气充满管路;
停顿加热,关闭
中蒸馏水倒吸进入
,原因是
放掉水,重复操作
次。
〔4〕仪器清洗后,
中参加硼酸〔
〕和指示剂。
铵盐试样由
注入
,随后注入氢氧化钠溶液,用蒸馏水冲洗
中保存少量水。
,使水蒸气进入
①
中保存少量水的目的是。
②
中主要反响的离子方程式为,
采用中空双层玻璃瓶的作用是。
〔5〕取某甘氨酸〔
〕样品
克进展测定,滴定
中吸收液时消耗浓度为
的盐酸
,那么样品中氮的质量分数为
,样品的纯度
【考点】探究物质的组成;
化学实验根本操作;
离子反响与离子方程式;
化学计算。
【专题】定量测定与误差分析.
Ⅱ—物质的别离、提纯与检验
1."
本草衍义-8"
中对精制砒霜过程有如下表达:
"
取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之〞,文中涉及的操作方法是
A.蒸馏B.升华C.干馏D.萃取
【考点】物质的别离、提纯的根本方法选择与应用。
【专题】物质的别离提纯和鉴别。
2.〔6分〕〔2021•XX-4〕以下实验设计能到达实验目的是
实验目的
实验设计
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
制备无水AlCl3
蒸发Al与稀盐酸反响后的溶液
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
A.AB.BC.CD.D
钠及其化合物;
铝及其化合物、铝盐的水解;
混合物的别离与提纯;
卤素单质间的置换反响。
【专题】物质的别离提纯和鉴别
3.〔2021•XX-4〕以下制取SO2、验证其漂白性、收集并进展尾气处理的装置和原理能到达实验目的是
4.〔2021•新课标Ⅰ-10〕实验室用
复原
制备金属
的装置如下列图(
粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。
以下说法正确的选项是
A.①、②、③中依次盛装
溶液、浓
、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.完毕反响时,先关闭活塞
,再停顿加热
D.装置
〔启普发生器〕也可用于二氧化锰与浓盐酸反响制备氯气
【考点】制备实验方案的设计:
包括气体除杂、氢气的验纯与操作本卷须知、启普发生器的使用。
【专题】无机实验综合。
5.〔13分〕〔2021•-26〕TiCl4是由钛精矿〔主要成分为TiO2〕制备钛〔Ti〕的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:
TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181〔升华〕
316
1412
熔点/℃
﹣69
25
193
304
714
在TiCl4中的溶解性
互溶
﹣
微溶
难溶
〔1〕氯化过程:
TiO2与Cl2难以直接反响,加碳生成CO和CO2可使反响得以进展。
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣220.9kJ•mol﹣1
①沸腾炉中加碳氯化生成TiCl4〔g〕和CO〔g〕的热化学方程式:
②氯化过程中CO和CO2可以相互转化,根据如图判断:
CO2生成CO反响的△H0〔填"
>〞"
<〞或"
=〞〕,判断依据:
③氯化反响的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,那么尾气的吸收液依次是
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,那么滤渣中含有。
〔2〕精制过程:
粗TiCl4经两步蒸馏得纯TiCl4。
示意图如下:
物质a是,T2应控制在。
【考点】盖斯定律与热化学方程式的书写;
氯及其化合物;
铁及其化合物;
金属综合;
制备实验方案的设计
【专题】无机实验综合
6.〔12分〕〔2021•XX-16〕铝是应用广泛的金属。
以铝土矿〔主要成分为Al2O3,含SiO2和Fe2O3等杂质〕为原料制备铝的一种工艺流程如下:
注:
SiO2在"
碱溶〞时转化为铝硅酸钠沉淀。
〔1〕"
碱溶〞时生成偏铝酸钠的离子方程式为。
〔2〕向"
过滤Ⅰ〞所得滤液中参加NaHCO3溶液,溶液的pH(填"
增大〞、"
不变〞或"
减小〞)。
〔3〕"
电解Ⅰ〞是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是
〔4〕"
电解Ⅱ〞是电解Na2CO3溶液,原理如下列图.
阳极的电极反响式为,阴极产生的物质A的化学式为。
〔5〕铝粉在1000℃时可与N2反响制备AlN。
在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是
【考点】铝及其化合物;
硅及其化合物;
电解原理;
物质别离和提纯的方法和根本操作综合应用;
7.〔15分〕〔2021•XX-19〕某科研小组采用如下方案回收一种光盘金属层中的少量Ag〔金属层中其他金属含量过低,对实验的影响可忽略〕。
①NaClO溶液在受热或酸性条件下易分解,如:
3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水:
AgCl+2NH3•H2