高考化学二轮复习专题23物质的检验练习含答案文档格式.docx
《高考化学二轮复习专题23物质的检验练习含答案文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学二轮复习专题23物质的检验练习含答案文档格式.docx(26页珍藏版)》请在冰豆网上搜索。
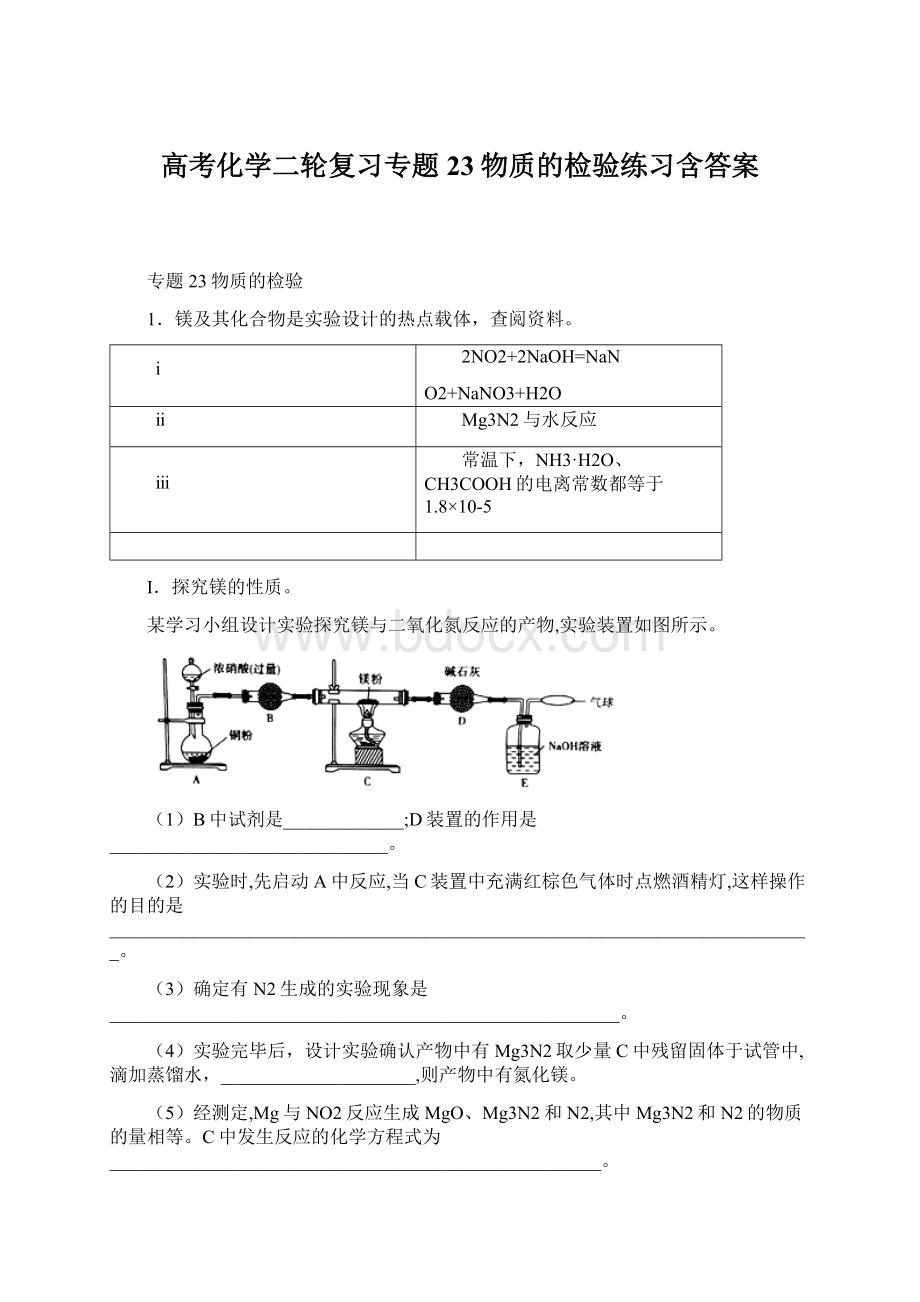
(3)确定有N2生成的实验现象是_______________________________________________________。
(4)实验完毕后,设计实验确认产物中有Mg3N2取少量C中残留固体于试管中,滴加蒸馏水,_____________________,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。
C中发生反应的化学方程式为_____________________________________________________。
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:
氢氧化镁、蒸馏水、硝酸氨溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉
末投入氯化氨溶液中,振荡、白色粉末全部溶解。
为了探究其原因,他们提出两种假设。
假设1:
氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:
NH4++OH-=NH3·
H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验探究哪一种假设正确:
____________________________________________。
【答案】P2O5等吸收E中挥发出来的水蒸气排尽装置内空气,避免O2、CO2、N2等与镁反应E中产生气泡,瘪气球缓慢鼓起有刺激性气味的气体逸出(产生的气体能使湿润红色石蕊试纸变蓝色)11Mg+4NO2
8MgO+Mg3N2+N2(写成4Mg+2NO2
4MgO+N2、3Mg+N2
Mg3N2也给分)取少量氢氧化镁于试管中,加入足量CH3COONH
4溶液,若白色固体溶解,则假设2正确;
若白色固体不溶解,则假设1正确
2.乙二酸俗称草酸,其钠盐和钾盐易溶于水,钙盐难溶于水。
草酸晶体(H2C2O4·
2H2O)无色、熔点为101℃。
易溶于水,150℃-160℃大量升华,170℃以上分解。
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是__________________________,由此可知草酸晶体分解的产物中有______________,装置B的主要作用是_____________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有H2O和CO,为进行验证,选用下图中的装置进行实验。
实验装置连接的合理顺序为a
→___________________→k(填小写字母),能证明草酸晶体分解产物中有CO的现象是______________________________________________________________,草酸晶体受热分解的化学方程式为_______________________________________________________________。
(3)用酸性KMnO4溶液滴定反应结束后的F溶液,测定Na2C2O4的浓度
实验步骤:
取20.00mLF中的溶液于锥形瓶中,再向锥形瓶中加入足量稀H2SO4,用0.1600mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶被25.00mL。
①高锰酸钾溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②滴定终点的现象是_______________________________________________________。
③计算F溶液中Na2C2O4的物质的量浓度为_________。
【答案】澄清石灰水出现白色浑浊CO2冷凝草酸,防止草酸进入C中与澄清石灰水作用生成沉淀干扰CO2的检验→d→e→f→g→h→i→b→c→m→nD中固体由黑变红,H中出现白色浑浊H2C2O4·
2H2O
CO↑+CO2↑+3H2O酸式滴入最后一滴高锰酸钾溶液后,溶液颜色由无色变为红色,且30秒内不褪色0.5000mol/L
3.碳化铝可用作甲烷发生剂,实验室欲利用如图所示装置制取甲烷并还原CuO。
已知:
Al4C3+12H2O=4Al(OH)3+3CH4↑。
(1)仪器a的名称是____________。
(2)连接装置并检查气密性后,打开a的活塞和弹簧夹K,一段时间后点燃c和g,d中CuO全部被还原为Cu时,e中固体颜色由白变蓝,f中溶液变浑浊,g处酒精灯火焰呈蓝色。
①e中的试剂是________,其作用是_____________________________。
②实验完毕后,要先熄灭c并继续通入甲烷至d冷却后再熄灭g,原因是_______________。
(3)若最后在g处点燃的气体仅为CH4,则d中发生反应的化学方程式为____________________。
【答案】分液漏斗无水硫酸铜检验产物中是否有水避免炽热铜粉重新被氧化,且尾气可能含有毒的CO,需要用燃烧法除去CH4+4CuO
4Cu+2H2O+CO2
【解析】
(1)仪器a为分液漏斗;
(2)连接装置并检查气密性后,打开a的活塞和弹簧夹K,水滴入烧瓶与Al4C3发生反应,生成CH4,先利用CH4排尽装置中的空气,防止氧气干扰实验。
空气排尽后,再点燃c和g,与CuO发生反应。
e中固体由白变蓝,则e中为无水硫酸铜,检验水的产生;
f中溶液变浑浊,则产生了CO2。
实验完毕后,先熄灭c
4.某课外小组利用H2还原WO3(黄色)粉末测定W(银白色)的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题:
(1)仪器B的名称____________,C中水的作用是_______________________________;
(2)D中盛放的试剂是___________,其作用是___________________________________;
(3)实验过程中有下面几步:
①加热反应管E,②从仪器A逐滴滴加液体,③由仪器G收集气体并检验纯度,④待E试管冷却后,停止从A中滴加液体。
正确的实验操作顺序是_____;
(4)E中反应的化学方程式_____________________________________________________,
E中产生的现象为___________________________________________________________;
(5)本实验样品WO3为纯净物,且完全被还原。
若测得如下数据①空E管的质量a②E管和WO3的总质量b;
③反应后E管和W粉的总质量c(冷却到室温称量);
④反应前F管及内盛装物的总质量d;
⑤反应后F管及内盛装物的总质量e。
由以上数据可以列出计算W的相对原子质量的不同计算式(除W外,其他涉及的元素的相对原子质量均为已知),请写出其中一个。
Ar(W)=___________________________。
【答案】圆底烧瓶除去B中挥发出的HCl气体浓硫酸干燥②③①④WO3+3H2=W+3H2O粉末由黄色逐渐变为银白色,且玻璃管内壁有水珠产生
或
-48或
-48
5.芳香族羧酸通常用芳香烃的氧化来制备。
芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。
某同学用甲苯的氧化反应制备苯甲酸。
反应原理:
相关物质的物理常数:
名称
相对分子质量
性状
熔点/℃
沸点/℃
密度/(g·
cm-3)
溶解性
水
乙醇
乙醚
甲苯
92
无色液体,易燃,易挥发
-95
110.6
0.8669
不溶
易溶
易溶
苯甲酸
122
白色片状或针状晶体
122.4
248
1.2659
微溶
主要实验装置和流程如下:
图1回流搅拌装置图2抽滤装置
实验方法:
一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应
一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
(1)操作I为_________;
操作II为_________。
(2)如果水层呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化。
加亚硫酸氢钾的目的是________。
(3)白色固体B的主要成分为_________,其中可能含有的主要杂质是_________。
(4)下列关于仪器的组装或者使用正确的是_________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置可采用酒精灯直接加热的方法
D.图1冷凝管中水的流向是上进下出
(5)称取1.22g产品,配成100.0mL溶液。
取其中25.00mL溶液于锥形瓶中,滴加酚酞作为指示剂,用浓度为0.1000mol·
L-1的KOH标准溶液进行滴定,消耗了20.00mL。
产品中苯甲酸质量分数为_____。
若采用甲基橙作指示剂,会导致测定的结果________(填“偏高”、“偏低”或“无影响”)。
【答案】分液蒸馏除去未反应的高锰酸钾,防止盐酸酸化时被高锰酸钾所氧化,产生氯气苯甲酸KClAB80.0%偏低
6.完成下列填空:
某化学小组拟采用如下装置(夹持和加热仪器等已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
完成下列填空:
(1)写出甲装置中反应的化学方程式______________________________。
(2)为完成上述实验,正确的连接顺序为A连______,B连_____(填写接口字母)。
(3)乙装置中a试剂可以是_______________。
(4)测定Cu的相对原子质量。
将wgCuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量
方案1
方案2
U型管+固体
硬质玻璃管+固体
反应前的总质量/g
a
c
反应后的总质量/g
b
d
你认为较佳方案是_____________,另一个方案得到的Cu的相对原子质量会_______(选填“偏低”、或“偏高”)
【答案】2NaCl+2H2O
2NaOH+H2↑+Cl2↑EC淀粉KI溶液方案2偏低
7.铝锰合金可作炼钢脱氧剂。
某课外小组欲测定铝锰合金中锰的含量。
I硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的浓度滴定
步骤1:
取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加2滴R溶液作指示剂,继续滴定至终点,消耗的体积为V1mL。
步骤2:
重复步骤1实验,接近终点时加4滴R溶液,消耗的体积为V2m