高三化学二轮专题重点突破滴定曲线的分析与应用知识梳理提升训练.docx
《高三化学二轮专题重点突破滴定曲线的分析与应用知识梳理提升训练.docx》由会员分享,可在线阅读,更多相关《高三化学二轮专题重点突破滴定曲线的分析与应用知识梳理提升训练.docx(13页珍藏版)》请在冰豆网上搜索。
高三化学二轮专题重点突破滴定曲线的分析与应用知识梳理提升训练
2020年高三化学二轮专题重点突破:
——滴定曲线的分析与应用
【知识梳理】
中和滴定曲线图像的分析方法
抓反应的“起始”点
判断酸、碱的相对强弱
抓反应的“一半”点
判断是哪种溶质的等量混合
抓溶液的“中性”点
判断溶液中溶质的成分及哪种物质过量或不足
抓“恰好”反应点
判断生成的溶质成分及溶液的酸碱性
抓反应的“过量”点
判断溶液中的溶质,判断哪种物质过量
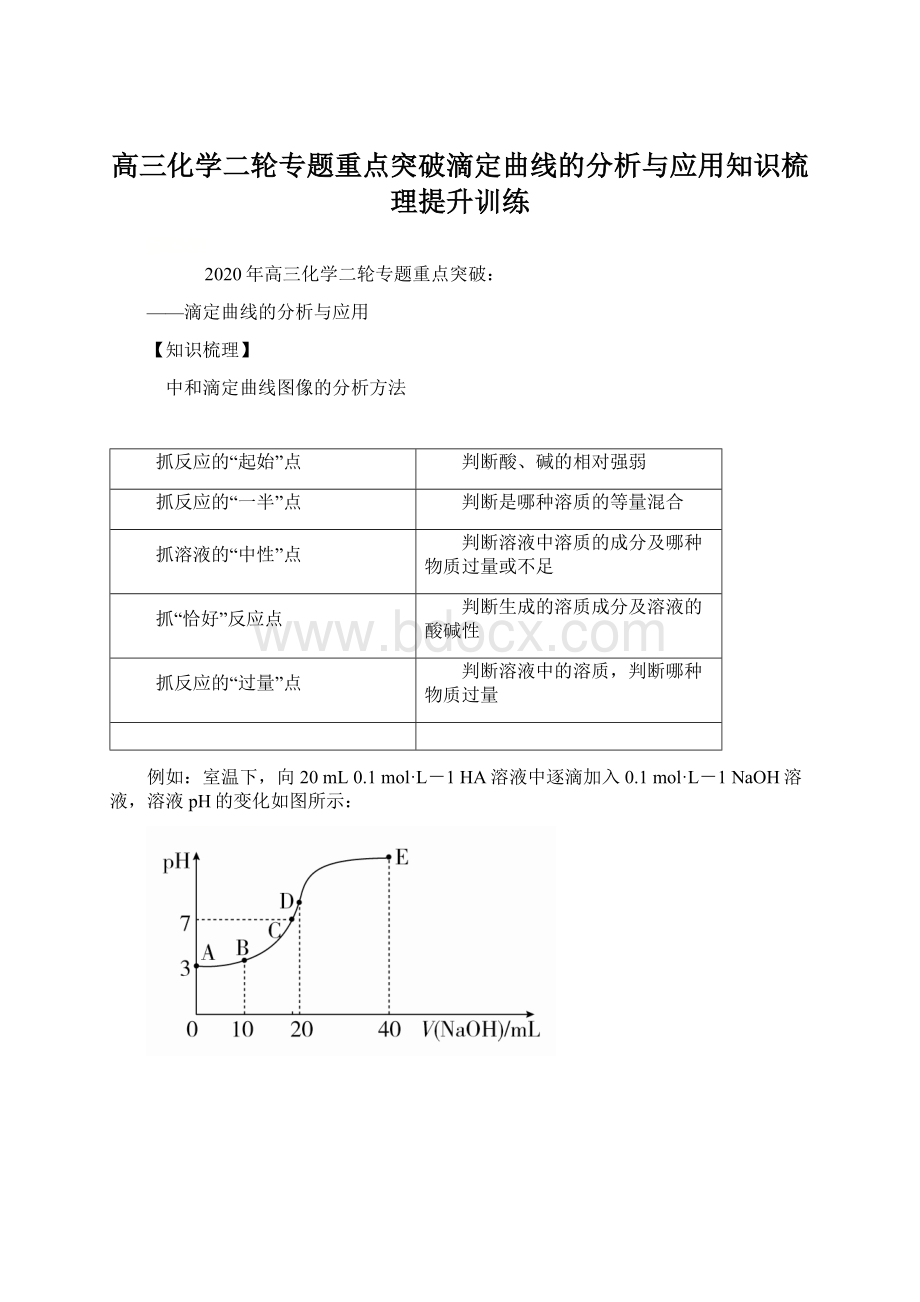
例如:
室温下,向20mL0.1mol·L-1HA溶液中逐滴加入0.1mol·L-1NaOH溶液,溶液pH的变化如图所示:
【提升训练】
1.(2019·北京高考)实验测得0.5mol·L-1CH3COONa溶液、0.5mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。
下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
答案 C
解析 升温,促进水的电离,溶液中的H+、OH-浓度均增大,但二者始终相等,溶液呈中性,A错误;升温,CH3COONa溶液中的水解平衡正向移动,c(OH-)增大,B错误;随温度升高,CuSO4溶液的水解平衡正向移动,水的电离平衡正向移动,因此CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果,C正确;随温度升高,CH3COONa溶液和CuSO4溶液的水解平衡均正向移动,CH3COONa溶液和CuSO4溶液的pH均降低,是Kw改变与水解平衡移动共同作用的结果,D错误。
2.常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述错误的是( )
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
答案 D
解析 由H2XH++HX-可知:
Ka1=
,则c(H+)=,等式两边同取负对数可得:
pH1=-lgKa1+lg。
同理,由HX-H++X2-可得:
pH2=-lgKa2+lg。
因1>Ka1≫Ka2,则-lgKa1<-lgKa2。
当lg=lg时,有pH1<pH2,故曲线N表示pH与lg的变化关系,曲线M表示pH与lg的变化关系,B正确。
由曲线M可知,当pH=4.8时,lg≈-0.6,由pH2=-lgKa2+lg可得:
lgKa2≈-0.6-4.8=-5.4,Ka2=10-5.4=100.6×10-6,故Ka2的数量级为10-6,A正确。
NaHX溶液中,<1,则lg<0,此时溶液pH<5.4,溶液呈酸性,所以c(H+)>c(OH-),C正确。
由图可知,当溶液呈中性时lg>0,则c(X2-)>c(HX-),D错误。
3.草酸(H2C2O4)是一种二元弱酸。
常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX[X表示或]随pH的变化关系如图所示。
下列说法不正确的是( )
A.直线Ⅰ中X表示的是
B.直线Ⅰ、Ⅱ的斜率均为1
C.c(HC2O)>c(C2O)>c(H2C2O4)对应1.22D.c(Na+)=c(HC2O)+2c(C2O)对应pH=7
答案 C
解析 根据电离常数表达式,可知=,=,又H2C2O4的第一步电离常数大于第二步电离常数,故当和相等时,前者对应溶液的pH小,则直线Ⅰ中X表示,A正确;由图像可知,当pH=1.22时,lg=0,则Ka1=c(H+)=10-1.22,当pH=0时,根据Ka1=10-1.22,可知lg=-1.22,即直线Ⅰ的斜率为1,同理根据pH=4.19时
lg=0和Ka2的表达式可求出pH=0时,
lg=-4.19,即直线Ⅱ的斜率也为1,B正确;结合题中浓度关系可知,<1、
>1,又=<1,则c(H+)>10-4.19mol·L-1,pH<4.19,=
·=·>1,则c(H+)<10-2.705mol·L-1,pH>2.705,综上,c(HC2O)>c(C2O)>c(H2C2O4)对应2.7054(2019·全国卷Ⅰ)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
[批注点拨]
[解析] 溶液导电能力的强弱与溶液中自由移动的离子浓度和种类有关,A正确;由图像知,a点到b点,HA-转化为A2-,b点导电能力相对于a点增强,可判断Na+和A2-的导电能力之和大于HA-的,B正确;b点为反应终点,发生的反应为2KHA+2NaOH===Na2A+K2A+2H2O。
因为H2A为弱酸,所以Na2A、K2A溶液显碱性,pH>7,C错误;c点为Na2A、K2A和NaOH的混合溶液,由于b点是反应终点,所以b点时c(Na2A)=c(K2A),c点又加入了NaOH溶液,故c点的c(Na+)>c(K+)又因为b~c点加入的NaOH溶液的体积小于a~b点加入的NaOH溶液的体积,所以c(K+)>c(OH-),故c(Na+)>c(K+)>c(OH-),D正确。
[答案] C
5.(2019·福建六校联盟高三联考)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示。
下列判断错误的是( )
A.三种酸的电离常数关系:
KHA>KHB>KHD
B.滴定至P点时,溶液中:
c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:
c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
答案 C
解析 根据三种酸的浓度均为0.1mol·L-1,结合滴定前三种酸溶液pH:
HAHA>HB>HD,由于酸性越强其电离常数越大,即电离常数:
KHA>KHB>KHD,A正确;由P点时中和百分数为50%,可知溶液中c(HB)=c(NaB),再结合此时溶液pH<7可知HB的电离程度大于B-的水解程度,结合电荷守恒c(Na+)+c(H+)=c(OH-)+c(B-),知c(B-)>c(Na+),B正确;NaOH滴定HA,根据电荷守恒可知,cA(Na+)+c(H+)=c(A-)+c(OH-),当溶液pH=7时,cA(Na+)=c(A-),同理cB(Na+)=c(B-)、cD(Na+)=c(D-),根据中和反应原理可知溶液呈中性时三种酸消耗的NaOH的量不同,故溶液中c(Na+)不同,则c(A-)、c(B-)、c(D-)不同,C错误;当中和百分数达100%时,将三种溶液混合,即溶液为NaA、NaB、NaD的混合液,根据质子守恒可知c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),即c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D正确。
6.(2019·安徽五校联盟高三质检)常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。
下列叙述不正确的是( )
A.该温度下,HClOH++ClO-的电离常数Ka的对数值lgKa=-7.54
B.氯水中的Cl2、ClO-、HClO均能与KI发生反应
C.pH=1的氯水中,c(Cl2)>c(Cl)>c(HClO)>c(ClO-)
D.已知常温下反应Cl2(aq)+Cl-(aq)Cl(aq)的K=0.191,当pH增大时,K减小
答案 D
解析 HClOH++ClO-的电离常数Ka的对数值lgKa=lg,根据图示,当溶液的pH=7.54时,HClO和ClO-的物质的量分数相等,即c(H+)=10-7.54时,c(HClO)=c(ClO-),代入得lgKa=-7.54,A正确;氯水中的Cl2、ClO-、HClO均有强氧化性,均能与KI发生反应,B正确;根据图示,pH=1的氯水中,c(Cl-)>c(Cl2)>c(Cl)>c(HClO)>c(ClO-),C正确;平衡常数只与温度有关,当pH增大时,K不变,D错误。
8.(2019·佛山市高三教学质量检测)常温下,向20mL0.1moL/L的H3PO4溶液中滴加0.1moL/L的NaOH溶液,所得溶液的pH与NaOH溶液体积的关系如图所示,下列说法正确的是( )
A.H3PO4溶液第一步滴定可用酚酞作指示剂
B.A点溶液中c(H2PO)>c(H3PO4)>c(HPO)
C.图像中A、B、C三处溶液中相等
D.B点溶液存在2c(Na+)=c(PO)+c(H2PO)+c(HPO)+c(H3PO4)
答案 C
解析 H3PO4溶液第一步滴定生成NaH2PO4,溶液呈酸性,变色范围约为4~5,可选用甲基橙作指示剂,故A错误;A点为NaH2PO4溶液,NaH2PO4在水溶液中,电离大于水解,A点溶液中c(H2PO)>c(HPO)>c(H3PO4),故B错误;温度相同,同一反应的平衡常数相同,HPO水解常数:
A、B、C三处溶液中
相等,故C正确;B点是Na2HPO4溶液,物料守恒为c(Na+)=2[c(PO)+c(H2PO)+c(HPO)+c(H3PO4)],故D错误。
9.(2019·成都市高三诊断)已知:
pCu=-lgc(Cu+),pX=-lgc(X-)(X-表示Cl-、Br-、I-)。
298K时,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。
在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。
下列说法正确的是( )
A.298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中x代表CuI曲线,且P点c(Cu+)=c(I-)
C.298K时,增大M点的阴离子浓度,则M点沿着曲线y向N点移动
D.298K时,CuBr(s)+I-(aq)CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
答案 D
解析 CuCl的饱和溶液中存在溶解平衡:
CuCl(s)Cu+(aq)+Cl-(aq),加入少量NaCl,c(Cl-)增大,平衡逆向移动,c(Cu+)减小,A错误;图中横、纵坐标之和pCu+pX=-lgc(Cu+)+[-lgc(X-)]=-lg[c(Cu+)·c(X-)]=-lgKsp(CuX),故横、纵坐标之和越小,对应的Ksp越大,因此x代表CuCl曲线,P点c(Cu+)=c(Cl-)或根据P点横、纵坐标均为3,c(Cu+)=c(X-)=10-3mol·L-1,计算出Ksp(CuX)=10-6,B错误;y代表CuBr曲线,增大M点的c(Br-),CuBr(s)Cu+(aq)+Br-(aq)平衡逆向移动,c(Cu+)减小