利血平的合成路线docWord文档格式.docx
《利血平的合成路线docWord文档格式.docx》由会员分享,可在线阅读,更多相关《利血平的合成路线docWord文档格式.docx(17页珍藏版)》请在冰豆网上搜索。
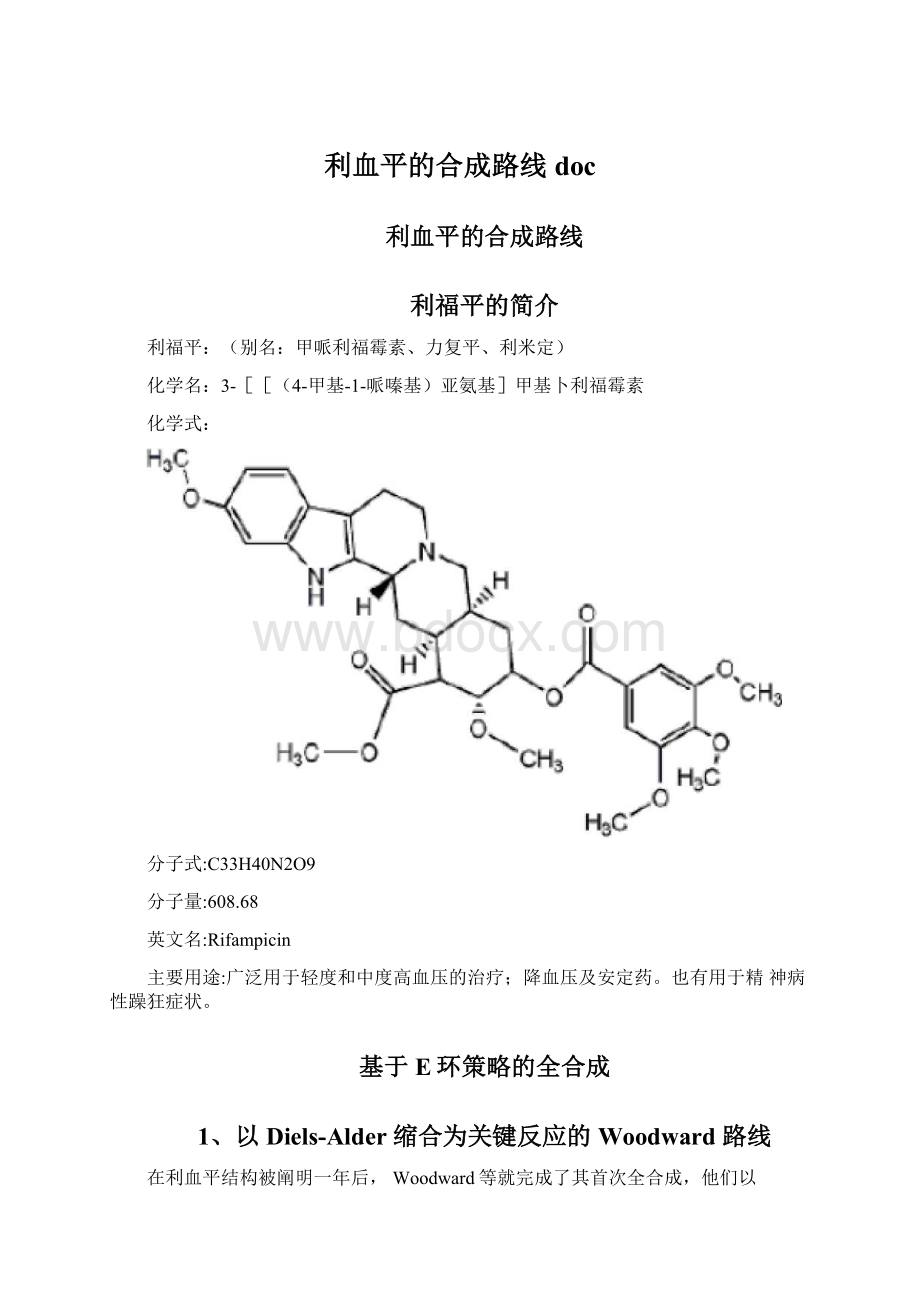
降血压及安定药。
也有用于精神病性躁狂症状。
基于E环策略的全合成
1、以Diels-Alder缩合为关键反应的Woodward路线
在利血平结构被阐明一年后,Woodward等就完成了其首次全合成,他们以
l,4-对苯二醒(I)和戊二烯酸⑵为起始原料(sehemel,经Diels-Alder缩合反应得到具有顺式稠合双环结构的加成物3,再经选择性还原、环氧化、分子内醋化和Meoein-Potmdorf-veriey还原,建立了3,5-氧桥和五环内醋,得到了不饱和酯7,其中所需的C3-R立体构型得以确立,接下来在2位立体选择性地引入甲氧基,这样就完成了E环五个相邻手性中心的构建。
然后通过NBS溴代、氧化、脱溴和3,5-醚桥键断裂得到不饱和酮酸11,接下来经酯化、双羟化和高碘酸氧化断裂将E
环所需官能团逐一展现,得到关键手性砌块醛酯13,与6-甲氧基色胺通过
Bischler-NaPieralski环化偶合构建了稠合的五环结构,再经还原亚胺离子得17,
此时C3位处于a构型,而非利血平结构中的3构型,Woodward通过将C-16,C-18
位内酯化的方法增加环内张力将C3位构型扭转为非稳定的B构型,从而建立了利血平结构中所有的六个手性中心,接下来的酯化、(+)-樟脑磺酸拆分完成了利
血平的全合成。
Scheme1*Woodward'
sSynrhesiftofReserpirie
73%from9
12
13
15
R«
C02M&
^Conditions:
(a)benzerWjnstlux;
(b)SaHH+:
(clGHSCO;
H;
MlNbOACjAc/h(e)AlOPrOh,j-PrC>
(f)NoOMe,McOH;
(g}NE?
St抽出SO*;
(h)CrOj,aq.AcOH;
(i)Zn.AcOH;
(j)CH小科鮒Ac;
O:
(IJOjO*;
佃)HIOt;
(n)CHt\i;
(o)NaBH41MeOH;
(p}POCh;
(q)MaSH^(r)KOH.MeOH;
倒DCC,pyryline;
rrflug
(u)NaOMc,MeOH;
(v)3t4.5-trimc£
hcx>
'
bcLzoylchloride;
|w)^camphor*10-sulfonicaciiLMeOH,CHCh;
(x)IWNsOH
缺点:
尽管Wbodward路线被视为有机合成的极高成就,但其仍存在一些薄弱环节,如:
(1)通过繁琐的内醋化来完成3位立体构型的转变;
(2)18位乙酸酷在最后阶段才转化为所需的三甲氧苯甲酸酷;
(3)在全合成的最后才进行拆分。
对
于这些缺点,后来的研究者们作出了许多改进,有的将拆分步骤放在合成的最初阶段,拆分试剂有麻黄碱、奎宁、辛可尼丁、番木鳖碱等,有的改进了中间体的还原方法,其中法国化学家Velluz的改进最为成功,并实现了工业应用。
2、以deMayo反应构建E环的Pearlman路线
在Woodward开拓性合成20年后,Pearlman报道了利用新奇的deMayo反应来构建E环前体的利血平的第二条全合成路线(Scheme2)该路线以1,4-二氢苯甲酸21为起始原料,经环氧化、开环、内酯化、甲基醚化、内酯开环得羟基酯25,其中利血平C16,C17,C18位的立体构型和所需官能团己得以建立,接下来与顺式丙烯酸内酯26缩合得到一对非对映异构体27和28,其中endo-27在光照下发生[2+2]环加成反应生成29,接下来断裂缩醛键、分子内酯化和Baeyer-vinager氧化得3-乙酞环丁烷酯31,在酸性甲醇中发生Aldol-内酯开环反应得具有利血平所需五个手性中心和官能团的缩醛32,经酯化得关键手性砌块33,33可经过与
Woodward路线中相似的步骤得到利血平。
尿henw*2*PwulmaJi^Synthtsi?
ofRcseqiljie
29
Tondilnxis:
(a)HCOjH.H(O;
(b)l«
cCp(c)MdhC或0*Aj/J;
仙McOH,H;
SO,'
(c)CiiSO^,(f)治aakine;
闆MeOH.⑷F£
CQ*H;
讪MeOlt,H曲①rd】哄®
记冶町扁i^icsch洒归
DMAPjk)50%^AcOH
该路线虽总收率低于1%,但由于原料价廉易得,中间体分离容易,仍不失为一个实用的合成路线。
3、以双Michael加成为关键反应的Stork路线
Stork于1989年报道了(-)-利血平的第一条立体专一性全合成路线,该路线以(S)-3-环己烯基甲酸34为原料(scheme3)经碘代、环氧化、硒化、脱硒成烯醇39,再经氧化转变为双Michael加成反应的前体烯醇锂盐41,与二甲基硅基丙烯酸酯42发生双Michael加成反应得具有五个所需手性中心的双环酮43,接下来将硅基
转化为羟基,环酮经Baeyer-Vinager氧化得内酯48,再经一锅煮的内酯开环还原反应得对映纯的关键手性砌块羟基醛50,50与六甲氧色胺14缩合并经过一个
strecker反应构建D环生成小氨基腈51,当直接在乙腈中热解51时,氰基脱离形成一个紧密离子对,叫垛基的a位碳从平伏位进攻烯胺离子,生成了C3-a构型
的异利血平醇54,而当在溶剂中加入银盐AgBF4,或当反应在盐酸中进行时,紧密离子对被打破形成自由离子对中间体53,吲哚基的a位碳就从轴向位进攻烯胺离子,生成C3-B构型的利血平醇55,再酯化就完成(-)-利血平的全合成。
Scheme3.*Stork'
sSynthesisofReserpine
3435
PhSe*
37
OH
38
、CO2M®
CH2OTs
MeO^C
freeIonpair
renditions:
(a)bKI,Na»
COltCH2ClrH2O(t:
lv/v),0°
C;
(b)DIBALH,THF,・78'
(c)N.H.BnBr,DMFt(d)
(PhSe)2.NaBH4,EtOH;
(c)30%出0“THF,0°
C-r.t.;
reflux,THF;
(f)p-nitrobenzoicacid.Ph*.DEAD.THF;
(g)LiNfSiMcj):
;
(h)BufNF,THF;
(i)hydrogenolysh;
(j)tosvlation;
(k)peracidtreatment;
tl)methylation:
(m)DrBALH^(n)hydrolysis;
(q)NaCN,AgH,(p)MeCN,△;
(q)AgBF^orH\THF;
(r)3t4hS-iriffleih0Kyhenmylchlnride;
Stork路线简洁、高效,并且解决了合成中C3位的立体定位显得更为令人瞩
目。
4、以系列自由基环化为关键反应的Fraser-Reid路线
1994年,Fraser-Reid小组报道了一条立体专一性的(-)-利血平全合成路线(Schemed该路线以D-葡萄糖的衍生物56为起始原料,经水解、对甲苯磺酸酯化和碘代生成碘代物57,接下来通过与三丁基丙烯酸酯进行自由基偶联引入丙烯酸酯基得到58,然后4位水解并引入一个带溴甲基的硅基作为自由基环化的前体,在AIBN的引发下发生两次高度区域选择性和立体选择性的自由基环化,生成笼状分子61,其中利血平E环所需的三个手性中心已得以建立,接下来通过Tamao氧化脱硅基得二醇62,62中的酯基通过硅基保护、LAH还原、甲磺酸酯化、硒氧消除和脱硅保护得两个差向异构体63和64的混和物,其中所需的64经David区域选择性臭氧氧化得酮65,再经一立体选择性还原得二醇67,这样,Woodward醛酯13中所需的五个手性中心就得以建立起来,接下来通过一系列官能团转化,如:
羟基保护、缩醛断裂引入侧链和PDC氧化、03氧化引入酯基和醛基得到Woodward醛酷13,最后与6-甲氧色胺偶联得就完成(-)-利血平的立体专一性全合成。
Schemed*Frawr-ReidSyntkesiso(Rcwrpine
47M«
XondiiifWS:
(91i)McUNs.McQH.)i)右Cl,卩yritfine.iii>
SikAcjO,別无;
{b)Bu^rCH^CHCOjEkA!
BNhPh尿:
(cr)McDH-EkN-liiO〔贮:
山(d)CTSiMe^H^r,EtjN.CHQj;
何Bu]SnCl1NaCNBHhAIBN;
(flHQhKHCOitKF.(gli>
TBSCI,imi血如c,DMF,油LAHhEtQ斶MbCIEi]NbCHjCLsidphSeS«
Ph.NaBbLH>
Obreflux,v)ftBu^NF,THF,(MMcOH.Wc:
STii)McOHJi^PbjP'
McCRKHMDS;
(i)Bu2SnOTMBS,(j)SaBH(OAckEA;
(k)TBDPSC1,Et3NHDMAP,(1}Mc!
fAgjO;
\m}l)AcOH^THFH:
O(4:
2:
)X90"
Cnii)PhiPCHjOMeCI;
BuLi.THF.iii)AcjO,pyrkfirK;
(ci)i)^Bxj4NFsTHFhii>
PDC,DMF,简TWCHK粘(o)i)AcOH,THEii)PDC,DMFriii)IMS-CHNs(p)OhMeOH,-刘弋thenMe;
S;
iqli)M曲氐CH.OH,Xti>
TM5-CHM>
iii】AcjO,pyridiiK.
Fraser-Reid路线步骤较长,操作繁琐,但显示了自由基环化反应在建立复杂立体结构中的巨大潜力。
5、以分子内Diels-Alder环化为关键反应的Liao路线
1996年台湾学者Liao报道了一条制备(土)-利血平的简洁路线,以烯丙醇和
4-羟基-3-甲氧基苯甲酸甲醋73为起始原料(scheme5)经一个氧化偶联得隐藏的邻苯二醒中间体96,紧接着发生分子内[4+2]环加成反应生成双环酮75,再NaBH4还原得一对差向异构体混和物endo-76和exo-77,其中exo-77经Michael加成、Swem氧化得一对异构体79和80,80经Sml2还原成醇81,将羟基保护为对甲苯磺酸酯后再Baeyer-Viiliger氧化得内酯82和83的混和物,83经还原开环得Stork醛50,接下来按Stork路线中的操作就完成(土)-利血平的全合成。
Scheme5/Liio^SynthesisofReserpine
-ConditiMK(1}Ph[(OAc)j,CH2€]s(b)NaBTL,McOH;
(c)MeOHhKjCO,,reflux;
(d)(COCI):
tMesSO.NEt^,
CHj0lh-7ST;
(c)Smt31