第二节几种重要的金属化合物Word格式.docx
《第二节几种重要的金属化合物Word格式.docx》由会员分享,可在线阅读,更多相关《第二节几种重要的金属化合物Word格式.docx(54页珍藏版)》请在冰豆网上搜索。
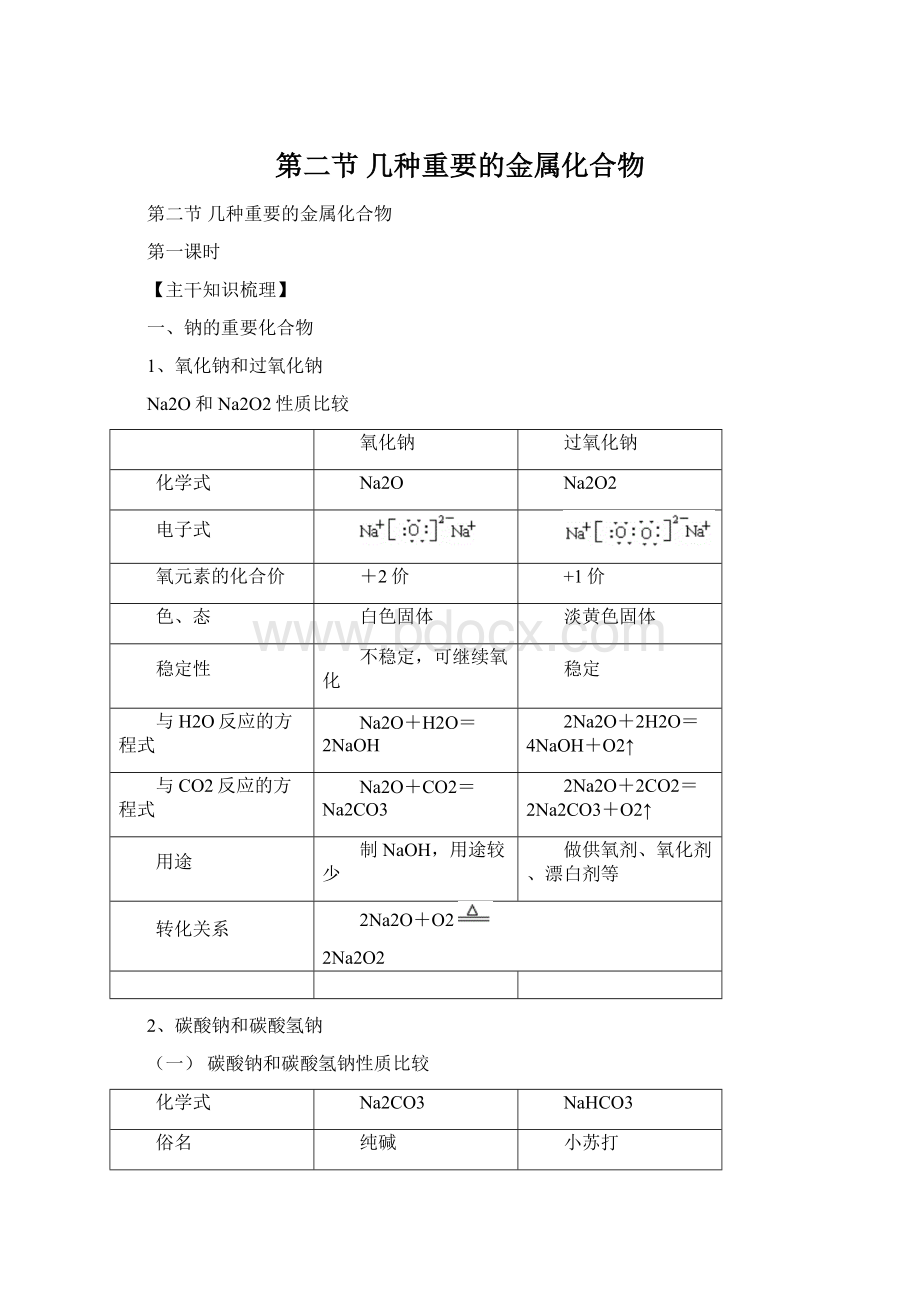
与CO2反应的方程式
Na2O+CO2=Na2CO3
2Na2O+2CO2=2Na2CO3+O2↑
用途
制NaOH,用途较少
做供氧剂、氧化剂、漂白剂等
转化关系
2Na2O+O2
2Na2O2
2、碳酸钠和碳酸氢钠
(一)碳酸钠和碳酸氢钠性质比较
Na2CO3
NaHCO3
俗名
纯碱
小苏打
颜色和状态
白色粉末(Na2CO3·
10H2O为晶体)
白色晶体
溶解性
易溶于水,溶液呈碱性
易溶于水(比Na2CO3小),溶液呈碱性
热稳定性
受热易分解其方程式
与酸反应
(离子方程式)
CO
+2H+=H2O+CO2↑
H++HCO3-=H2O+CO2↑
与Ca(OH)2等碱的反应
Ca2++CO32-==CaCO3↓
Ca2++OH-+HCO3-==CaCO3↓+H2O(碱足量)
Ca2++2OH-+2HCO3-==CaCO3↓+2H2O+CO32-
相互转化
3、焰色反应
很多金属或者它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,这叫做焰色反应。
该变化属于物理变化。
【重点难点讲练】
【要点透析】
一、过氧化钠性质:
实验室可利用Na2O2与H2O的反应快速制取O2;
Na2O2不是碱性氧化物;
Na2O2与H2O、CO2反应可以都放出大量的热。
证明方法是用脱脂棉包住Na2O2放在石棉网上,用胶头滴管向脱脂棉上滴加几滴水,或用玻璃管向脱脂棉吹CO2,脱脂棉燃烧。
点拨:
过氧化钠与水反应的实质
一般认为,过氧化钠与水的反应应分两步进行:
Na2O2+2H2O=2NaOH+H2O2(复分解反应);
2H2O2
2H2O+O2(分解反应)
失2×
e-
2Na2O2+4H2O=4NaOH+2H2O+O2
得2×
其总反应式及电子转移情况为:
由此可见,还原产物是H2O,氧化剂是Na2O2,还原剂是Na2O2。
例1、呼吸面具中的Na2O2可以与H2O、CO2反应,放出氧气。
若用KO2(超氧化钾)代替Na2O2,也可以起到同样的作用,生成K2CO3和O2。
4KO2+2CO2=2K2CO3+3O2;
由上述知识可知,解答下列问题:
(1)1摩尔Na2O2和KO2,分别与CO2反应,生成的氧气质量比是_______.
(2)你认为在呼吸面具或潜水艇中,选用_______做供氧剂更合适。
理由_______.
【解析】根据2Na2O2+2CO2=2Na2CO3+O2;
1molNa2O2与CO2反应生成O20.5mol;
1molKO2与CO2反应生成3/4molO2,所以相同条件下KO2产氧量高。
答案:
(1)2/3
(2)KO2,相同条件下KO2产氧量高。
例2、铁路提速为鲜活水产品、新鲜水果和蔬菜的运输提供了有利条件。
在鲜活鱼的长途运输中,必须考虑以下几点:
水中需要保持适量的O2;
及时除去鱼排出的CO2;
防止细菌的大量繁殖。
现有两种在水中能起供氧灭菌作用的物质,其性能如下:
过氧化钠(Na2O2):
易溶于水,与水反应生成NaOH和O2;
过氧化钙(CaO2):
微溶于水,与水反应生成Ca(OH)2(微溶)和O2。
根据以上介绍,你认为运输鲜活水产品时应选择加入水中。
原因是
解析:
此题综合性较强,考查了金属过氧化物的性质:
与水反应产生碱和氧气。
碱可以杀菌消毒,抑制细菌繁殖,还可以吸收鱼苗呼吸产生的CO2气体,但必须注意区别Ca(OH)2(微溶,碱性弱)和NaOH易溶性(碱性强)对鱼苗的损害。
过氧化钙(CaO2);
过氧化钠(Na2O2)与水激烈反应生成O2和强碱NaOH,对生物题杀伤能力较强。
小结:
学习Na2O2时除重点掌握它的和H2O、CO2的反应外还需知道Na2O2可以作为漂白剂的。
可设计实验:
向烧杯中加入一定量的水,再滴加两滴酚酞试液。
把少量固体Na2O2加入烧杯中,观察烧杯中溶液的变化;
然后再加入较多Na2O2固体;
(或者向盛水的烧杯中加入一有色羽毛,再加入一块固体过氧化钠)。
记录你观察到的现象。
二、有关钠的化合物的混合物的计算:
(1).NaHCO3和Na2CO3固体混合物加热。
仅发生反应2NaHCO3
Na2CO3+CO2↑+H2O,反应的差量即为分解产生的H2O和CO2,由差量法求解.
(2)amolNa2O2和bmolNaHCO3固体混合物在密闭容器中加热。
发生的反应按下列方式处理:
2NaHCO3
Na2CO3+CO2↑+H2O↑分解产生的CO2与Na2O2反应完后,若Na2O2过量,H2O再与Na2O2反应.
①当a/b<
1/2时,剩余固体为Na2CO3,排出气体为O2、H2O、CO2
②当a/b=1/2,剩余固体为Na2CO3,排出气体为O2、H2O
③当1/2<
a/b<
1,剩余固体为Na2CO3、NaOH,排出气体为O2、H2O
④当a/b=1时,剩余固体为Na2CO3、NaOH,排出气体为O2
⑤当a/b>1时,剩余固体为Na2CO3、NaOH、Na2O2,排出气体为O2
(3)NaHCO3和NaOH的混合物在密闭容器中加热
NaHCO3和NaOH在密闭容器中加热所发生的反应按下列方式处理;
首先考虑NaHCO3+NaOH===Na2CO3+H2O①若NaHCO3过量则再考虑2NaHCO3
Na2CO3+CO2↑+H2O↑②。
反应的差量可能是①造成的,也可能是①②共同造成,主要是看两者相对量的关系,所以首先讨论何者在①中过量是重要问题,然后再根据差量法进行进一步的计算。
讨论过量一般采用的方法是假设两者等物质的量按反应①,由差量法求得理论失重值,再进行判断:
若实际失重值小于或等于理论失重值,则n(NaHCO3):
n(NaOH)≤1:
1按反应①由差量法求算,质量减少为H2O的质量;
b、若实际失重值大于理论失重值,则n(NaHCO3):
n(NaOH)>
1:
1,按反应①和②由差量法求算,质量减少由两部分组成:
NaHCO3+NaOH===Na2CO3+H2O产生的水和由2NaHCO3
Na2CO3+CO2↑+H2O↑生成的H2O和CO2.
【例3】加热4.54gNa2CO3和NaHCO3的混合物至质量不再变化,剩余固体的质量为3.30g。
计算原混合物中NaCO3的质量分数。
【解析】2NaHCO3
Na2CO3+H2O+CO2,失去的质量为水和二氧化碳,题中失重为4.54g-3.30g=1.24g,则W(NaHCO3)=
×
2×
84g=3.36g,则W(Na2CO3)=4.54g-3.36g=1.18g,所以NaCO3的质量分数为
=26%
【答案】26%
【例4】有NaHCO3、Na2CO3、CaO、NaOH组成的混合物27.2g,把它们溶于水后,溶液中Ca2+、CO32—、HCO3—均转化为沉淀,将反应后的溶液蒸干,最后得到白色固体物质共29g,则原混合物中Na2CO3的质量是()
A、10.6gB、5.3g
C、5.9gD、无法确定
【解析】发生反应的方程式为:
⑴CaO+H2O=Ca(OH)2,
⑵2NaHCO3+Ca(OH)2=CaCO3↓+2H2O,
⑶Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
设Na2CO3为amol,NaHCO3为bmol,则CaO为(a+b)mol。
由于CaO+H2O=Ca(OH)2,使混合物增加了(a+b)mol水的质量;
由NaHCO3转化成CaCO3使混合物减轻了bmol水的质量,所以反应前后的质量差为amol水的质量。
依题意得a=1.8/18mol=0.1mol
【答案】A
解此类题目的要诀是合理分析反应的进行顺序,按方程式逐一分析。
三、焰色反应
很多金属或者它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,由该方法可鉴别物质。
焰色反应的实验
⑴、用品:
铂丝(或铁、铬、镍、钨等),酒精灯(或煤气灯),试剂。
⑵、操作:
洗——烧——蘸——烧
“洗”:
用稀盐酸洗涤铂丝。
“烧”:
在无色火焰上灼烧铂丝至火焰呈无色。
“蘸”:
蘸取试剂。
再次在无色火焰上灼烧,并观察火焰的颜色。
⑶、火焰的颜色
钠:
黄色;
钾:
紫色(透过蓝色钴玻璃);
钙:
砖红色
铜:
绿色
【例5】把物质灼烧时,焰色反应为黄色,下列判断正确的是()
A、该物质一定是钠的化合物
B、该物质一定含有钠元素
C、该物质一定是金属钠
D、不能确定该物质中是否含有钾元素
【解析】物质灼烧时火焰呈黄色,说明物质中一定含有钠元素。
由于钠元素的黄色火焰能够掩盖掉钾元素的紫色火焰,而该操作中并没有透过蓝色钴玻璃,因此无法确定是否含有钾元素。
【答案】B、D。
进行焰色反应实验步骤:
把铂丝或光洁无锈的铁丝,用蒸馏水洗净,放在酒精灯或煤气灯的外焰上灼烧,至没有颜色时为止,再蘸取溶液,在外焰上灼烧验,此时观察火焰的颜色。
【针对练习】
1.Na2O2与水反应能够产生O2,这一反应在呼吸面具、潜水艇及太空飞船中可为人体提供呼吸所用的O2。
下面对该反应的说法中正确的是()
A.这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂
B.这是一个氧化还原反应,Na2O2是氧化剂,水是还原剂
C.这是一个氧化还原反应,Na2O2是还原剂,水是氧化剂
D.这是一个置换反应,有单质O2产生
Na2O2与水反应能够产生O2,是一个自身氧化还原反应,Na2O2既是氧化剂,又是还原剂,所以A正确;
它不符合置换反应的条件,所以不是置换反应。
A
2、(04上海)等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
(A).3:
4:
1(B).3:
3:
2
(C).6:
7:
3(D).6:
9:
3.下列灭火剂能够扑灭金属钠着火的是()
A.干冰灭火器B.泡沫灭火器
C.干粉灭火器D.砂土
干冰是固态的CO2,干粉灭火器里的NaHCO3受热分解为CO2、H2O和Na2CO3,泡沫灭火器里既含有H2O,又含有CO2,它们都能与金属钠及燃烧产物Na2O2发生反应,因此它们都不能用作钠的灭火器剂。
钠着火后,应用沙土盖灭。
D
4.(06年1月西城区抽样测试)取ag某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质量增加了bg。
若b>a,则A为()
(A)H2(B)CO
(C)C12H22O11(D)C6H12O6
C
5.关于Na2O和Na2O2的叙述正确的是( )
A.都是白色的固体
B.都是碱性氧化物
C.都能和水反应形成强碱溶液
D.都是强氧化剂
6.(06年湖南省百校大联考)将含有O2和CH4的混合气体置于盛有23.4gNa2O2的密闭容器中,电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体产生。
下列叙述正确的是
A.原混合气体中O2和CH4的体积比为2∶1
B.残留物只有Na2CO3
C.原混合气