水的电离和溶液的pHWord格式.docx
《水的电离和溶液的pHWord格式.docx》由会员分享,可在线阅读,更多相关《水的电离和溶液的pHWord格式.docx(22页珍藏版)》请在冰豆网上搜索。
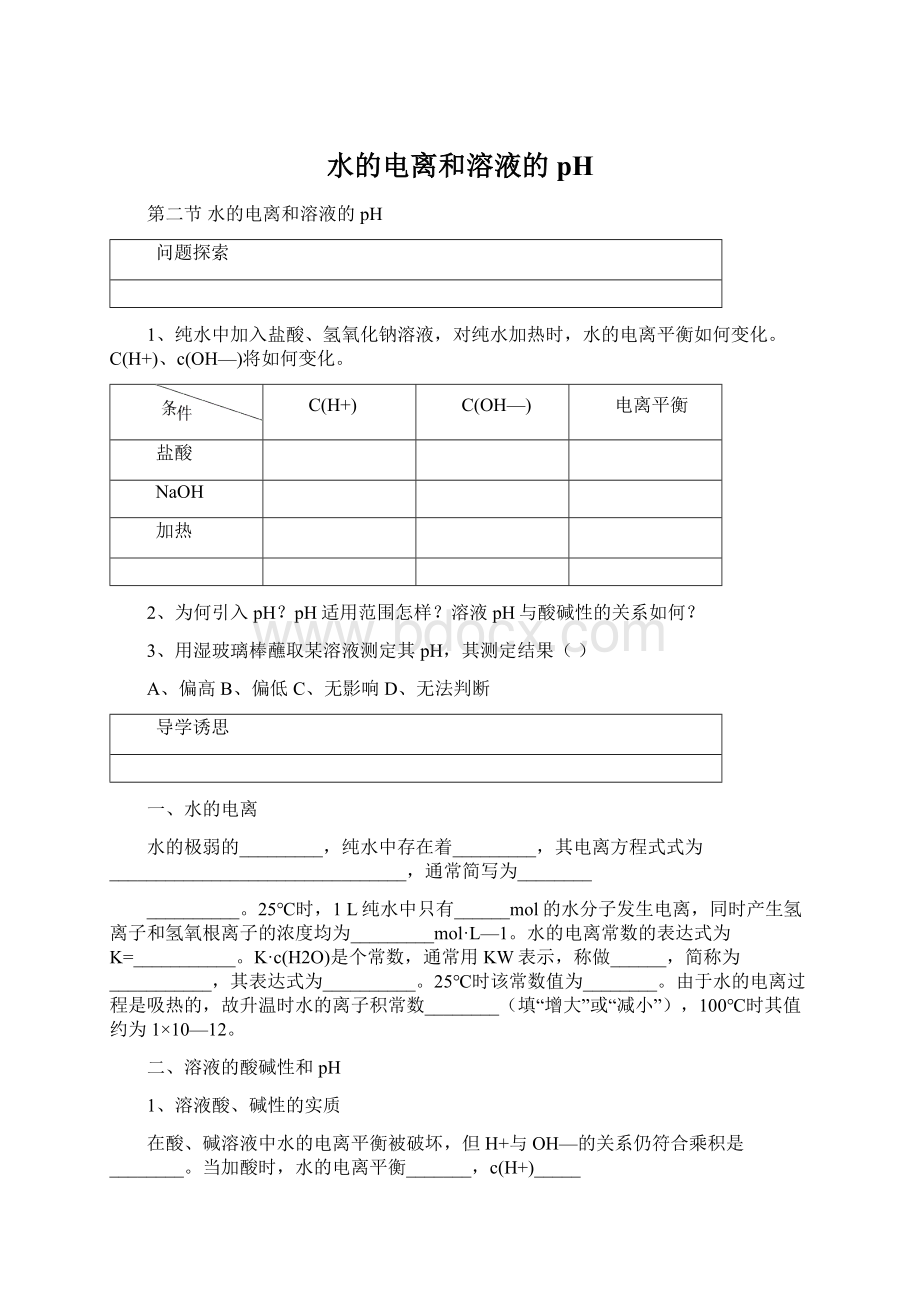
c(H2O)是个常数,通常用KW表示,称做______,简称为___________,其表达式为__________。
25℃时该常数值为________。
由于水的电离过程是吸热的,故升温时水的离子积常数________(填“增大”或“减小”),100℃时其值约为1×
10—12。
二、溶液的酸碱性和pH
1、溶液酸、碱性的实质
在酸、碱溶液中水的电离平衡被破坏,但H+与OH—的关系仍符合乘积是________。
当加酸时,水的电离平衡_______,c(H+)_____
c(OH—)。
所以说,溶液酸、碱性的实质是溶液中的c(H+)和c(OH—)的相对大小问题。
2、溶液酸碱性的表示方法——pH
(1)定义pH=___________
(2)意义pH大小能反映出溶液中c(H+)的大小,即能表示溶液的酸碱性强弱。
pH<
7溶液呈________。
PH越小,溶液酸性越________;
pH每减小1个单位,c(H+)________。
pH>
7溶液呈________,pH越大,溶液的碱性越_______;
pH每增加1个单位,c(OH—)增大_______。
(3)pH的适用范围
当溶液的酸碱性用pH表示时,其c(H+)的大小范围一般为:
1×
10—14mol·
L—1<
c(H+)<
1mol·
即14>
注意点:
当c(H+)≥1mol·
L—1、c(OH—)≥1mol·
L—1时,一般不用pH表示溶液的酸碱度,用物质的量浓度直接表示溶液的酸、碱性更方便。
(4)溶液酸碱性的判断
①利用c(H+)和c(OH—)的相对大小判断
若c(H+)>
c(OH—),则溶液呈__________;
若c(H+)<
c(OH—),则溶液呈__________。
②利用pH判断
若溶液的pH<
7,则溶液呈________;
若pH=7,则溶液呈_____;
若pH<
7,则溶液呈_______。
①是无条件的,任何温度、浓度都适用。
②是有条件的,适用温度为25℃。
在100℃时,KW=10—12,pH=6为中性,pH>
6为碱性,pH<
6为酸性。
(5)溶液pH的测定方法
测定溶液的pH可用pH试纸,这种试纸在使用时不能用水湿润,否则非中性溶液的pH测定值比实际pH或大或小。
使用时_________________________。
精确测定溶液的pH应使用______。
热点透视
25℃时水的电离平衡
H2OH++OH—若改变外界条件,水中的c(H+)、pH、酸碱性、水的电离程度及c(H+)与c(OH—)的乘积将发生什么变化?
用增大(强)、减小(弱)、不变、酸性、碱性、不变等将结果填入下表:
改变的条件
水的电离程度
pH
酸碱性
C(H+)·
c(OH—)
(1)通入CO2气体
(2)通入NH3
(3)通入HCl气体
(4)加入NaOH固体
(5)加热
[例1]在95℃时,纯水的pH_______(填“大于”“小于”“等于”)7,所选择的理由是_______________________________。
解析:
本题考查影响水电离的因素、温度与pH及KW的关系,已知室温时,纯水中的c(H+)=c(OH—)=10—7mol·
L—1,而水存在着如下电离H2OH++OH——Q,故升高温度,水的电离程度增大,致使c(H+)=c(OH—)>
10—7mol·
L—1,即pH<
7。
答案:
小于。
因25℃时纯水的pH=7,当升高温度时,水的电离程度增大,c(H+)也增大,故pH减小。
[例2]pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是()
A、11:
1B、9:
1C、1:
11D、1:
9
本题考查pH概念及计算方法。
PH=13的强碱溶液中,c(H+)=10—13mol·
L—1,其c(OH—)==0.1mol·
L—1;
pH=2的强酸溶液中,c(H+)=0.01mol·
混合物的pH=11,则
c(OH—)强==1×
10—3mol·
L—1
设碱的体积为V(碱):
酸的体积为V(酸),则有:
解得:
D
[例3]25℃时,pH=2的HCl溶液中,由水电离出的H+离子浓度是
A、1×
L—1B、1×
10—12mol·
C、1×
10—2mol·
L—1D、1×
10—14mol·
pH=2的HCl溶液中,由水电离出的H+离子浓度等于溶液中OH—离子的浓度。
则
mol·
B
素能培养
一、选择题
1、常温下,在0.1mol·
L—1CH3COOH溶液中,水的离子积是
10—14B、1×
10—13
C、1.32×
10—14D、1.32×
10—15
2、能影响水的电离平衡,并使溶液中的c(H+)>
c(OH—)的操作是
A、向水中投入一小块金属钠
B、将水加热煮沸
C、向水中通入二氧化碳气体
D、向水中加食盐晶体
3、将0.23g钠投入到100mL水中充分反应后所得溶液的密度为1g/cm3,则该溶液的pH为(温度为25℃)
A、1B、13C、12D、10
4、在100℃时,水的离子积为1×
10—12,若该温度下某溶液中的H+浓度为1×
L—1,则该溶液
A、呈碱性B、呈酸性
C、呈中性D、c(OH—)=100c(H+)
5、0.01mol·
L—1NaOH溶液中的c(H+)是0.0005mol·
L—1Ba(OH)2溶液中c(H+)的
A、10倍B、20倍C、倍D、倍
6、下列酸溶液的pH相同时,其物质的量浓度最小的是
A、H2SO3B、H2SO4C、CH3COOHD、HNO3
7、将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的
A、pH=9B、c(OH—)≈10—1mol·
C、ph≈7D、c(OH—)≈10—7mol·
8、在pH=1的硫酸溶液中,由水电离出H+的浓度为
A、0B、0.1mol·
C、10—7mol·
L—1D、10—13mol·
9、下列各碱溶液,当其pH相同时,物质的量浓度最大的是
A、KOHB、NH3·
H2OC、Ba(OH)2D、NaOH
10、体积相同,pH也相同的HCl、HNO3、CH3COOH分别与足量的NaHCO3反应,产生CO2的体积
A、同样多B、HCl最多
C、HCl、HNO3一样多D、CH3COOH最多
11、下列说法中正确的是
A、100mLpH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等
B、100mL1mol·
L—1的盐酸和50mL2mol·
L—1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等
C、100mLpH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等
D、100mL0.1mol·
L—1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的2倍
12、把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是
A、10:
1B、1:
10C、1:
100D、1:
2
13、向100mLpH=1的H2SO4溶液中,滴加0.01mol·
L—1的NaOH溶液,当所得混合液的pH为2时,加入NaOH溶液的体积是
A、10mLB、90mLC、100mLD、450mL
14、下列试纸中,在测溶液的性质时,预称不能用蒸馏水润湿的是
A、石蕊试纸B、醋酸铅试纸
C、KI淀粉试纸D、pH试纸
15、下列各组溶液充分混合后,混合液的pH一定大于7的是
A、pH=3的醋酸与pH=11的NaOH等体积混合
B、pH=2的盐酸与pH=12的Ba(OH)2等体积混合
C、0.1mol·
L—1的酸性溶液与0.2mol·
L—1的碱性溶液等体积混合
D、pH=9的溶液稀释1000倍
16、某温度下,重水D2O的离子积为1.6×
10—15,若用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是
A、中性溶液的pD=7.0
B、含0.01mol的NaOD的D2O溶液1L,其pD=12.0
C、溶解0.01mol的DCl的D2O溶液1L,其pD=2.0
D、在100mL0.25mol·
L—1的DCl重水溶液中,加入50mL0.2mol·
L—1的NaOD的重水溶液,其pD=1.0
二、填空题
17、在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbLNaOH溶液,问:
(1)若a+b=14,则Va/Vb=___________
(2)若a+b=13,则Va/Vb=___________
(3)若a+b>
14,则Va/Vb=___________,且Va_____Vb(填“>
”“<
”“=”)(题中a≤b,b≥8)
阅读思考
阅读材料1
在一定温度下,由水电离的H+和OH—的物质的量浓度之间存在如下关系:
c(H+)·
c(OH—)=KW。
同样,对于难溶盐MA,其饱和溶液中的M+和A—的物质的量浓度之间也存在类似关系:
c(M+)·
c(A—)=K。
现将足量的AgCl分别放入5mL水、10mL0.2mol·
L—1MgCl2溶液、20mL0.5mol·
L—1NaCl溶液和40mL0.3mol·
L—1HCl溶液中溶解并达到饱和,各溶液中Ag+离子浓度的数值依次为a、b、c、d,a、b、c、d由大到小的排列顺序为__________。
阅读材料2
已知AnBm的离子积=c(Am+)nc(Bn—)m式中的c(Am+)和c(Bn—)表示离子的物质的量浓度,若某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度为1g·
mL—1。
思考:
(1)Ca(OH)2的离子积为________。
(2)溶液离子积只与温度有关,向Ca(OH)2饱和溶液中加入CaCl2,使Ca2+浓度为0.4mol·
L—1,溶液的pH=________。
第三节盐类的水解
1、某溶液中由水电离出的c(H+)=1×
10—13mol·
L—1,则该溶液的酸碱性如何?
2、KNO3溶液中含杂质Fe3+,可用加热法除去Fe3+,试说明理由,并写出有关离子方程式。
3、在用MgCl2·
6H2O制取无水MgCl2时,可在干燥的氯化氢气流中加热使之失去