全国市级联考安徽省宣城市学年高一下学期期末调研测试化学试题Word格式.docx
《全国市级联考安徽省宣城市学年高一下学期期末调研测试化学试题Word格式.docx》由会员分享,可在线阅读,更多相关《全国市级联考安徽省宣城市学年高一下学期期末调研测试化学试题Word格式.docx(11页珍藏版)》请在冰豆网上搜索。
得分
注意事项.
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
评卷人
一、选择题(题型注释)
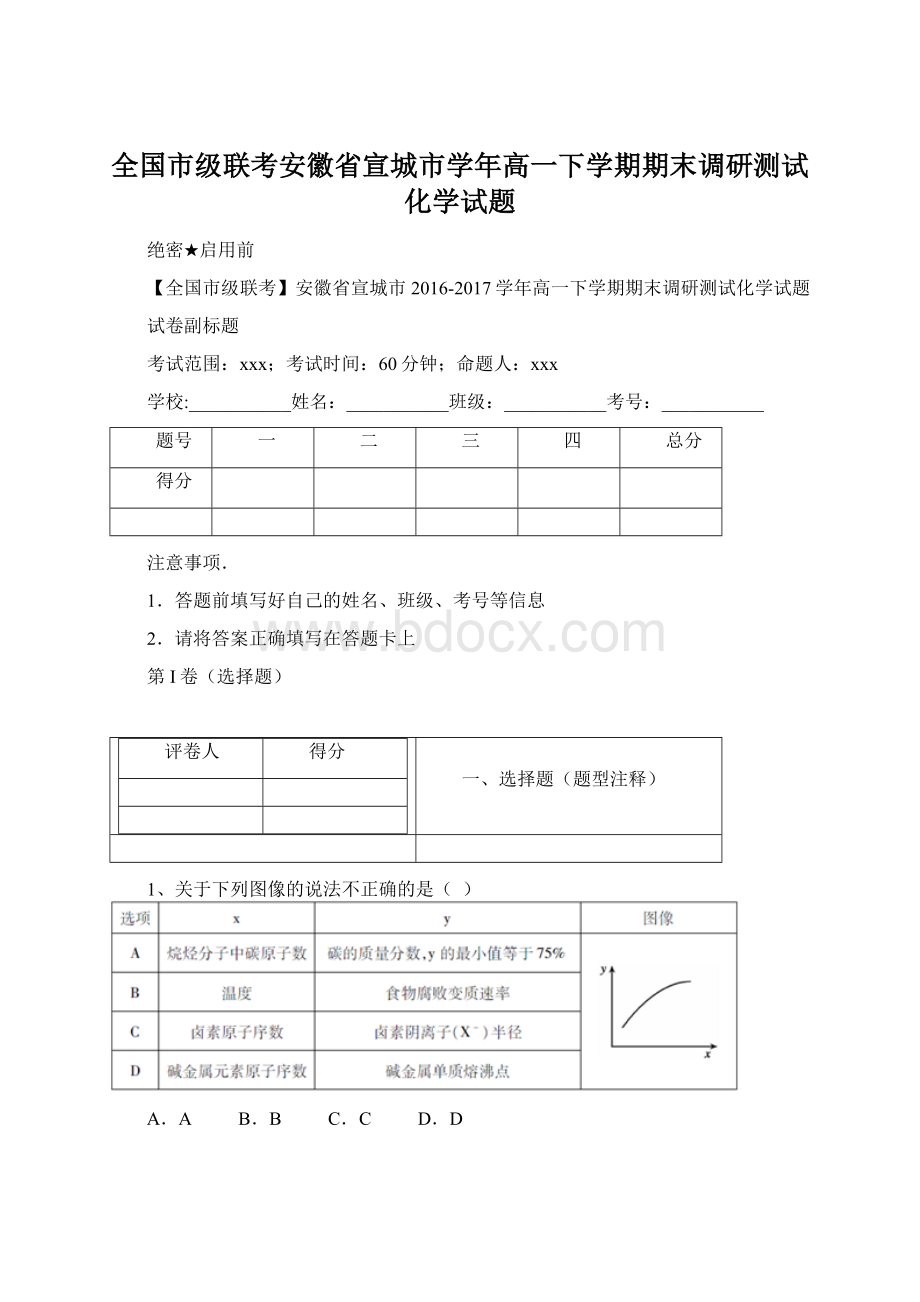
1、关于下列图像的说法不正确的是(
)
A.A
B.B
C.C
D.D
2、短周期主族元素X、Y、Z、W的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素,Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族。下列说法正确的是(
A.原子半径:
Y<
Z<
W
B.由Y、Z组成的化合物是两性氧化物
C.W的简单气态氢化物的热稳定性比Y的强
D.由X、Y组成的化合物只有两种
3、下列有关实验操作和现象、结论都正确的是(
4、某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是(
A.锌片作正极
B.铜片上有气泡产生
C.将电能转化为化学能
D.电子由铜片经导线流向锌片
5、下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是(
A.制取SO2
B.验证漂白性
C.收集SO2
D.尾气处理
6、在一定条件下,对于密闭容器中进行的可逆反应:
2SO2(g)+O2(g)2SO3(g)。下列说法错误的是(
A.改变反应条件可以改变该反应的限度
B.增大压强,正逆反应速率都增大
C.达到平衡时,SO2、O2、SO3在容器中共存
D.达到平衡时,SO2与SO3的浓度相等
7、已知反应A+B=C+D的能量变化如图所示,下列说法正确的是(
A.若此反应过程中有电子转移,可设计成原电池
B.该反应为放热反应
C.该反应在常温下也有可能进行
D.反应物的总能量高于生成物的总能量
8、下列物质转化常通过加成反应实现的是(
A.
B.CH2=CH2→CH2BrCH2Br
C.CH4→CH3Cl
D.CH3CH2OH→CH3CHO
9、等质量的下列烃完全燃烧,消耗O2最多的是(
A.CH4
B.C2H4
C.C2H6
D.C4H10
10、2016年IUPAC命名117号元素为Ts(中文名“”,tiá
n),Ts的原子核外最外层电子数是7。下列说法不正确的是(
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
11、下列化学用语表示正确的是(
A.乙醇的结构简式:
C2H6O
B.氯化氢的电子式:
C.CH4分子的比例模型:
D.镁离子的结构示意图:
12、下列关于浓硝酸的说法正确的是
A.保存在棕色瓶中
B.不易挥发
C.与铜不反应
D.受热不分解
13、下列有关苯、乙酸、乙醇说法正确的是
A.都易溶于水
B.苯易与液溴发生加成反应
C.乙酸溶液显酸性
D.乙醇不能与金属钠反应
14、用下列物质冶炼相应金属时,需加入还原剂的是(
A.HgO
B.Al2O3
C.Fe2O3
D.NaCl
15、海水中有着丰富的化学资源。仅通过物理方法就能从海水中获得的物质是(
A.淡水
B.氯气
C.烧碱
D.碘
16、古丝绸之路贸易中的下列商品,主要成分属于无机物的是()
第II卷(非选择题)
二、填空题(题型注释)
17、能源是经济增长与社会发展的重要物质基础,美国马奇蒂博士对世界一次能源替代趋势曾作如下预测:
回答下列问题:
(1)上图化石能源中属于较清洁的能源是_________。
(2)核电厂的燃料一般由0.71%235U、99.28%238U及0.0058%234U组成
①235U、238U、234U三种核素之间的关系是______________。
②235g核素发生裂变反应:
,净产生的中子数为_______。
(3)下图是氢能的制备及利用的途径之一,涉及能量转化方式有___________。(填代号)
a光能→化学能
b电能→化学能
c化学能→电能
(4)目前实现煤的综合利用的主要途径是煤的干馏、煤的气化和液化。
①煤的干馏属于变化______________。(填物理或化学)
②煤的气化过程发生的主要反应是____________。
(5)可燃冰属于新能源,我国是全球第一个成功稳定开采可燃冰的国家。某种可燃冰(甲烷水合物)晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,则这种可燃冰的平均组成可表示为____________。
三、简答题(题型注释)
18、孔雀石的主要成分为CuCO3·
Cu(OH)2。某同学设计从孔雀石中冶炼铜的方案如下:
(1)将孔雀石粉碎的目的是_________,加入过量稀硫酸,可观察到的现象是_________。
(2)操作a的名称是________,在滤液中加入过量铁粉发生的反应有_______、________(用离子方程式表示)。
(3)A的化学式为_________,在悬浊液中加入A的目的是___________。
(4)从滤液中获得铜的另外一种方案是:
2CuSO4+2H2O2Cu+O2↑+2H2SO4。现有111kgCuCO3·
Cu(OH)2,通过这种方案理论上可以制取_________kg铜。
(5)请你根据提供的试剂,设计由孔雀石冶炼铜的另外一种方案(请用简洁的文字说明)__________。(可供选择试剂:
铁粉、稀硫酸)
19、下面为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
(1)元素④的原子结构示意图为___________,元素⑦在自然界的存在形态是__________。
(2)用电子式表示元素⑤、⑧形成化合物的过程_____________。
(3)元素①③形成的最简单氢化物化学式是__________,写出实验室制备此物质的化学方程式___________。
(4)元素⑥的单质与磁性氧化铁反应的化学方程式___________。
(5)由元素②形成的只有三种同分异构体的烷烃是_________(填化学式),这三种同分异构体的结构简式分别是CH3CH2CH2CH2CH3、___________、___________。
四、推断题(题型注释)
20、已知:
有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料制备乙酸乙酯,其合成路线如下图所示:
(1)有机物A的结构简式是________,D分子中官能团的名称是_________。
(2)反应①和④的反应类型分别是:
_______、____________。
(3)反应④的化学方程式是__________,利用该反应制取乙酸乙酯的原子利用率为____________。
(4)某同学用下图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲上层为透明且不溶于水的油状液体。
①实验结束后,振荡试管甲,有无色气泡生成,其主要原因是__________(用化学方程式表示)。
②除去乙酸乙酯中混有的少量乙酸和乙醇,应加入________,分离时用到的主要仪器是_________。
参考答案
1、D
2、B
3、D
4、B
5、B
6、D
7、C
8、B
9、A
10、D
11、C
12、A
13、C
14、C
15、A
16、A
17、
天然气
同位素
9NA(或9×
6.02×
1023)
a、c
化学
C+H2O(g)CO+H2
CH4·
8H2O
18、
增大接触面积、加快反应速率(或提高原料浸出率等)
固体溶解,生成蓝色溶液和无色气体
过滤
Fe+Cu2+=Fe2++Cu
Fe+2H+=Fe2++H2↑
H2SO4
除去未反应的Fe
64kg
先将孔雀石加热分解生成CuO,再用铁屑和稀硫酸反应产生的氢气在加热条件下还原氧化铜(其它合理答案即可)
19、
化合态和游离态
NH3
2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
8Al+3Fe3O44Al2O3+9Fe
C5H12
CH3CH(CH3)CH2CH3
C(CH3)4
20、
CH2=CH2
羧基
加成反应
酯化反应(或取代反应)
CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
83%
2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O
饱和碳酸钠溶液
分液漏斗
【解析】
1、A、烷烃中随着碳原子数的增多,碳的质量分数增多,甲烷是最简单的烷烃,其中C的质量分数为75%,故A说法正确;
B、升高温度,加快反应速率,故B说法正确;
C、同主族从上到下,电子层数增多,半径增大,电子层数越多,半径越大,故C说法正确;
D、碱金属从上到下,熔沸点降低,故D说法错误。
2、X的最高正价与最低负价的代数和为2,X为N或P,Y是地壳中含有最多的元素,即Y为O,因为元素的原子序数依次增大,因此X为N,Z原子的最外层电子数是Y原子的最外层电子数的一半,Z为Al,W与Y同主族,则W为S,A、电子层数越多,半径越大;
电子层数相等,半径随着原子序数的递增而减小,因此原子半径大小顺序是Al>
S>
N>
O,故A错误;
B、组成的化合物是Al2O3,属于两性氧化物,故B正确;
C、同主族从上到下非金属性减弱,非金属性越强,其氢化物越稳定,因此H2O的稳定性