届高考备考化学二轮提升训练工艺流程题答案 解析Word格式文档下载.docx
《届高考备考化学二轮提升训练工艺流程题答案 解析Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《届高考备考化学二轮提升训练工艺流程题答案 解析Word格式文档下载.docx(18页珍藏版)》请在冰豆网上搜索。
(3)“沉降”操作时加入冰水的作用是__。
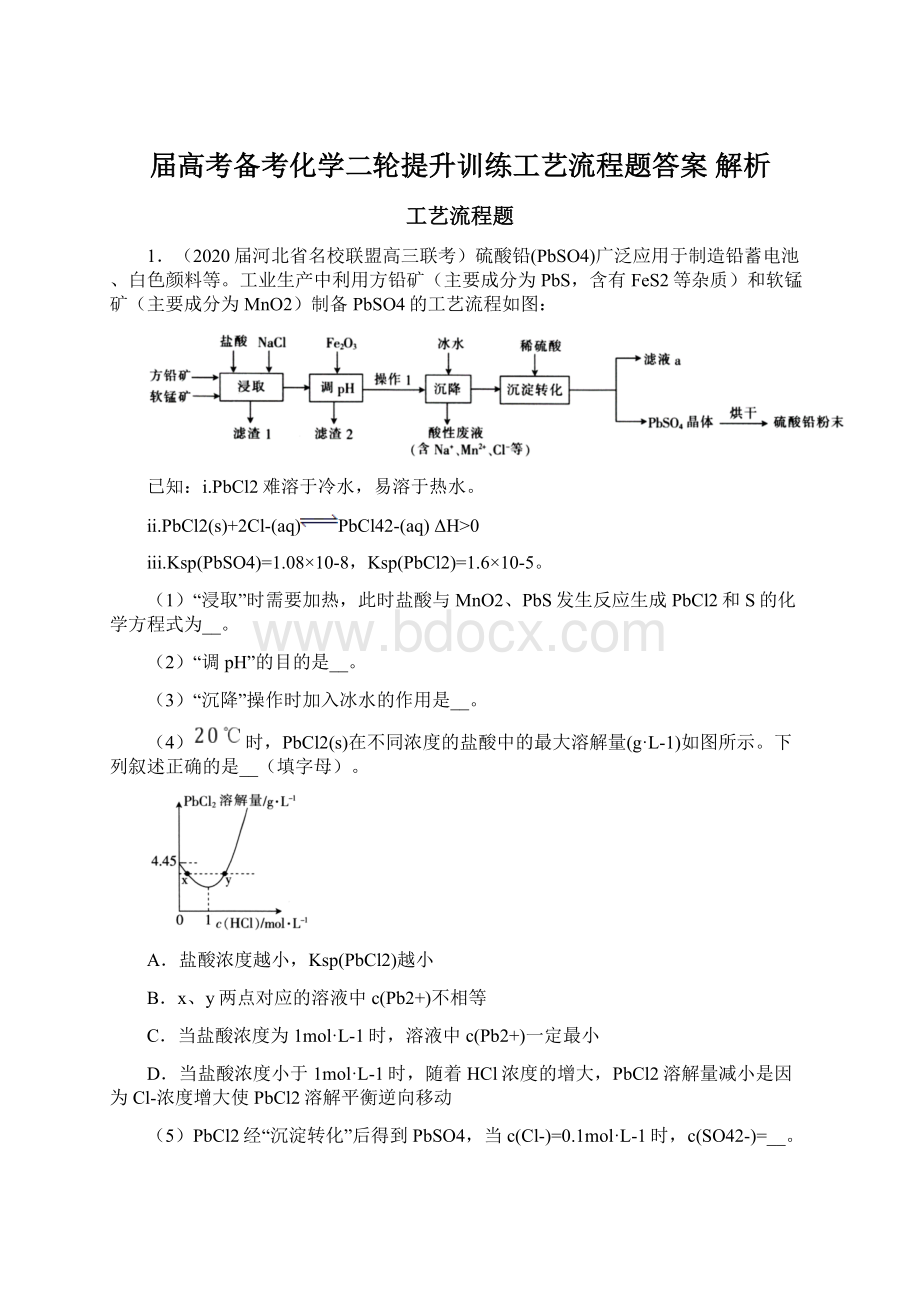
(4)时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·
L-1)如图所示。
下列叙述正确的是__(填字母)。
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·
L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·
L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·
L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。
利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·
PbSO4·
H2O),该反应的化学方程式为__。
【答案】
(1)MnO2+PbS+4HC1PbC12+S+MnC12+2H2O
(2)除去Fe3+(3)温度降低,PbC12+2C1-PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体(4)BD(5)6.75×
10-6mo1•L-1(6)浸取4PbSO4+6NaOH=3PbO•PbSO4•H2O+3Na2SO4+2H2O
【分析】
方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)中加入稀盐酸,盐酸与MnO2、PbS发生反应生成PbCl2和S,MnO2被还原成Mn2+,加入的NaCl可促进反应PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)平衡正向移动使更多的Pb元素存在于溶液中;
加入Fe2O3溶液调节溶液pH,使铁离子转化成氢氧化铁沉淀除去,然后过滤;
PbCl2难溶于冷水,将滤液冷水沉降过滤得到PbCl2晶体,之后加入稀硫酸发生沉淀转化,生成硫酸铅晶体,过滤得到晶体烘干得到硫酸铅粉末,滤液a中主要成分为HCl。
【详解】
(1)根据题意可知该过程中MnO2将PbS2中的S元素氧化成S单质,锰元素被还原成Mn2+,根据电子守恒和元素守恒可得方程式为MnO2+PbS+4HClPbCl2+S+MnCl2+2H2O;
(2)调节pH的主要目的是使Fe3+转化为沉淀,从而除去;
(3)温度降低,PbC12+2C1-PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体),所以沉降时加入冰水;
(4)PbCl2是微溶化合物,溶于水存在平衡:
PbCl2(s)Pb2+(aq)+2Cl-(aq),由图象可知在浓度为1mol/L时溶解量最小;
结合题目所给信息可知,小于1mol/L时,主要是电离出的氯离子抑制氯化铅的溶解,大于1mol/L时,可发生PbCl2(s)+2Cl-(aq)PbCl42-(aq),而促进溶解。
A.Ksp(PbCl2)只受温度的影响,温度不变,则Ksp(PbCl2)不变,故A错误;
B.根据分析可知x、y两点对应的溶液中的溶质不同,所以c(Pb2+)不相等,故B正确;
C.根据分析可知当盐酸浓度大于1mol/L之后,主要发生反应:
PbCl2(s)+2Cl-(aq)PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
D.根据分析可知盐酸浓度小于1mol·
L-1时,主要存在平衡PbCl2(s)Pb2+(aq)+2Cl-(aq),氯离子的增多使平衡逆向移动,故D正确;
综上所述选BD;
(5)沉淀转化的方程式为PbCl2(s)+SO42-(aq)⇌PbSO4(s)+2Cl-(aq),该反应的平衡常数K=,所以当c(Cl-)=0.1mol/L时,c(SO42-)=6.75×
10-6mol/L;
(6)发生沉淀转化后,滤液a中的主要溶质为HCl,所以经处理后可以返回到浸取工序循环使用;
反应物有PbSO4和NaOH,生成中有3PbO·
H2O,根据元素化合价的变化可知该反应不是氧化还原反应,根据元素守恒可得方程式:
4PbSO4+6NaOH=3PbO·
H2O+3Na2SO4+2H2O。
2.(2020届安徽省皖南八校高三临门一卷)镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。
以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
已知物质的还原性:
Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。
阳极泥的成分为___________________(写名称)。
(1)2FeS+3O22FeO+2SO2
(2)增大接触面积,提高浮选率(3)镍在焰色反应中,火焰呈无色,不影响其他金属元素的焰色(4)SiO2+2FeOFe2SiO4(5)NiS-2e-=Ni2++S(6)pH<
2时,溶液中c(H+)较大,H+易在阴极放电;
pH>
5时,Ni2+易形成Ni(OH)2沉淀铜
Fe>Ni>H2>Cu,根据工艺流程分析可知,硫化镍矿在“熔炼”过程中,通入氧气后发生氧化还原反应,生成可用于制取硫酸的SO2,并得到低镍矿,向低镍矿中加入石英发生反应SiO2+2FeOFe2SiO4,得到高镍矿,再经破碎、细磨后得到镍矿粉进行浮选,进而得到含有少量CuS的NiS,接着在NiSO4作电解质溶液的条件下进行电解,NiS和CuS在阳极失去电子得到S单质和Cu2+、Ni2+,Cu2+、Ni2+再在阴极得到电子得到含有少量Cu的粗镍,最后再在NiSO4溶液中,调节pH至2~5,电解精炼得到纯镍,据此分析解答。
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,高温条件下,杂质FeS与O2反应生成FeO和SO2,反应的化学方程式为2FeS+3O22FeO+2SO2,故答案为:
2FeS+3O22FeO+2SO2;
(2)为了提高浮选率,得到较高纯度NiS,可将高镍矿破碎、细磨,增大其接触面积,故答案为:
增大接触面积,提高浮选率;
(3)因为镍在焰色反应中,火焰呈无色,不会影响其他金属元素的焰色,所以在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂进行灼烧,故答案为:
镍在焰色反应中,火焰呈无色,不影响其他金属元素的焰色;
(4)根据上述分析可知,“除铁”过程中,向低镍矿中加入石英发生反应SiO2+2FeOFe2SiO4,故答案为:
SiO2+2FeOFe2SiO4;
(5)“电解”制粗镍过程中,主要是NiS在阳极失去电子得到S单质和Ni2+,发生的主要反应为NiS-2e-=Ni2++S,故答案为:
NiS-2e-=Ni2++S;
(6)已知物质的还原性:
Fe>Ni>H2>Cu,则氧化性:
Cu2+>
H+>
Ni2+,若当pH<
2时,溶液中c(H+)较大,H+易在阴极放电,不易得到Ni单质,pH>
5时,Ni2+易形成Ni(OH)2沉淀,“电解精炼”过程中,得到的阳极泥的主要成分为Cu单质,故答案为:
pH<
5时,Ni2+易形成Ni(OH)2沉淀;
铜。
3.(2020届四川省成都市第七中三诊模拟)钼酸钠晶体(Na2MoO4•2H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。
工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示。
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___;
在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为____________。
(3)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol•L-1,c(CO32-)=0.10mol•L-1。
由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。
在不损失MoO42-的情况下,CO32-的最大去除率是____________[已知Ksp(BaCO3)=1×
10-9、Ksp(BaMoO4)=4.0×
10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中Na2MoO4溶液通过结晶的方法可得到Na2MoO4晶体。
母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因_________。
(5)途径Ⅱ比途径Ⅰ的优点有________________(答出两条)。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。
常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠(M=206g•mol-1)的物质的量浓度为________(计算结果保留3位有效数字)。
(1)充分粉碎钼精矿,加压增大氧气浓度,升高温度等7:
2
(2)MoS2+9ClO-+6OH-==MoO42-+9Cl-+3H2O(3)90%(4)多次使用后母液中杂质的浓度增大,再次重结晶时会析出杂质影响产品纯度(5)过程简单、不会产生污染性气体(6)①浓硫酸具有强氧化性,常温下能使铁钝化②7.28×
l0-4mol•L-1
【解析】
(1)途径I为了提高钼精矿焙烧速率,粉碎钼精矿增大接触面积,增加氧气的浓度或升高温度;
途径I焙烧过程中,反应物为氧气、钼精矿,产物为二氧化硫和三氧化钼,反应方程式为:
2MoS2+7O22MoO3+4SO2,其中氧化剂为氧气,还原剂为MoS2,则氧化剂与还原剂物质的量之比为7:
2,答案为:
充分粉碎钼精矿,加压增大氧气浓度,升高温度等;
7:
2;
(2)途径Ⅱ氧化时MoS2与次氯酸钠、氢氧化钠溶液反应生成Na2MoO4和硫酸钠,利用化合价升降法结合原子守恒和电荷守恒配平,发生反应的离子方程式为MoS2+9ClO-+6OH-==MoO42-+9Cl-+3H2O,故答案为:
MoS2+9ClO-+6OH-==MoO42-+9Cl-+3H2O;
(3)BaMoO4开始沉淀时,溶液中钡离子的浓度为:
c(Ba2+)==1×
10-7mol/L,溶液