关于物质的量的计算Word文件下载.docx
《关于物质的量的计算Word文件下载.docx》由会员分享,可在线阅读,更多相关《关于物质的量的计算Word文件下载.docx(14页珍藏版)》请在冰豆网上搜索。
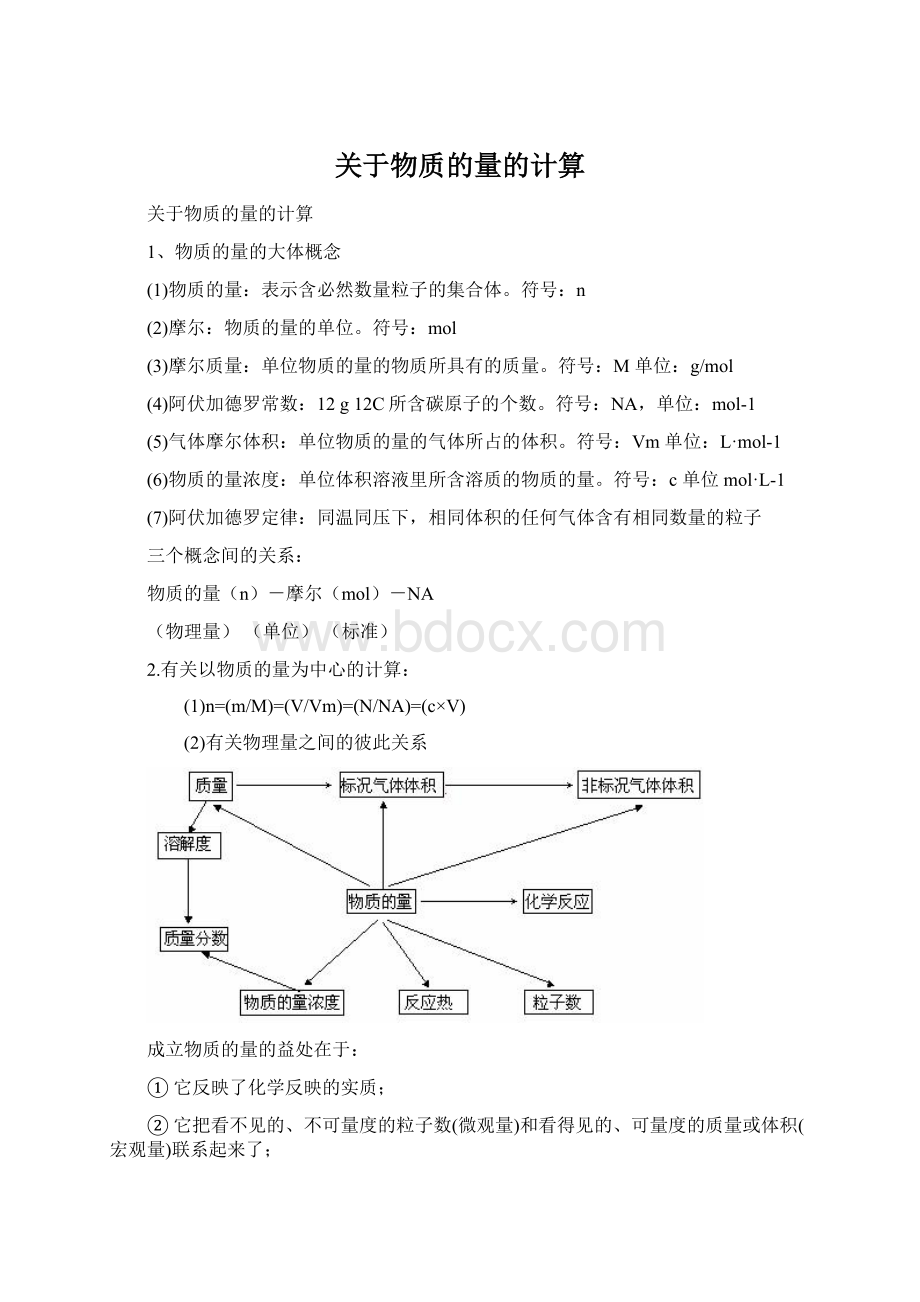
三个概念间的关系:
物质的量(n)-摩尔(mol)-NA
(物理量)(单位)(标准)
2.有关以物质的量为中心的计算:
(1)n=(m/M)=(V/Vm)=(N/NA)=(c×
V)
(2)有关物理量之间的彼此关系
成立物质的量的益处在于:
①它反映了化学反映的实质;
②它把看不见的、不可量度的粒子数(微观量)和看得见的、可量度的质量或体积(宏观量)联系起来了;
③它把气体的体积和分子数联系起来了;
④能够成立以物质的量为中心的,联系其它各类物理量的一个完整的化学计算体系;
⑤由于化学方程式中各物质的化学计量数之比既是粒子数比,又是物质的量之比,也是相同条件下气体的体积比。
这种比值较相应的质量比简单,因此,用物质的量的关系进行计算就比较简捷。
3.有关物质的量的八关系:
①1mol任何物质都含有阿伏加德罗常数个粒子,即近似为×
1023个粒子。
②1mol任何物质的质量,以克作单位,数值上等于该物质的相对分子质量(或相对原子质量、或相对离子质量等)
③关于由分子或直接由原子组成的物质,物质的量相同,所含分子数或原子数相同。
④关于相同质量的两种物质而言,摩尔质量与物质的量成反比。
即摩尔质量大的,物质的量则小。
M1n1=M2n2=
⑤关于相同物质的量的两种物质而言,摩尔质量与质量成正比。
即摩尔质量大的质量就大。
=
⑥1mol分子(或原子)的质量是1个分子(或原子)质量的×
1023倍。
⑦不同元素的相对原子质量之比等于其摩尔质量之比;
不同分子的相对分子质量之比等于其摩尔质量之比。
⑧化学反映方程式中,各物质的化学计量数之比既是粒子数之比,也是物质的量之比。
(化学反映定律)
提示:
高中化学计算主若是以物质的量为中心的计算,学习中要养成把其他物理量转化为物质的量这一思维模式
4.有关物理量及符号、单位
物理量
符号
单位
物质的量
mol
摩尔质量
M
g/mol
气体摩尔体积
Vm
L/mol
物质的量浓度
c
mol/L
质量分数
ω
1
粒子数
N
相对分子质量
(Mr)
相对原子质量
(Ar)
阿伏加德罗常数
NA
气体密度
ρ
g/L
固体、液体的密度
g/cm3
5、配制必然物质的量浓度的溶液时应注意以下几方面的问题:
(1)配制溶液时,需要依照所选择容量瓶的容量和溶液的物质的量浓度,称取必然质量的固体溶质或量取必然体积的液体溶质。
(2)不能配制任意体积的必然物质的量浓度的溶液。
这是因为在配制的进程中是用容量瓶来定容的,而容量瓶的规格是有限的,经常使用的有50mL、100mL、150mL、200mL、
250mL、500mL、1000mL等。
因此只能配制溶液体积与容量瓶容积相匹配的必然物质的量浓度的溶液。
(3)在配制必然物质的量浓度的溶液时,不能直接将溶质放入容量瓶中进行溶解,而要在 中溶解,待烧杯中溶液的温度恢复到室温时,才能将溶液转移到容量瓶中。
(4)定容后的容量瓶在反复倒置、振荡后,会显现容量瓶中的液面低于容量瓶刻度线的情形,这时再向容量瓶中加入蒸馏水。
这是因为容量瓶是属于“容纳量”式的玻璃仪器(注意与量筒对照)。
6、配制必然体积、必然物质的量浓度的溶液实验误差的要紧缘故:
①称量时引发的误差,使所配溶液中溶质的物质的量浓度偏高或偏低
②用于溶解稀释溶液的烧杯未用蒸馏水洗涤,使溶质的物质的量减少,致使溶液中溶质的物质的量浓度偏低
③转移或搅拌溶液时有部份液体溅出,致使溶液中溶质的物质的量浓度偏低
④在给容量瓶定容时,仰视读数会使溶液体积增大,致使溶液中溶质的物质的量浓度偏低;
俯视读数会使溶液体积减小,致使溶液中溶质的物质的量浓度偏大。
7、阿伏加德罗常数常考八大方面
(1)考物质的状态:
标准状况下,LCHCl3中含有的氯原子数量为3NA
错,标准状况下,CHCl3为液态
(2)考分子的组成:
10g氖(相对原子质量为2)气所含分子数为NA
错,氖为单原子分子
(3)考粒子的质量:
任何条件下,48gO3气体含有×
1023个O3分子
对,质量与条件无关
(4)考含同位素的摩尔质量:
18gD2O中含有的质子数量为10NA
错,D2O的摩尔质量是20g/mol,18gD2O的物质的量为mol,含质子数量为9NA
(5)考溶液的组成:
1Lmol/LNa2CO3溶液中含有的CO2-3数量为。
错,CO2-3会水解,比小
(6)考电子转移:
g铁粉与硝酸反映失去的电子数必然为×
×
1023
错,Fe过量时失去的电子数能够为×
(7)考化学键的数量:
gSiO2晶体中含有的硅氧键数量为×
对
(8)考反映原理:
常温常压下,gNO2气体含有×
1023个NO2分子。
错,NO2有一部份转化为N2O4
8.用浓溶液A(用质量分数表示)配制稀溶液B(用物质的量浓度表示)
求所需浓溶液的体积V(A)
C(B)×
V(B)×
M=ω(A)×
V(A)×
ρ(A)
(mol/L)(L)(g/mol)%(mL)(g/cm3)
物质的量浓度与溶质的质量分数之间的换算:
c×
V×
M=ω×
ρ
(mol/L)(L)(g/mol)%(mL)(g/cm3)
c=
令V=1L=1000mL,则得:
稀释规则:
稀释前后溶质的质量和物质的量不变。
m浓×
ω浓=m稀×
ω稀
V浓×
ρ浓×
ω浓=V稀×
ρ稀×
c浓×
V浓=c稀×
V稀
混合规则:
混合前后溶质的质量不变。
m1×
ω1%+m2×
ω2%=m3×
ω3%,式中,m1+m2=m3(质量有加和性)
c1V1+c2V2=c3V3,若告知混合后溶液的密度,则有体积效应,即V1+V2≠V3(体积没有加和性),混合后溶液的体积要依照混合溶液的密度来计算。
9.阿伏加德罗律的应用
阿伏加德罗定律:
同温同压下,同体积的气体具有同数的分子。
P:
气体压强(单位:
Pa)
V:
气体的体积(单位:
L)
n:
气体分子的物质的量(单位:
mol)
T:
温度(单位:
K)
R:
常数
在非标准状况下,不能用气体摩尔体积22.4L/mol进行计算,这时可利用阿氏定律及其有关关系来计算。
1.适用范围
气体摩尔体积的适用范围是气体,能够是单一气体,也能够是混合气体,如molH2与molO2的混合气体在标准状况下的体积约为L。
由这必然律可知:
①同温同压下,同体积的任何气体含有相同物质的量的分子;
②同温同压下任何混合气体的分子总数与相同状态下的各纯气体的分子数之和相同。
而且还可推出气体反映定律:
在有气体存在的化学方程式中,气体物质的化学计量数之比,既是分子数之比,物质的量之比,也是相同状态下气体体积比。
10.有关气体体积的八关系:
①标准状况下,1mol任何气体所占有的体积都约为L。
②同温同压下,同体积的气体具有同数量的分子(阿伏加德罗定律)。
③有关气体体积的计算中,质量、体积和物质的量的对应单位是“g—L—mol”。
④相同体积的两种气体,摩尔质量与质量成正比。
即摩尔质量大的,质量大,
⑤相同质量的两种气体,摩尔质量与物质的量成反比。
即摩尔质量大的,物质的量小,分子数少。
⑥比较两种气体的轻重,可看密度,最好看相对分子质量。
即相对分子质量大的,密度大。
⑦混合气体可看成一种纯气体对待(气体彼其间不发生反映)。
只是平均相对分子质量应按下式计算:
=M1×
n1%+M2×
n2%+……=M1×
V1%+M2×
V2%+……
⑧化学方程式中,气体物质的化学计量数之比,既是粒子数比,也是物质的量之比,仍是相同条件下气体的体积比。
(气体反映定律)
11.求混合气体(气体间不发生反映)的平均摩尔质量或平均相对分子质量
(1)物质的量概念法:
(2)密度法:
=×
22.4mol/L
(3)平均值法:
混合气体可看成一种气体,只是平均分子量应按下式计算:
练习:
判定下列说法是不是正确,并说明理由。
⑴物质的量确实是物质的数量
⑵摩尔是国际七个大体物理量之一
⑶1摩尔苹果
⑷只有在标况下,气体摩尔体积是mol
⑸1mol二氧化碳的质量和二氧化碳的摩尔质量都是44克
⑹阿伏伽德罗常数确实是×
⑺1摩尔的氯化钠溶于1升水中形成溶液,其物质的量浓度为1mol/L
⑻气体的体积大小的要紧决定因素是气体的微粒数量和微粒间距
(9)摩尔是物质的量的单位,每摩尔粒子含有阿伏加德罗常数个粒子。
( )
(10)物质的量是能把物质的质量和微观粒子数联系起来的一个物理量。
(11)95gMgCl2中含有×
1023个Mg2+和×
1023个Cl-。
(12)×
1023个Na+的质量等于23g。
2.下列关于摩尔质量的说法正确的是( )
A.水的摩尔质量是18g
B.2molH2O的摩尔质量是1molH2O的摩尔质量的2倍
C.任何物质的摩尔质量都等于它的相对分子质量或相对原子质量
D.水的摩尔质量是氢气摩尔质量的9倍
3.147gH2SO4的物质的量是________;
molH2SO4的质量是________g,其中含有________molH,含有________molO;
2molH2SO4中含有硫酸分子数为__________个,含氢原子数为________个。
4、下列说法中正确的是( )
A.摩尔既是物质的量的单位又是物质的质量单位
B.物质的量既表示物质的数量又表示物质的质量
C.阿伏加德罗常数是12kg12C中含有的碳原子数量
D.1molH2O中含有10mol电子
五、下列说法正确的是()
A.71g氯相当于2mol氯
B.每摩尔物质中含有×
1023个原子
C.阿伏加德罗常数为12g12C所含的碳原子数
molKClO3中含有3mol氧元素
六、若是1g水中含有m个氢原子,则阿伏加德罗常数是()
A.B.9mC.2m
7.相同质量的下列气体中,所含原子数最多的是
A.CH4
B.N2
C.CO
D.O2
8.相同质量的H2SO4与H3PO4中的氢原子数之比为
A.2:
3B.3:
2C.1:
2D.2:
9.0.5L1mol/LFeCl3溶液与0.2L1mol/LKCl溶液中的Cl-的数量之比
A.5:
2B.3:
1C.15:
2D.1:
3
10.amolO2气体和amolO3气体相较较,下列叙述必然正确的是
A.体积相同
B.质量相等