专题18盐类水解胶体的性质及其运用15页Word文件下载.docx
《专题18盐类水解胶体的性质及其运用15页Word文件下载.docx》由会员分享,可在线阅读,更多相关《专题18盐类水解胶体的性质及其运用15页Word文件下载.docx(16页珍藏版)》请在冰豆网上搜索。
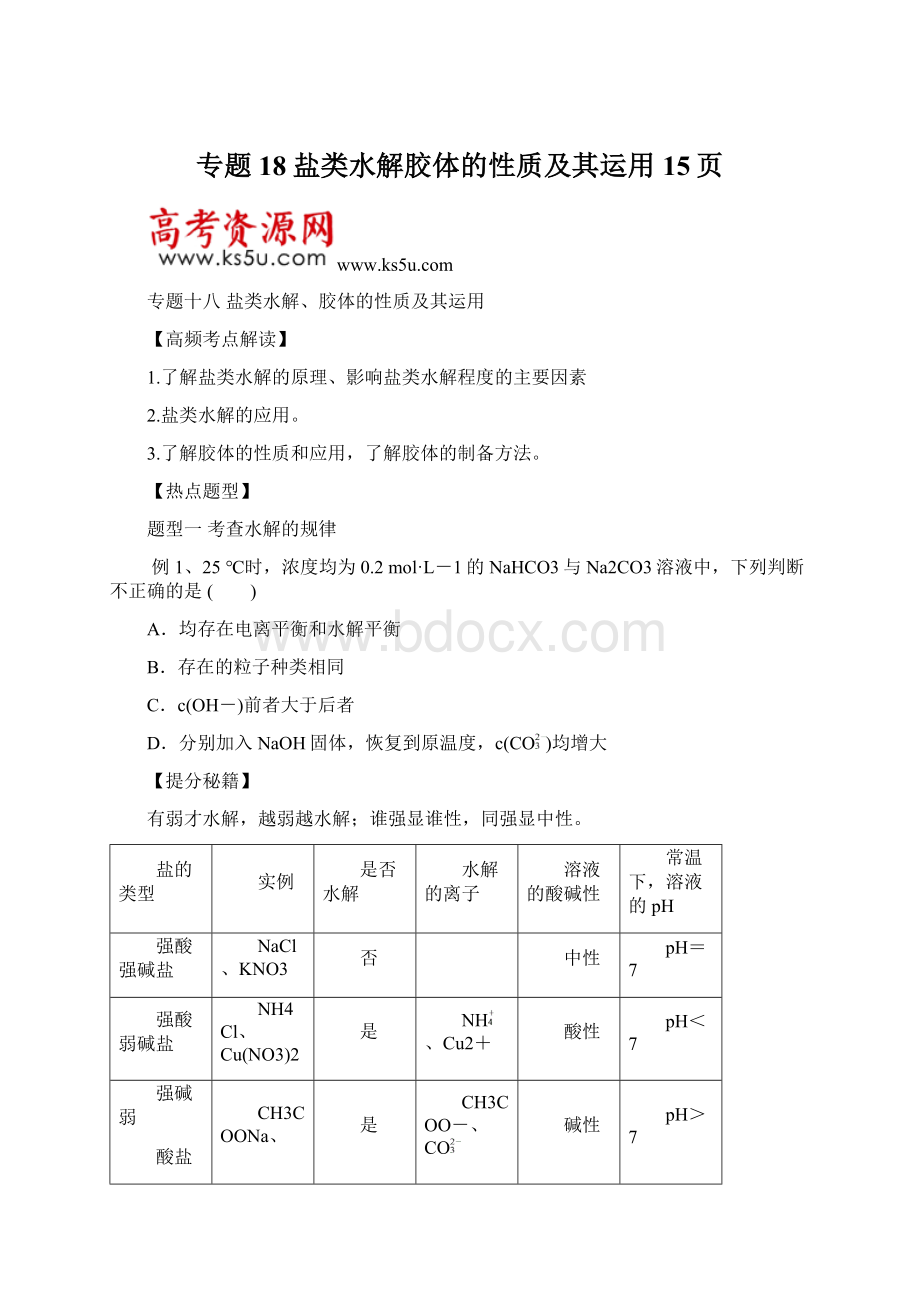
溶液的酸碱性
常温下,溶液的pH
强酸强碱盐
NaCl、KNO3
否
中性
pH=7
强酸弱碱盐
NH4Cl、Cu(NO3)2
是
NH、Cu2+
酸性
pH<7
强碱弱
酸盐
CH3COONa、
Na2CO3
CH3COO-、CO
碱性
pH>7
【举一反三】
有关①100mL0.1mol·
L-1NaHCO3、②100mL0.1mol·
L-1Na2CO3两种溶液的叙述不正确的是( )
A.溶液中由水电离出的H+个数:
②>
①
B.溶液中阴离子的物质的量浓度之和:
C.①溶液中:
c(CO)>
c(H2CO3)
D.②溶液中:
c(HCO)>
题型二溶液中粒子浓度大小的比较
例2、常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:
c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:
c(Na+)>c(HCO)>c(CO)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:
c(Cl-)=c(NH)>c(OH-)=c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
【提分秘籍】溶液中粒子浓度大小的比较
1.分析依据
(1)电离平衡
电离过程是微弱的,如H2CO3溶液中:
c(H2CO3)>c(HCO)>c(CO)(多元弱酸分步电离逐级减弱)
(2)水解平衡
水解过程是微弱的。
如Na2CO3溶液中:
c(CO)>c(HCO)>c(H2CO3)(多元弱酸根离子分步水解逐级减弱)
2.离子浓度的定量关系
(1)电荷守恒
溶液中所有阳离子所带的正电荷总浓度等于所有阴离子所带的负电荷总浓度。
如NaHCO3溶液中:
c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)
(2)物料守恒
在电解质溶液中,某些微粒可能发生变化,但变化前后某种元素的原子个数守恒。
如0.1mol·
L-1NaHCO3溶液中:
c(Na+)=c(HCO)+c(CO)+c(H2CO3)=0.1mol·
L-1
3.主要类型
(1)多元弱酸溶液
多元弱酸分步电离,逐级减弱,如H3PO4溶液中:
c(H+)>c(H2PO)>c(HPO)>c(PO)
(2)多元弱酸的正盐溶液
多元弱酸的弱酸根离子的分步水解,水解程度逐级减弱,如在Na2CO3溶液中:
c(Na+)>c(CO)>c(OH-)>c(HCO)
(3)不同溶液中同一离子浓度大小的比较
要看溶液中其他离子对该离子的影响。
如在相同物质的量浓度的下列溶液中:
①NH4Cl;
②CH3COONH4;
③NH4HSO4,c(NH)由大到小的顺序为:
③>①>②。
(4)混合溶液中各离子浓度的比较
要进行综合分析,如电离因素、水解因素等。
如在0.1mol·
L-1NH4Cl溶液和0.1mol·
L-1的氨水混合溶液中,各离子浓度大小的顺序为:
c(NH)>c(Cl-)>c(OH-)>c(H+)。
【特别提醒】
(1)关注离子所带电荷的多少
在列电荷守恒式时,不要简单地认为只是各离子浓度的相加,注意离子所带电荷的多少,如2c(CO)的系数“2”不可漏掉。
(2)等式考虑守恒原理,不等式考虑平衡原理
①在微粒浓度大小比较中,等式一般与电荷守恒、物料守恒相联系,如果给定的等式不是两个守恒式,可以把两个守恒式变化形式后相互作差,加以推导即可。
②如果给定的是不等式,要先考虑等式,对等式的一边加入或减少某离子,即可变成不等式。
【技巧点拨】 粒子浓度关系的判断技巧
(1)对于混合溶液中微粒浓度的比较,要先考虑是否反应,再判断反应后酸或碱是否过量,若过量,则须同时考虑电离与水解两个方面。
(2)一般而言,等浓度的弱酸与弱酸盐混合,电离程度大于水解程度,溶液呈酸性;
HCN、NaCN混合液除外,它们的混合溶液呈碱性,水解程度大于电离程度。
(3)对于存在电离和水解过程的NaHA溶液,若溶液呈酸性,则电离过程大于水解过程,则c(A2-)>c(H2A);
若溶液呈碱性,则电离过程小于水解过程,则c(H2A)>c(A2-)。
对于0.1mol·
L-1Na2SO3溶液,正确的是( )
A.升高温度,溶液pH降低
B.c(Na+)=2c(SO)+c(HSO)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO)+2c(HSO)+c(OH-)
D.加入少量NaOH固体,c(SO)与c(Na+)均增大
题型三盐类水解的应用
例3、已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性;
将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为:
6.4、6.4、3.7。
现有含有FeCl2杂质的氯化铜晶体(CuCl2·
2H2O),为制取纯净的CuCl2·
2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
含杂质的水溶液Ⅰ溶液Ⅱ
1.判断溶液的酸碱性:
Na2CO3溶液呈碱性的原因是:
CO+H2OHCO+OH-
2.配制或贮存易水解的盐溶液:
如配制FeCl3溶液时,先将它溶解在较浓的盐酸中,再加水至指定浓度;
配制CuSO4溶液时,加入少量的H2SO4,以抑制Cu2+水解。
3.判断盐溶液蒸干灼烧时所得的产物:
如AlCl3、FeCl3溶液蒸干后得到Al(OH)3、Fe(OH)3,灼烧得到Al2O3、Fe2O3,CuSO4溶液蒸干后得CuSO4固体,NaHCO3溶液低温蒸干后可得NaHCO3固体。
4.离子共存:
Al3+、Fe3+与HCO、CO、Al3+与AlO,Al3+与S2-因相互促进水解而不共存。
5.解释生活中的现象或事实:
如明矾净水、热纯碱液除油污,草木灰不能与铵盐混用、泡沫灭火器原理。
6.离子浓度大小的比较:
如碳酸氢钠溶液中离子浓度大小顺序为:
c(Na+)>c(HCO);
c(OH-)>c(H+)
7.物质的提纯(水解除杂):
如MgCl2溶液中混有少量Fe3+杂质时,因Fe3+水解的程度比Mg2+的水解程度大,可加入MgO或Mg(OH)2等,导致水解平衡右移,生成Fe(OH)3沉淀而除去。
【特别提醒】
(1)因Fe3+在酸性较强的环境中比Al3+、Mg2+、Cu2+更易发生水解,故一般可采用调节pH的方法生成Fe(OH)3沉淀除去,如加入CuO、Cu(OH)2等皆可,但不能加会引入杂质离子的物质。
(2)相互促进水解的离子在同一溶液中是否可以大量共存,要看水解产物能否脱离反应体系。
如Fe3+与HCO互相促进水解生成沉淀和气体,水解趋于完全,二者不能大量共存。
CH3COO-和NH水解相互促进生成的是弱酸和弱碱,仍然存在平衡状态,二者可以大量共存。
下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③B.②③④
C.①④⑤D.①②③④⑤
题型四胶体的性质
例4、下列关于胶体的认识错误的是( )
A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化
B.纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体
C.往Fe(OH)3胶体中逐滴加入稀硫酸会先产生沉淀而后沉淀逐渐溶解
D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
1.胶体稳定的主要原因
胶体粒子直径较小,具有较大的比表面积,同种胶体的胶粒因吸附分散剂中相同的离子而使胶体粒子带有同种电荷,彼此相互排斥,阻碍了胶粒的凝聚。
2.胶体粒子的带电规律
一般地,①金属氢氧化物、金属氧化物的胶体粒子带正电荷,如Fe(OH)3胶体、Al(OH)3胶体。
②非金属氧化物、金属硫化物的胶体粒子带负电荷,如硅酸胶体、土壤胶体等。
某种胶体在电泳时,它的粒子向阴极移动。
在这种胶体中分别加入下列物质:
①蔗糖溶液 ②硫酸镁溶液 ③硅酸胶体 ④氢氧化铁胶体,不会发生凝聚的是( )
A.①③B.①④
C.②③D.③④
题型五胶体的应用
例5、下列说法正确的是( )
①豆浆和雾都是胶体 ②可用丁达尔现象区分溶液和胶体
③医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关 ④胶体微粒很小,可以透过半透膜 ⑤氢氧化铁胶体稳定存在的主要原因是胶粒带电荷
A.①②③B.①②④C.②⑤D.①②⑤
利用胶体的性质,胶体在人们的生产、生活中以及在科学实验方面都有着广泛的应用。
(1)用于净水。
明矾净水利用了Al(OH)3胶体粒子的吸附作用。
(2)医疗上利用渗析原理可对肾衰竭病人进行透析,利用聚沉原理可用于手术治疗。
(3)工业上,利用电泳和聚沉原理可进行高压除尘。
(4)食品生产中可利用聚沉原理,如用豆浆做成豆腐。
(5)也常用胶体原理解释一些自然现象,如江河入海口容易形成沙州。
不能用有关胶体的观点解释的现象是()
A.在江河入海处易形成三角洲
B.在豆浆里加入盐卤做豆腐
C.在CaCl2溶液中滴入NaHCO3溶液看不到沉淀
D.同一钢笔同时使用不同牌号的墨水易发生堵塞
【高考风向标】
1.(2014·
浙江卷)下列说法正确的是( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。
假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
2.(2014·
山东卷)已知某温度下CH3COOH和NH3·
H2O的电离常数相等,现向10mL浓度为
0.1mol·
L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH)=c(CH3COO-)
3.(2014·
新课标全国卷Ⅱ)一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×
10-5mol·
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b