高中知识思维导图展望高中化学知识Word文档下载推荐.doc
《高中知识思维导图展望高中化学知识Word文档下载推荐.doc》由会员分享,可在线阅读,更多相关《高中知识思维导图展望高中化学知识Word文档下载推荐.doc(12页珍藏版)》请在冰豆网上搜索。
强酸
弱酸
强碱
弱碱
正盐
酸式盐
碱式盐
复盐
金属氧化物
非金属氧化物
两性氧化物
过氧化物
复杂氧化物
氧化性酸
非氧化性酸
可溶性强碱
微可溶性强碱
可溶性弱碱
不可溶性弱碱
2、有机化合物的分类
烃
烃的衍生物
合成高分子
蛋白质
糖
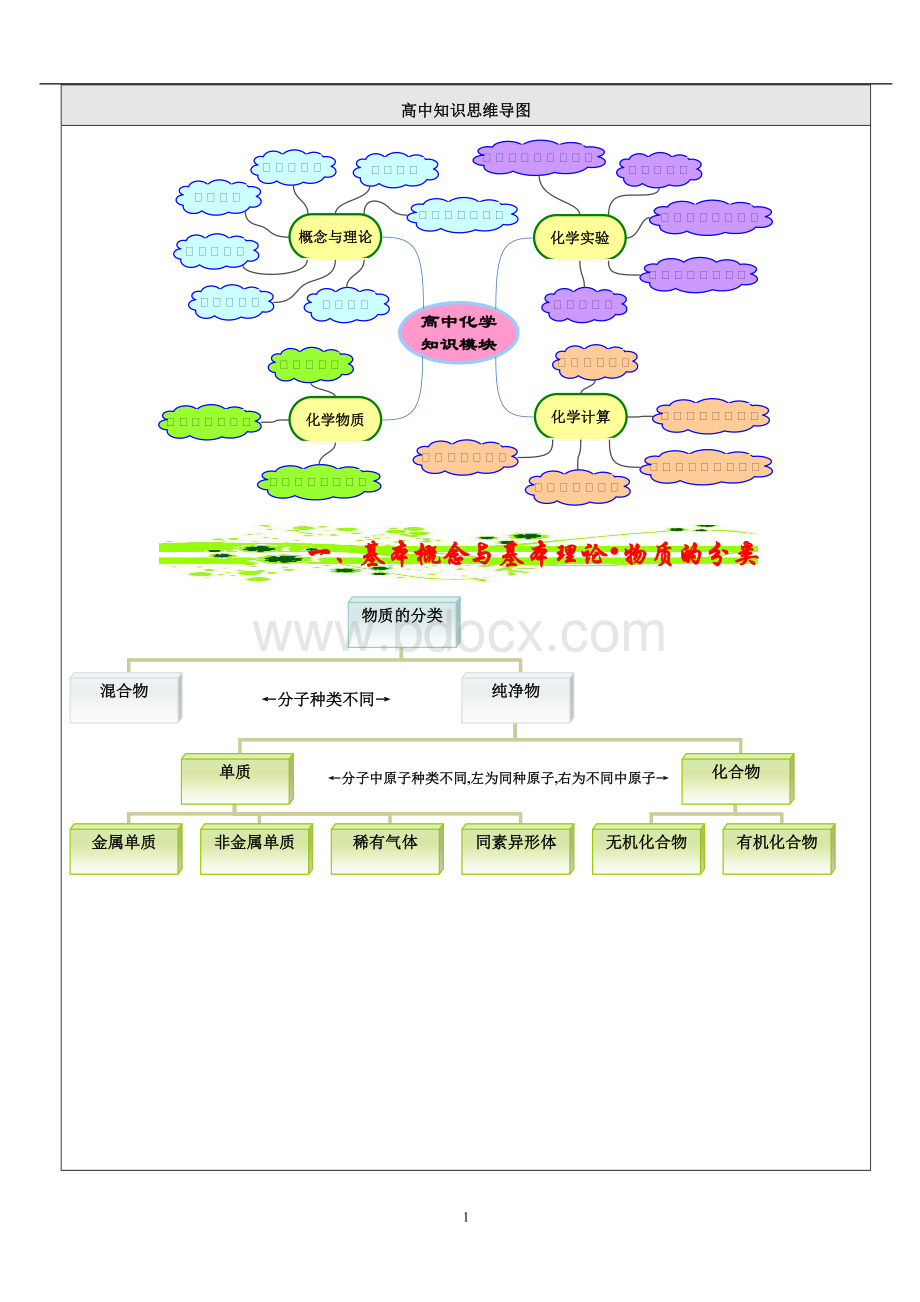
一、基本概念与基本理论•化学变化
1、化学变化类型
化学变化
类型
无机反应
有机反应
化学变化的基本类型(形式)
按有无电子转移划分(本质)
其他
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
从参加反应的微粒划分
从是否可逆划分
从热效应划分
分子反应
原子反应
可逆反应
不可逆反应
放热反应
吸热反应
2、化学变化的表示方法
化学变化的表示方法
化学方程式
电离方程式
离子方程式
电极方程式
热化学方程式
书写原则
书写注意事项
配平方法
书写步骤
离子反应发生条件
书写要求
阳极或负极(发生氧化反应)
阴极或正极(发生还原反应)
以化学反应的事实为依据
遵守质量守恒定律
观察法
最小公倍法、奇数偶数法
氧化还原配平法
生成难容物质
生成挥发性物质
生成弱电解质
各物质都注明状态
以“mol”为单位计算热值(kJ)
根据放热或吸热用“+”或“-”表示
一、基本概念与基本理论•物质结构
一、基本概念与基本理论•元素周期律
核外电子排布
的周期性
元素性质的布周期性
元素周期律
元素周期表
横:
周期
n=1
n=2
n=3
n=4
n=5
n=6
n=7
元素种类:
2
8
18
32
26
短周期
长周期
不完全周期
主族:
ⅠA~ⅦA
副族:
ⅢB~ⅦB、ⅠB~ⅡB
Ⅷ族
0族
纵:
族
决定
归纳
编制
表的结构
元素性质
原子结构
实质
周期表位置
一、基本概念与基本理论•化学平衡
一、基本概念与基本理论•电解质溶液
电解质
强电解质(完全电离)AB→A++B-
弱电解质(部分电离)
离子反应
化学能与电能的转换:
化学能电能
水的电离平衡H2OH++OH-
电离度定义
电离平衡的移动
水的离子积
Kw=1×
10-14(25℃)
溶液的酸碱性—pH=(-lg[H+])
盐类的水解
规律(显性判断)
影响因素
发生条件
表示方式
常见类型
非氧化还原
氧化反应
水解反应
络合反应
溶液中氧化还原反应
电离平衡
ABA++B-
一、基本概念与基本理论•原电池
原电池
原理
应用
电源
蓄电池
干电池
高能电池
一、基本概念与基本理论•电解池
电解池
氯碱工业(电解饱和食盐水)
电镀
电解精炼(精炼铜)
电冶金(电解法炼铝)
二、化学物质•非金属及其化合物
1、卤族元素
2、硫及其化合物
3、氮及其化合物
二、化学物质•金属及其化合物
1、铝及其化合物
2、铁及其化合物
3、钠及其化合物
4、镁及其化合物
二、化学物质•有机化合物
链烃
环烃
卤代烃
醇
酚
醛
羧酸
酯
其他:
醚、酮、硝基化合物、胺
单糖:
葡萄糖、果糖
二糖:
蔗糖、麦芽糖
多糖:
淀粉、纤维素
蛋白质、氨基酸
高分子化合物
天然高分子:
橡胶、多糖、蛋白质
合成高分子:
合成塑料、
合成纤维、
合成橡胶
饱和烃:
烷烃
不饱和烃
烯烃
炔烃
二烯烃
三、化学计算
气体体积
(L)
物质的量浓度
(mol/L)
物质质量
(g)
物质的量
(mol)
微粒个数
(个)
化学式计算
化学方程式计算
多步反应的计算
混合物的计算
以物质的量为核心的计算
÷
摩尔质量(g/mol)
×
6.02×
1023/mol(NA)
[6.02×
1023/mol(NA)]
溶液体积(L)
气体摩尔体积(22.4L/mol,标况)
四、化学实验
化学实验
常见仪器的主要用途及使用方法
常见试剂的保存与
取用
化学实验的
设计与评价
综合实验
物质的分离与提纯
物质的检验
常见气体的制备、净化干燥、收集
重要物质的制备实验
重要物质的性质实验
基本操作
12