高考化学一轮复习《物质的量浓度一定物质的量浓度溶液的配制》学案Word文件下载.docx
《高考化学一轮复习《物质的量浓度一定物质的量浓度溶液的配制》学案Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考化学一轮复习《物质的量浓度一定物质的量浓度溶液的配制》学案Word文件下载.docx(18页珍藏版)》请在冰豆网上搜索。
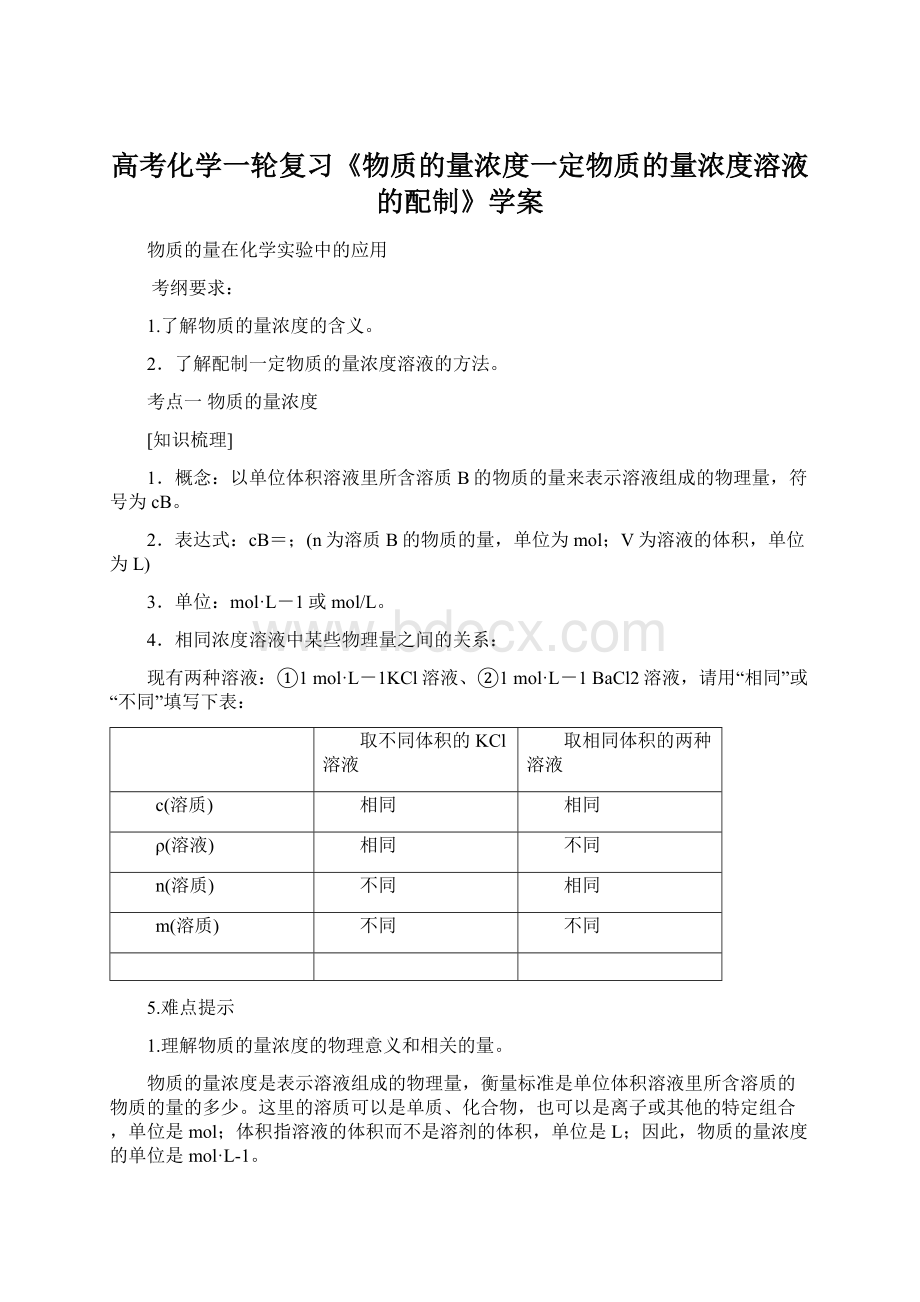
c(溶质)
相同
ρ(溶液)
不同
n(溶质)
m(溶质)
5.难点提示
1.理解物质的量浓度的物理意义和相关的量。
物质的量浓度是表示溶液组成的物理量,衡量标准是单位体积溶液里所含溶质的物质的量的多少。
这里的溶质可以是单质、化合物,也可以是离子或其他的特定组合,单位是mol;
体积指溶液的体积而不是溶剂的体积,单位是L;
因此,物质的量浓度的单位是mol·
L-1。
2.明确溶液中溶质的化学成分。
求物质的量浓度时,对一些特殊情况下溶液的溶质要掌握清楚,如NH3溶于水得NH3·
H2O,但我们习惯上认为氨水的溶质为NH3;
SO3溶于水后所得溶液的溶质为H2SO4;
Na、Na2O、Na2O2溶于水后所得溶液的溶质为NaOH;
CuSO4·
5H2O溶于水后所得溶液溶质为CuSO4
3.熟悉表示溶液组成的其他物理量。
表示溶液组成的物理量除物质的量浓度外,还有溶质的质量分数、质量物质的量浓度等。
它们之间有区别也有一定的联系,如物质的量浓度(c)与溶质的质量分数(ω)的关系为c=ρg·
mL-1×
1000mL·
L-1×
ω/Mg·
mol-1。
[知识精讲]
命题点1 对物质的量浓度概念的理解及简单计算
物质的量浓度有两个因素决定,即溶质物质的量和溶液的体积。
理解物质的量浓度要从上述两个方面进行,再者,也要注意溶质浓度与具体所含微粒浓度的关系。
(1)描述物质的量浓度中的体积是指溶液的体积,而不是指溶剂的体积。
(2)溶液体积的单位是L,根据密度计算溶液体积的单位一般是mL,要注意单位的换算。
(3)溶质的浓度和离子的浓度不同,要注意根据化学式具体分析计算,如1mol·
L-1的Al2(SO4)3溶液中Al3+的物质的量浓度不是1mol·
L-1,而是2mol·
L-1。
[典题示例]
判断正误(正确的打“√”,错误的打“×
”)。
(1)含1mol溶质的任何溶液,物质的量浓度一定相等。
( )
(2)配制1mol·
L-1NaCl溶液1L,其方法是:
将58.5gNaCl溶于1L水中。
(3)体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同。
(4)1L0.5mol·
L-1CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5mol·
(5)从1L0.2mol·
L-1的NaOH溶液中取出10mL,这10mL溶液的物质的量浓度是2mol·
提示:
(1)×
(2)×
(3)√ (4)×
(5)×
命题点2 考查物质的量、溶质的质量分数、物质的量浓度之间的换算
突破物质的量浓度计算要注意的两个关键点
(1)牢记定义式,灵活利用守恒推导。
由定义式出发,运用守恒(溶质守恒、溶剂守恒等)及公式:
c=、溶质的质量分数=×
100%进行推理,注意密度的桥梁作用,不要死记公式。
(2)灵活运用假设,注意单位换算。
例如:
已知溶质的质量分数w,溶液的密度为ρg·
cm-3,溶质的摩尔质量为Mg·
mol-1,求物质的量浓度c。
假设溶液为1L,所以溶液质量为1000ρg,溶质的质量为1000ρwg,溶质的物质的量为mol,这样可求出该溶液的物质的量浓度c=mol·
1.已知某饱和NaCl溶液的体积为VmL,密度为ρg/cm3,溶质的质量分数为w,物质的量浓度为cmol/L,溶液中含NaCl的质量为mg。
(1)用m、V表示溶液的物质的量浓度________。
(2)用w、ρ表示溶液的物质的量浓度________。
(3)用c、ρ表示溶质的质量分数________。
(4)用w表示该温度下NaCl的溶解度________。
解析:
(1)c==mol/L。
(2)c==mol/L。
(3)w=×
100%=×
100%。
(4)=,S=g。
答案:
(1)mol/L
(2)mol/L
(3)×
100% (4)g
2.(2010四川理综卷,12)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为pg/ml,质量分数为ω,物质浓度为cmol/L,则下列关系中不正确的是
A.B.
C.D.C=1000Vρ/(17V+22400)
A
本题考查基本概念。
考生只要对基本概念熟悉,严格按照基本概念来做,弄清质量分数与物质的量浓度及密度等之间的转化关系即可。
选C 根据c=进行计算,n=mol,V=,可知C正确。
命题点3 关于溶液稀释或混合的计算
解答溶液稀释或混合的计算问题,要活用“守恒思想”。
1.溶液稀释规律
(1)溶质的质量在稀释前后保持不变,即m1w1=m2w2。
(2)溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。
(3)溶液质量守恒,m(稀)=m(浓)+m(水)(体积一般不守恒)。
2.同溶质不同物质的量浓度溶液的混合计算
(1)混合后溶液体积保持不变时,c1V1+c2V2=c混×
(V1+V2)。
(2)混合后溶液体积发生改变时,c1V1+c2V2=c混V混,其中V混=。
3.溶质相同、质量分数不同的两溶液混合规律
同一溶质、质量分数分别为a%、b%的两溶液混合。
(1)等体积混合:
①当溶液密度大于1g·
cm-3时,结果是溶液浓度越大,密度越大,如H2SO4、HNO3、HCl、NaOH等溶液等体积混合后溶质质量分数w>
(a%+b%)。
②当溶液密度小于1g·
cm-3时,结果是溶液浓度越大,密度越小,如酒精、氨水等溶液等体积混合后,质量分数w<
(2)等质量混合:
两溶液等质量混合时(无论ρ>
1g·
cm-3还是ρ<
cm-3),则混合后溶液中溶质的质量分数w=(a%+b%)。
1.VLFe2(SO4)3溶液中含有agSO,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为( )
A.mol/LB.mol/L
C.mol/LD.mol/L
选A 依题意知,c(SO)=mol/L,c(Fe3+)==mol/L,故有×
0.5V=2V×
cB,cB=mol/L。
2.
(1)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是________(填序号,下同)。
①q=2p ②q>
2p ③q<
2p ④无法确定
(2)若上题中的溶质是乙醇而非硫酸,则p、q的关系是________。
当等体积混合时,设浓溶液的密度为ρ1,稀溶液的密度为ρ2,体积各为1L,则混合后
w==()×
p%
=(1+)p%
则当ρ1>
ρ2时,如H2SO4溶液、HNO3溶液,w>
2p%;
当ρ1<
ρ2时,如氨水、酒精溶液,w<
2p%。
(1)②
(2)③
[当堂达标]
1.(2015·
潍坊质检)有硫酸镁溶液500mL,它的密度是1.20g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( )
A.溶质的质量分数是24.0%
B.溶液的物质的量浓度是2.4mol/L
C.溶质和溶剂的物质的量之比是1∶40
D.硫酸根离子的质量分数是19.2%
选C 由Mg2+的质量分数知MgSO4的质量分数为×
4.8%=24.0%,其浓度为c==2.4mol/L,溶质与溶剂的物质的量之比为∶≈1∶21,SO的质量分数为×
4.8%=19.2%。
2.(2015·
天津联考)在t℃时,将agNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/mL,质量分数为w,其中含有NH的物质的量是bmol,下列叙述正确的是( )
A.溶质的质量分数w=×
100%
B.溶质的物质的量浓度c=mol/L
C.溶液中c(OH-)=mol/L+c(H+)
D.向上述溶液中加入VmL水,所得溶液的质量分数大于0.5w
选C 溶质的质量分数w=×
100%,A错误;
在计算时氨水中的溶质是NH3,而不是NH3·
H2O,将w=×
100%代入公式c=,化简可得c=mol/L,B错误;
氨水中含有的阳离子为H+和NH,含有的阴离子只有OH-,根据电荷守恒可知C正确;
由于氨水的密度小于水的密度,与水等体积混合所得稀氨水的质量大于原氨水质量的2倍,故其质量分数小于0.5w,D错误。
考点二一定物质的量浓度溶液的配制
1.主要仪器
托盘天平、药匙、量筒、玻璃棒、烧杯、容量瓶、胶头滴管。
2.容量瓶的构造及使用
(1)容量瓶上标有温度、规格和刻度线。
常用规格有50mL、100mL、250mL、1000mL等。
(2)容量瓶在使用前要检查是否漏水,其操作顺序为装水盖塞→倒立→正立→玻璃塞旋转180°
→倒立。
3.配制过程
以配制100mL1.00mol/LNaCl溶液为例。
(1)计算:
需NaCl固体的质量为5.9g。
如溶质为固体时,计算所需固体的质量;
如溶液是液体时,则计算所需液体的体积。
(2)称量:
用托盘天平称量NaCl固体。
用天平称出所需固体的质量或用量筒量出所需液体的体积。
(3)溶解:
将称量好的NaCl固体放入烧杯中,用适量蒸馏水溶解。
(4)移液:
待烧杯中的溶液冷却至室温后,用玻璃棒引流将溶液注入100mL容量瓶。
(5)洗涤:
用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液全部注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀。
(6)定容:
将蒸馏水注入容量瓶,当液面距瓶颈刻度线1~2_cm时,改用胶头滴管,滴加蒸馏水至凹液面与刻度线相切。
(7)摇匀:
盖好瓶塞,反复上下颠倒,摇匀。
配制流程图如下图所示:
命题点1 溶液配制过程中重要仪器的使用
仪器
注意事项或作用
容量瓶
(1)不能将固体或浓溶液直接在容量瓶中溶解或稀释;
(2)不能作为反应器或用来长期贮存溶液;
(3)不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的;
(4)不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
量筒
(1)不作反应器;
(2)不能将浓溶液直接在量筒中稀释;
(3)量取的液体倒出后不必洗涤。
托盘天平
(1)使用前调零;
(2)药品不能直接放在托盘上;
(3)左物右码,先大后小;
(4)读数至小数点后1位。
玻璃棒
(1)在溶液配制中的作用是搅拌、引流。
(2)搅拌勿碰烧杯内壁,引流注意玻璃棒下端应在刻度线以下。
1.判断正误(正确的打“√”,错误的打“×
(1)容量瓶在使用前应检查是否漏液。
(2)实验室需要950mL0.1mol/L的NaCl溶液,配制时应选用1000mL容量瓶。
(3)若移液前容量瓶内有少量水,能使所配溶液浓度偏低。
(4)配