化学键知识点与练习题(含答案)Word文档下载推荐.doc
《化学键知识点与练习题(含答案)Word文档下载推荐.doc》由会员分享,可在线阅读,更多相关《化学键知识点与练习题(含答案)Word文档下载推荐.doc(6页珍藏版)》请在冰豆网上搜索。
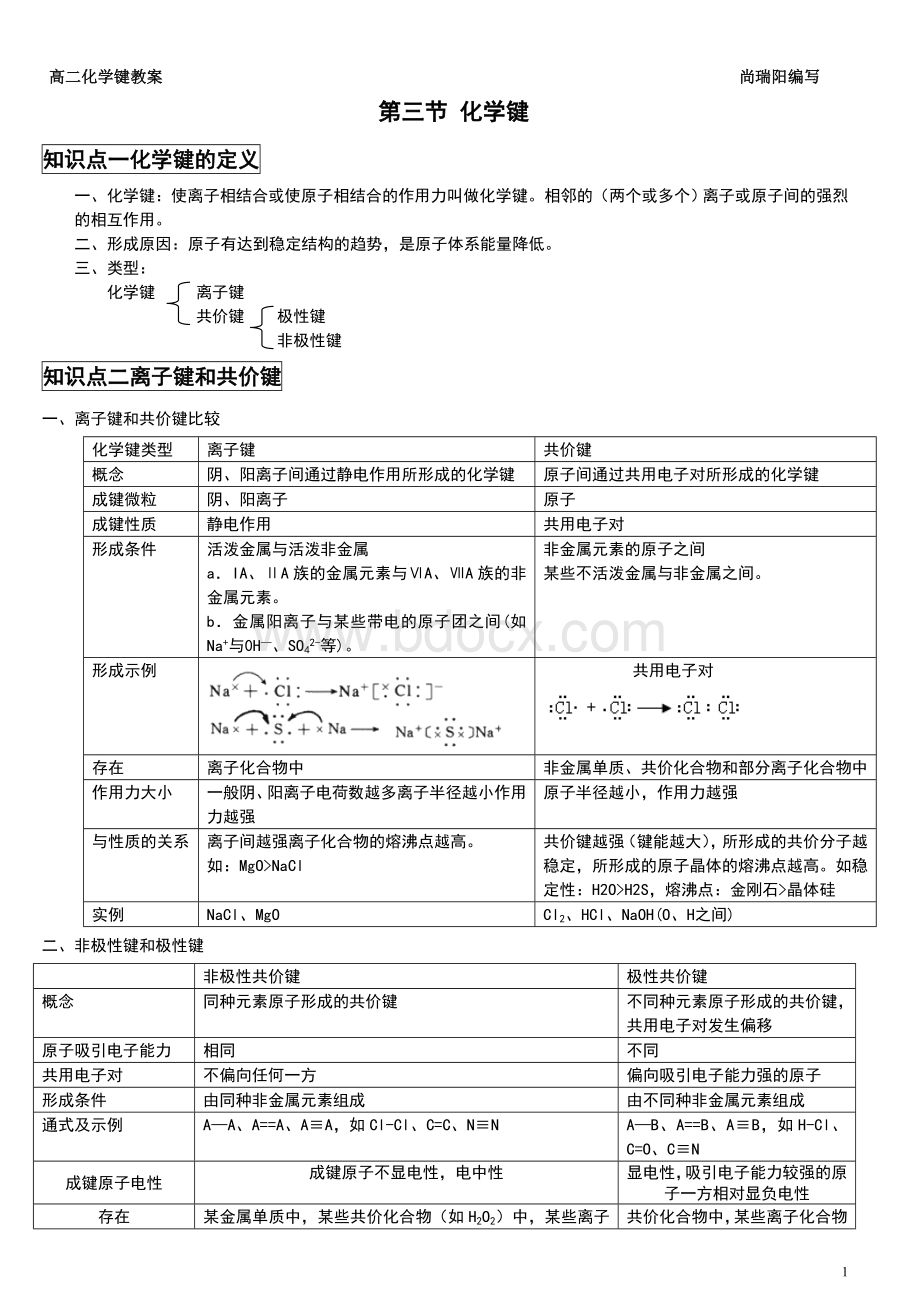
原子间通过共用电子对所形成的化学键
成键微粒
阴、阳离子
原子
成键性质
静电作用
共用电子对
形成条件
活泼金属与活泼非金属
a.IA、ⅡA族的金属元素与ⅥA、ⅦA族的非金属元素。
b.金属阳离子与某些带电的原子团之间(如Na+与0H—、SO42-等)。
非金属元素的原子之间
某些不活泼金属与非金属之间。
形成示例
共用电子对
存在
离子化合物中
非金属单质、共价化合物和部分离子化合物中
作用力大小
一般阴、阳离子电荷数越多离子半径越小作用力越强
原子半径越小,作用力越强
与性质的关系
离子间越强离子化合物的熔沸点越高。
如:
MgO>
NaCl
共价键越强(键能越大),所形成的共价分子越稳定,所形成的原子晶体的熔沸点越高。
如稳定性:
H2O>
H2S,熔沸点:
金刚石>
晶体硅
实例
NaCl、MgO
Cl2、HCl、NaOH(O、H之间)
二、非极性键和极性键
非极性共价键
极性共价键
同种元素原子形成的共价键
不同种元素原子形成的共价键,共用电子对发生偏移
原子吸引电子能力
相同
不同
不偏向任何一方
偏向吸引电子能力强的原子
由同种非金属元素组成
由不同种非金属元素组成
通式及示例
A—A、A==A、A≡A,如Cl-Cl、C=C、N≡N
A—B、A==B、A≡B,如H-Cl、C=O、C≡N
成键原子电性
成键原子不显电性,电中性
显电性,吸引电子能力较强的原子一方相对显负电性
某金属单质中,某些共价化合物(如H2O2)中,某些离子化合物(如Na2O2)中
共价化合物中,某些离子化合物(如NH4Cl、NaOH)中
相互关系
知识点三离子化合物和共价化合物
项目
离子化合物
共价化合物
阴、阳离子间通过离子键结合形成的化合物
不同元素的原子间通过共价键结合形成的化合物
化合物中的粒子
金属阳离子或NH4+、非金属阳离子或酸根阴离子没有分子
分子或原子、没有离子
所含化学键
离子键,还可能有共价键
只含有共价键
物质类型
活泼金属氧化物(过氧化物、超氧化物)、强碱、大多数盐
非金属氧化物、非金属氢化物、含氧酸、弱碱、少数盐大多数有机物
MgO、Na2O2、KO2、Ba(OH)2、MgSO4、Kal(SO4)2.12H2O
CO2、SiO2、NH3、H2SO4、Al(OH)3、HgCl2、C12H22O11
性质
状态
通常以晶体形态存在
气态、液体或固态
导电性
熔融状态能导电、易溶物质在水溶液里能导电
熔融状态不导电,易溶物质在水溶液里可能导电或不导电
类别
强电解质
强电解质、弱电解质或非电解质
熔融时克服的作用
分子间作用力或共价键
熔沸点
较高
较低(如CO2)或很高(如SiO2)
(1)当一个化合物中只存在离子键时,该化合物是离子化合物
(2)当一个化合中同时存在离子键和共价键时,以离子键为主,该化合物也称为离子化合物(3)只有当化合物中只存在共价键时,该化合物才称为共价化合物。
(4)在离子化合物中一般既含有金属元素又含有非金属元素;
共价化合物一般只含有非金属元素(NH4+例外)
注意:
(1)离子化合物中不一定含金属元素,如NH4NO3,是离子化合物,但全部由非金属元素组成。
(2)含金属元素的化合物不一定是离子化合物,如A1C13、BeCl2等是共价化合物。
二、化学键与物质类别的关系
化学键的种类
非金属单质
无化学键
稀有气体分子(单原子分子)He、Ne
O=O、Cl—Cl、H—H
只有极性键
H2O、CO2
既有极性键又有非极性键
H2O2
离
子
化
合
物
只有离子键
、
离子键、极性共价键
离子键、非极性共价键
知识点四电子式和结构式的书写方法
一、电子式:
1.各种粒子的电子式的书写:
(1)原子的电子式:
常把其最外层电子数用小黑点“·
”或小叉“×
”来表示。
例如:
(2)简单离子的电子式:
①简单阳离子:
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等。
②简单阴离子:
书写简单阴离子的电子式时不但要画出最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n—”电荷字样。
例如:
氧离子、氟离子。
③原子团的电子式:
书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n—”或“n+”电荷字样。
例如:
铵根离子、氢氧根离子。
(3)部分化合物的电子式:
①离子化合物的电子式表示方法:
在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。
所以,离子化合物的电子式是由阳离子和带中括号的阴离子组成,且简单的阳离子不带最外层电子,而阴离子要标明最外层电子多少。
如:
。
②共价化合物的电子式表示方法:
在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号。
2.用电子式表示化学反应的实质:
(1)用电子式表示离子化合物的形成过程:
(2)用电子式表示共价化合物的形成过程:
说明:
用电子式表示化合物的形成过程时要注意:
(1)反应物要用原子的电子式表示,而不是用分子或分子的电子式表示。
用弯箭头表示电子的转移情况,而共价化合物不能标。
(2)这种表示化学键形成过程的式子,类似于化学方程式,因此,它要符合质量守恒定律。
但是,用于连接反应物和生成物的符号,一般用“→”而不用“=”。
(3)不是所有的离子化合物在形成过程中都有电子的得失,如NH4+与Cl-结合成NH4Cl的过程。
二、结构式:
将分子中的共用电子对用短线表示,而反映分子中原子的排列顺序和结合方式的式子叫做物质的结构式。
单双三键分别用—、=、≡表示。
知识点五化学键与物质变化的关系
1.与化学变化的关系
化学反应实质是旧化学键的断裂和新化学键的形成。
任何反应都必然发生化学键的断裂和形成。
2.与物理变化的关系
发生物理变化的标志是没有生成新物质可能伴随着化学键的断裂,但不会有新化学键的形成。
物理变化的发生也可能没有化学键的断裂,只是破坏了分子之间的氢键或范德华力如冰的融化和干冰的气化。
化学键
分子间作用力
相邻的原子间强烈的相互作用
物质分子间存在的微弱的相互作用
能量
较大
很弱
性质影响
主要影响物质的化学性质
主要影响物质的物理性质
课堂练习题
答案:
6