新版GMP解读文档格式.docx
《新版GMP解读文档格式.docx》由会员分享,可在线阅读,更多相关《新版GMP解读文档格式.docx(27页珍藏版)》请在冰豆网上搜索。
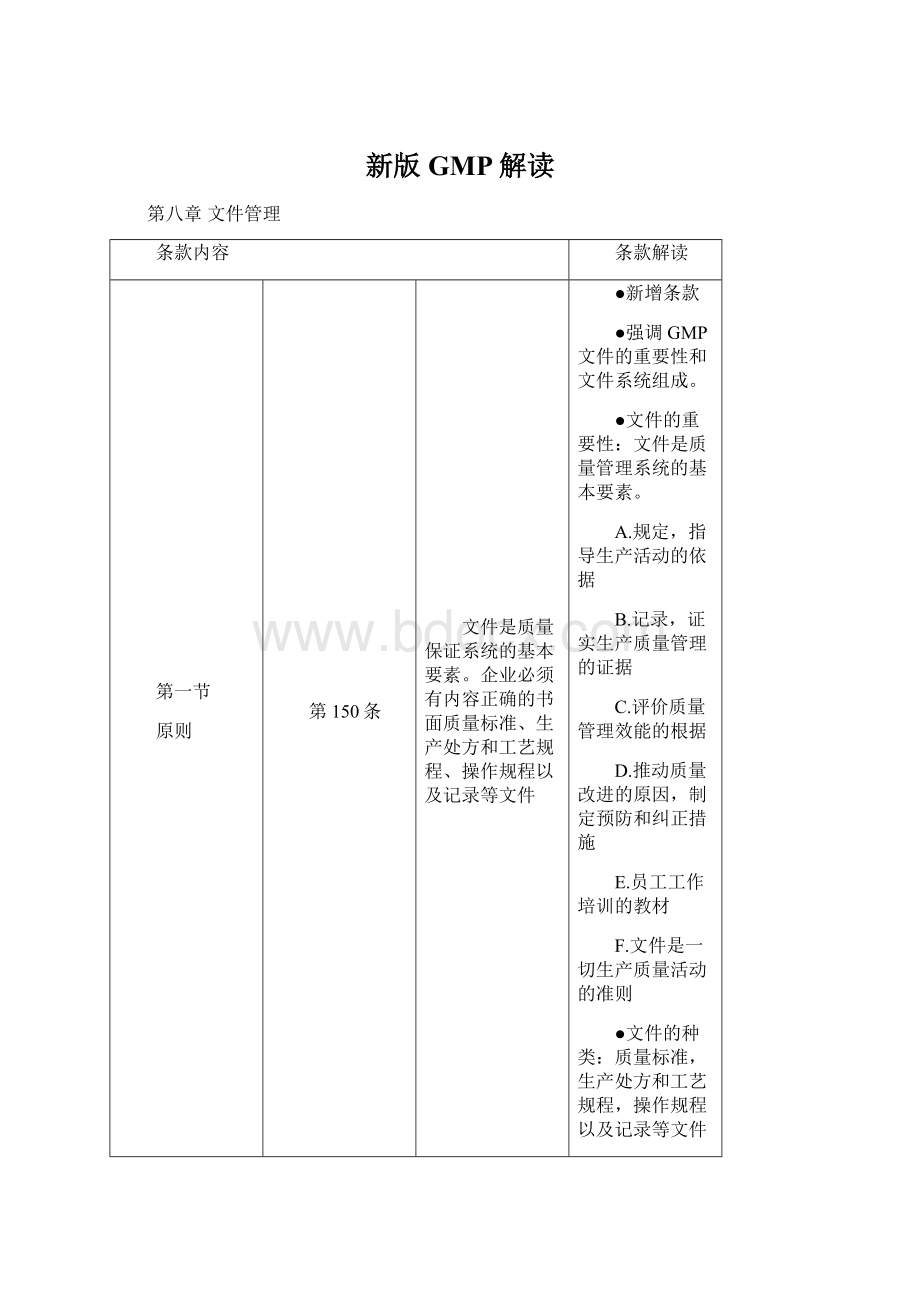
(一)英国系统大体上可分为四层:
一阶文件:
质量手册;
二阶文件:
程序文件;
三阶文件:
作业指导书;
四阶文件:
质量记录
(二)德国系统一阶文件:
程序手册;
三阶文件:
各种作业指导书,包括质量记录或表格
●
第八章文件管理
第151条
企业应当建立文件管理的操作规程,系统地设计、制定、审核、批准和发放文件。
与本规范有关的文件应当经质量管理部门的审核。
●完善条款
●根据98版规范第六十四条的原则,明确增加质量管理部门对GMP相关文件进行审核的管理要求。
1.文件管理文件化的要求:
企业应建立文件管理的操作规程
2.文件审核部门:
与本规范有关的文件应经过质量管理部门的审核
第152条
文件的内容应当与药品生产许可、药品注册等相关要求一致,并有助于追溯每批产品的历史情况。
●强调GMP相关技术文件的内容与产品注册资料一致性的要求,并提出可进行产品质量信息可追溯的要求。
⏹文件的法规符合性:
与药品生产许可;
药品注册;
药品相关法律,法规,规章及相关规范性文件等要求一致
⏹文件的作用:
有助于追溯每批产品的历史情况是文件的作用之一
第153条
文件的起草、修订、审核、批准、替换或撤销、复制、保管和销毁等应当按照操作规程管理,并有相应的文件分发、撤销、复制、销毁记录。
●根据98版规范第六十四条的原则,进一步明确补充文件受控发放与撤销,销毁的记录要求。
●文件整个生命周期的管理要求:
⏹文件的起草,制定修订,审核,批准,替换或撤销,复制,发放,保管和销毁等应按操作规程管理。
⏹文件分发,撤销,复制,销毁等都应有记录
第154条
文件的起草、修订、审核、批准均应当由适当的人员签名并注明日期。
●根据98版规范第六十五条的原则,进一步明确专门规定文件的起草,修订,审核与批准的管理要求。
1.责任到人:
文件的起草,修订,审核均由相关部门的适当的人员负责,质量负责人,生产负责人等负责文件的批准
2.可以追溯:
文件的起草,修订,审核,批准审后,应签名并注明日期
第155条
文件应当标明题目、种类、目的以及文件编号和版本号。
文字应当确切、清晰、易懂,不能模棱两可
●根据98版规范第六十五条的原则,进一步明确文件版本号的要求。
1.文件格式:
文件应标明题目,各类,目的以及文件编号和版本号
2.文字要求:
文字应确切,清晰,易懂,不能模棱两可。
第156条
文件应当分类存放、条理分明,便于查阅
●根据98版规范第六十五条的原则,进一步明确了文件的分类存放要求。
第157条
原版文件复制时,不得产生任何差错;
复制的文件应当清晰可辨。
●提出文件复制质量控制的专门要求。
第158条
文件应当定期审核、修订;
文件修订后,应当按照规定管理,防止旧版文件的误用。
分发、使用的文件应当为批准的现行文本,已撤销的或旧版文件除留档备查外,不得在工作现场出现。
●根据98版规范第六十四条的原则,进一步明确了文件定期审核和防止误用的要求。
第159条
与本规范有关的每项活动均应当有记录,以保证产品生产、质量控制和质量保证等活动可以追溯。
记录应当留有填写数据的足够空格。
记录应当及时填写,内容真实,字迹清晰、易读,不易擦除。
●根据98版规范第六十八条的原则,进一步明确了记录填写的规范要求。
第160条
应当尽可能采用生产和检验设备自动打印的记录、图谱和曲线图等,并标明产品或样品的名称、批号和记录设备的信息,操作人应当签注姓名和日期。
●强调客观电子记录的使用
●提出电子打印记录的管理要求
1.提倡电子自动打印记录,图谱和曲线图等,增强其准确性,及时性
2.电子自动打印记录,图谱和曲线图的管理要求:
(1)标明产品或样品的名称,批号和记录设备的信息
(2)操作人应签注姓名和日期
第161条
记录应当保持清洁,不得撕毁和任意涂改。
记录填写的任何更改都应当签注姓名和日期,并使原有信息仍清晰可辨,必要时,应当说明更改的理由。
记录如需重新誊写,则原有记录不得销毁,应当作为重新誊写记录的附件保存。
●根据98版规范第六十八条的原则,进一步明确了记录更改的规范要求。
●基本要求:
记录应保持清洁,不得撕毁和任意涂改
●记录更改的规定:
为保持记录的真实性,记录填写的任何更改都应签注姓名和日期,并使原有信息仍清晰可辩,必要时,应说明更改的理由
●记录重新誊写的规定:
为保持记录的真实性,记录如需重新誊写,则原有记录不行销毁,应作为重新誊写记录的附件保存。
第162条
每批药品应当有批记录,包括批生产记录、批包装记录、批检验记录和药品放行审核记录等与本批产品有关的记录。
批记录应当由质量管理部门负责管理,至少保存至药品有效期后一年。
质量标准、工艺规程、操作规程、稳定性考察、确认、验证、变更等其他重要文件应当长期保存。
●根据98版规范第六十八条原则,进一步明确批生产记录的范围
●强调质量管理部门对批记录文件的管理责任
●另外对确认和验证,稳定性考察记录提出长期保存的要求
第163条
如使用电子数据处理系统、照相技术或其他可靠方式记录数据资料,应当有所用系统的操作规程;
记录的准确性应当经过核对。
使用电子数据处理系统的,只有经授权的人员方可输入或更改数据,更改和删除情况应当有记录;
应当使用密码或其他方式来控制系统的登录;
关键数据输入后,应当由他人独立进行复核。
用电子方法保存的批记录,应当采用磁带、缩微胶卷、纸质副本或其他方法进行备份,以确保记录的安全,且数据资料在保存期内便于查阅。
●强调对电子记录的管理
●明确电子记录的录入与核对的控制
●明确电子记录更改与更改途径的追溯性控制
●明确电子的备份保存方式的管理要求
●对电子记录的基本要求:
1)记录数据方式可靠
2)记录的准确性应经过核对
3)就有所用系统的操作规程
●电子数据处理系统的管理:
1)只有经授权的人员方可输入或更改数据,更改和删除情况应有记录
2)应使用密码或其他方式来控制系统的登录
3)关键数据输入后,应由他人独立复核。
用电子方法保存批记录的要求:
应采用磁带,缩微胶卷,纸质副本或其他方法进行备份,以确保记录的安全,且数据资料在保存期内便于查阅
第二节 质量标准
第164条
物料和成品应当有经批准的现行质量标准;
必要时,中间产品或待包装产品也应当有质量标准
●提出物料和成品质量标准的管理要求
●关于中间产品或待包装产品质量标准制定:
1)必要性:
过程控制是GMP的精髓,生产过程需要控制的中间产品或待包装产品质量,因此必须制定相应的质量标准
2)标准类别:
中间产品或待包装产品质量标准为企业内控标准
3)制定的原则:
影响质量的关键要素,不低于法定标准;
依据产品质量年度回顾分析的统计数据;
生产工艺控制的要求以及实际生产的水平制定。
确保成品在有效期内符合法定标准
第165条
物料的质量标准一般应当包括:
(一)物料的基本信息:
1.企业统一指定的物料名称和内部使用的物料代码;
2.质量标准的依据;
3.经批准的供应商;
4.印刷包装材料的实样或样稿。
(二)取样、检验方法或相关操作规程编号;
(三)定性和定量的限度要求;
(四)贮存条件和注意事项;
(五)有效期或复验期。
●提出物料质量标准的编写内容的管理要求:
1.标准类别:
物料的质量标准指企业的内控标准
2.标准的制定:
物料质量标准指标不得低于(大都高于)法定标准的要求。
主要是增加检验项目或提高限度标准。
3.物料名称:
企业统一指定的物料名称通常应与法定名称保持一致
4.标准得内容:
以上9项内容未包括法定标准中的内容也应列入质量标准
5.物料的基本信息:
通用名称,规格,包装形式等
6.经批准的供应商:
这里的供应商指生产商,如经销商负责供货,还应注明经销商。
中药材,中药饮片应注明产地,并注明自行收购,GAP基地生产或经销商供应。
经批准的供应商包括经企业批准,原料药还应经药监注册部门批准
7.检验方法:
可以是法定的方法,也可以是经验证的其它检验方法。
如仲裁必须用法定的检验方法。
第166条
外购或外销的中间产品和待包装产品应当有质量标准;
如果中间产品的检验结果用于成品的质量评价,则应当制定与成品质量标准相对应的中间产品质量标准。
●对于有外购或外销的中间产品或待包装产品需制定质量标准
●当中间产品的质量状态不在改变时,中间产品的检验结果可用于成品质量评价。
--如片剂的中间检查项目
--如无菌制剂的无菌检测项目在灌装(灭菌后)取样
●外购或外销的中间产品和待包装产品的基本要求:
应有批准文号,有质量标准。
如广东两个制剂中间体文号:
奥美拉唑微丸(国药准字H)
●委托加工的中间产品和待包装产品必须有质量标准;
●中间产品的检验结果用于成品质量评价的前提条件:
1)当中间产品的质量指标至完成生产全过程,不会再发生变化时
2)而且中间产品的质量指标与成品质量标准相对应,中间产品质量指标的检验结果可用于成品质量评价
第167条
成品的质量标准应当包括:
(一)产品名称以及产品代码;
(二)对应的产品处方编号(如有);
(三)产品规格和包装形式;
(四)取样、检验方法或相关操作规程编号;
(五)定性和定量的限度要求;
(六)贮存条件和注意事项;
(七)有效期。
●提出成品的质量标准编制内容
第三节 工艺规程
第168条
每种药品的每个生产批量均应当有经企业批准的工艺规程,不同药品规格的每种包装形式均应当有各自的包装操作要求。
工艺规程的制定应当以注册批准的工艺为依据。
●强调不同生产批量都应当建立各自的工艺规程和批生产记录
●生产工艺规程的唯一性:
每种药品的每个生产批量均应有经企业指认的工艺规程。
●包装工艺规程的唯一性: