浙江省乐清国际外国语学校2014-2015学年高一下学期期末考试化学试题文档格式.doc
《浙江省乐清国际外国语学校2014-2015学年高一下学期期末考试化学试题文档格式.doc》由会员分享,可在线阅读,更多相关《浙江省乐清国际外国语学校2014-2015学年高一下学期期末考试化学试题文档格式.doc(12页珍藏版)》请在冰豆网上搜索。
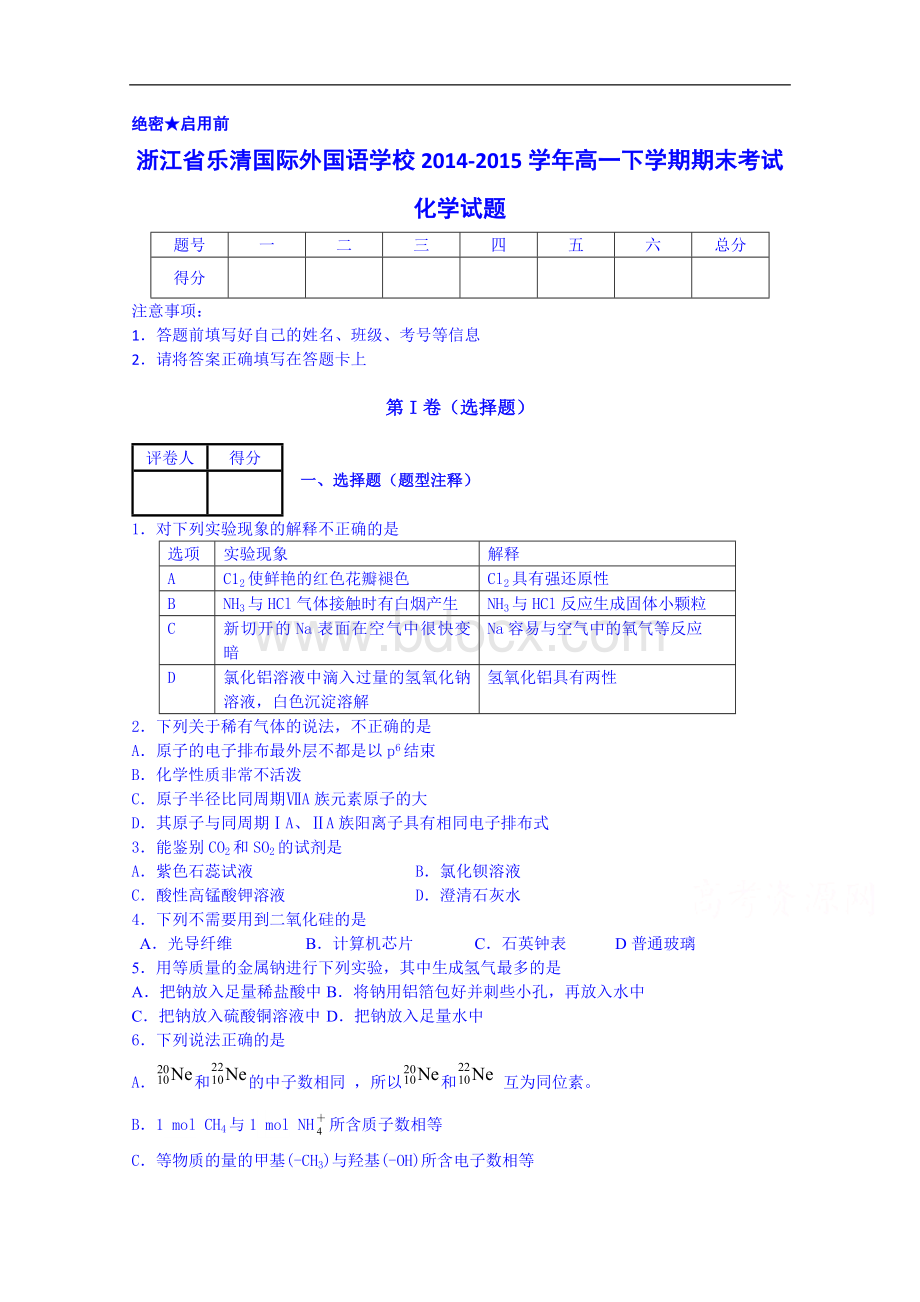
解释
A
C12使鲜艳的红色花瓣褪色
Cl2具有强还原性
B
NH3与HCl气体接触时有白烟产生
NH3与HCl反应生成固体小颗粒
C
新切开的Na表面在空气中很快变暗
Na容易与空气中的氧气等反应
D
氯化铝溶液中滴入过量的氢氧化钠溶液,白色沉淀溶解
氢氧化铝具有两性
2.下列关于稀有气体的说法,不正确的是
A.原子的电子排布最外层不都是以p6结束
B.化学性质非常不活泼
C.原子半径比同周期ⅦA族元素原子的大
D.其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式
3.能鉴别CO2和SO2的试剂是
A.紫色石蕊试液B.氯化钡溶液
C.酸性高锰酸钾溶液D.澄清石灰水
4.下列不需要用到二氧化硅的是
A.光导纤维B.计算机芯片
C.石英钟表D普通玻璃
5.用等质量的金属钠进行下列实验,其中生成氢气最多的是()
A.把钠放入足量稀盐酸中 B.将钠用铝箔包好并刺些小孔,再放入水中
C.把钠放入硫酸铜溶液中 D.把钠放入足量水中
6.下列说法正确的是
A.和的中子数相同,所以和互为同位素。
B.1molCH4与1molNH所含质子数相等
C.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
D.二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质
7.下列关于胶体说法正确的是
A.胶体是纯净物
B.胶体、溶液和浊液的本质区别是能否产生丁达尔现象
C.胶体不带电荷
D.胶体分散质粒子的直径在10-9~10-7μm之间
8.下列有关Na2CO3和NaHCO3的说法,错误的是
A.都易溶于水 B.水溶液都显碱性
C.都能与盐酸反应 D.加热都能分解
9.下列说法不正确的是( )
A.工艺师可利用氢氟酸刻蚀石英制作艺术品,说明氢氟酸的酸性很强
B.水晶项链和光导纤维的主要成分是相同的
C.粗硅的制备及提纯单晶硅均涉及到氧化还原反应
D.我国自主研发的“龙芯1号”CPU芯片与神舟六号飞船使用的太阳能电池都用到硅
10.在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内HNO3的物质的量浓度的大小范围是()
A.<c(HNO3)<B.<c(HNO3)<
C.<c(HNO3)<D.<c(HNO3)<
11.下列离子方程式正确的是( )
A.利用醋酸溶解含碳酸钙的水垢:
CaCO3+2H+=Ca2++H2O+CO2↑
B.用铜为电极电解饱和食盐水:
2Cl-+2H2OCl2↑+H2↑+2OH-
C.在明矾溶液中滴加过量氨水:
Al3++4NH3·
H2O=AlO2—+4NH4++2H2O
D.在小苏打溶液中加少量Ba(OH)2溶液:
2HCO3—+Ba2++2OH-=BaCO3↓+2H2O+CO32—
12.研究表明:
多种海产品体内含有+5价的砷(As)元素,对人体无毒,而砒霜的成分是As2O3,有剧毒;
青菜中含有维生素C。
专家忠告:
不要同时大量食用海鲜和青菜,否则容易中毒。
下面有关解释正确的是
A.As2O3中As元素为+3价B.维生素C能将+5价砷还原成As2O3
C.致人中毒过程中砷发生氧化反应D.维生素C具有氧化性
13.下列物质中,只含有离子键,不含有共价键的是
A.HCl B.KOH C.CaCl2 D.CO2
14.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.2g,若其中水的质量为10.8g。
则CO的质量是
A.2.1gB.2.6gC.3.8gD.5.1g
15.下列各组物质中所含分子数一定相同的是()
A.5.6LN2和11gCO2B.5gCO和5gH2
C.含1molH原子的H2O和0.5molBr2D.质子数相等的NH3和HCl
16.下表是元素周期表主族元素的一部分。
Z
W
X
Y
短周期元素W的最外层电子数是最内层电子数的2倍,Y单质可在空气中燃烧。
下列叙述错误的是()
A.Y的最高价氧化物的水化物是强酸
B.W的最高价氧化物能溶于烧碱溶液
C.Z的氧化物只有一种
D.X的最高正价是+5价
17.下列说法正确的是()
A.SiO2能和水发生化合反应生成硅酸B.SiO2是酸性氧化物,它不溶于任何酸
C.SiO2的俗名叫水玻璃,不溶于水D.SiO2又叫水晶,能溶于NaOH溶液中
18.短周期元素W、X、Y、Z在元素周期表中的位置关系如图所示。
下列说法正确的是
A.A.元素Y的最高价氧化物对应水化物的酸性比Z的强
B.元素Z一定位于元素周期表的第3周期第ⅦA族
C.原子半径的大小顺序为rY>
rW>
rX
D.元素X可能为硼或碳或氮
19.下列有关说法正确的是( )
A.1molCl2参加反应转移电子数一定为2NA
B.在反应KIO3+6HIKI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
C.根据反应中HNO3(稀)NO,而HNO3(浓)NO2可知,氧化性HNO3(稀)>
HNO3(浓)
D.含有大量NO3—的溶液中,不能同时大量存在H+、Fe2+、Cl-
20.下列物质中主要成分不是二氧化硅的是( )
A. 硅胶B.水晶C.玛瑙D. 硅石
21.离子反应是中学化学中重要的反应类型,在发生离子反应的反应物或生成物中,一定存在:
①单质;
②氧化物;
③电解质;
④盐;
⑤化合物 ( )
A.①② B.③⑤ C.④⑤ D.①②④
22.氧化镁、碳酸氢钠、氢氧化铝、碳酸钙均可用于治疗胃酸(主要成分是盐酸)过多。
它们分别与盐酸反应,依次对应的离子方程式正确的是
A. B.
C. D.
23.下列关于CO2与SO2说法不正确的是
A.都是无色气体 B.都是非电解质
C.通入Ba(OH)2溶液中都能产生白色沉淀 D.都是形成酸雨的主要原因
24.短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是()
A.Be、Na、AlB.C、Al、P
C.B、Mg、SiD.O、P、Cl
25.某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5mL0.2mol·
L-1盐酸,发生的现象是:
开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g。
下列说法中正确的是:
A.该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
26.下列判断正确的是:
①任何物质在水中都有一定的溶解度②浊液用过滤的方法分离③分散系一定是混合物④丁达尔效应、布朗运动、渗析都是胶体的物理性质⑤同一种溶质的饱和溶液要比不饱和溶液浓些⑥布朗运动不是胶体所特有的运动方式⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些。
A、③⑥⑧B、②④⑥⑧⑦C、①②③④⑤D、全部不正确。
27.设NA为阿伏伽德罗常数,下列叙述正确的是()
A.24g镁的原子最外层电子数为NA
B.1L0.1mol/L乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
28.根据表中信息判断,下列选项不正确的是
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4…
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4—…
Cl2、Mn2+…
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1molCl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4—>
Cl2>
Fe3+>
Br2
29.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。
X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。
A.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
B.39gZ2Y2中含有的离子数约为1.204×
1024
C.元素Z、R的氧化物的水化物之间相互反应生成的盐一定是正盐
D.元素Y、R分别与元素X形成的化合物的热稳定性:
XmY>
XmR
30.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是
第II卷(非选择题)
二、填空题(40分)
31.(4分)工业上用亚硫酸氢钠(NaHSO3)与碘酸钠(NaIO3)反应制备单质碘。
试配平该反应的化学方程式,并标出电子转移的总数及方向。
32.(14分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。
X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;
Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。
请回答:
(1)X元素是________;
Y元素是________;
Z元素是:
________。
(2)XZ3化合物的分子式是_________,电子式是_________。
(3)分别写出X、Y的含氧酸的分子式_________、_________。
33.(12分)①~⑩十种元素,在元素周期表中的位置如图所示。
回答下列问题:
(1)在上述十种元素中,置换酸中氢的能力最强的元素为(填化学符号,下同);
最高价氧化物的水化物的酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是;
原子半径最大的元素是,半径最小的离子是。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第周期族,该元素的单质在空气中燃烧的化学方程式为