人教版高中化学选修5全册知识点Word文档格式.doc
《人教版高中化学选修5全册知识点Word文档格式.doc》由会员分享,可在线阅读,更多相关《人教版高中化学选修5全册知识点Word文档格式.doc(32页珍藏版)》请在冰豆网上搜索。
(3)将支链的名称写在主链名称的前面,在支链的前面用阿拉伯数字注明它在主链上所处的位置,并在数字与名称之间用一短线隔开。
例如,用系统命名法对异戊烷命名:
2—甲基丁烷
(4)如果主链上有相同的支链,可以将支链合并起来,用“二”“三”等数字表示支链的个数。
两个表示支链位置的阿拉伯数字之间需用“,”隔开。
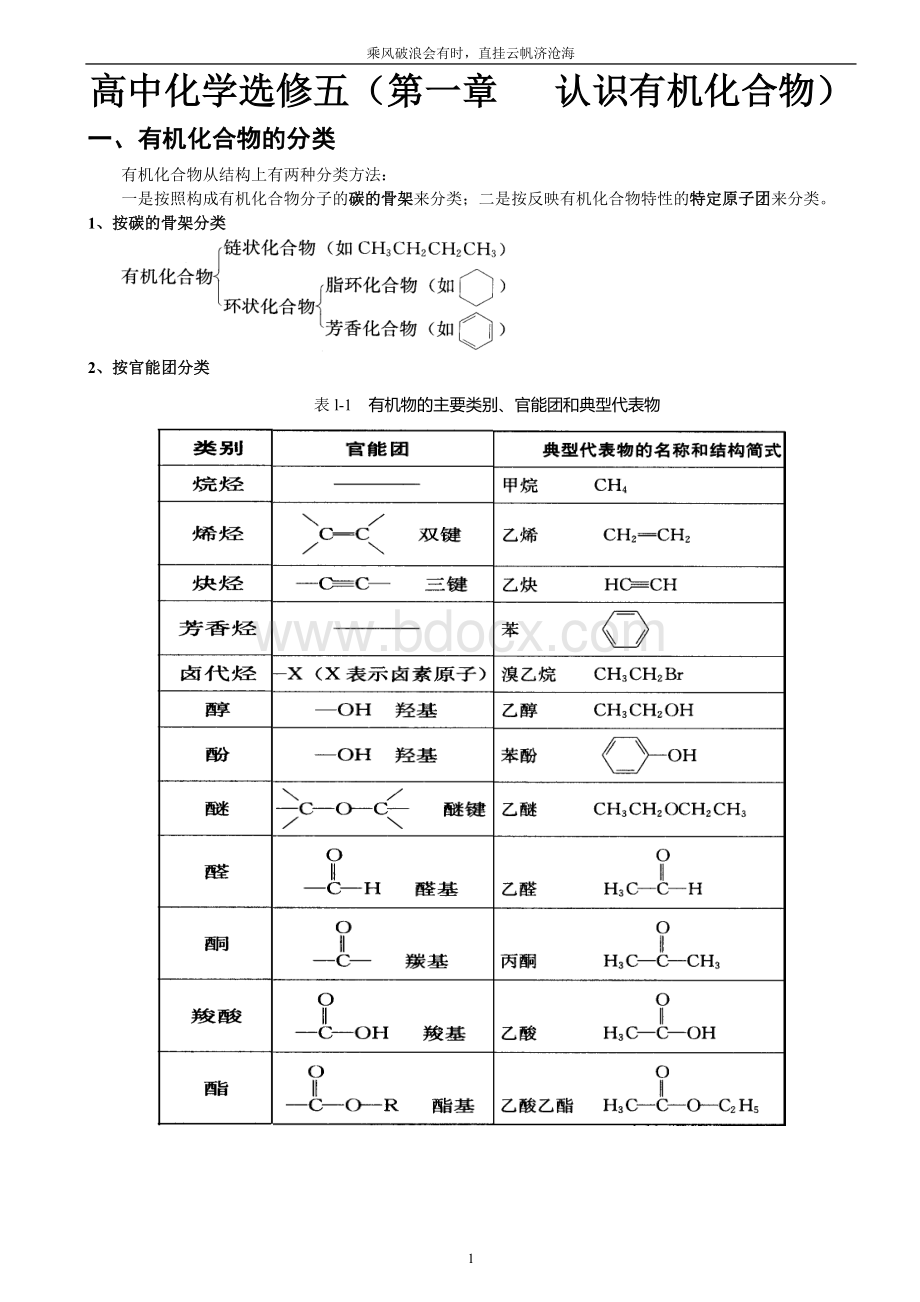
下面以2,3—二甲基己烷为例,对一般烷烃的命名可图示如下:
如果主链上有几个不同的支链,把简单的写在前面,把复杂的写在后面。
2—甲基—4—乙基庚烷
2、烯烃和炔烃的命名
前面已经讲过,烷烃的命名是有机化合物命名的基础,其他有机物的命名原则是在烷烃命名原则的基础上延伸出来的。
下面,我们来学习烯烃和炔烃的命名。
(1)将含有双键或三键的最长碳链作为主链,称为“某烯”或“某炔”。
(2)从距离双键或三键最近的一端给主链上的碳原子依次编号定位。
(3)用阿拉伯数字标明双键或三键的位置(只需标明双键或三键碳原子编号较小的数字)。
用“二”“三"
等表示双键或三键的个数。
1—丁烯2—戊炔
2—甲基—2,4—己二烯4—甲基—1—戊炔
3、苯的同系物的命名
苯的同系物的命名是以苯作母体的。
苯分子中的氢原子被甲基取代后生成甲苯,被乙基取代后生成乙苯。
如果两个氢原子被两个甲基取代后,则生成的是二甲苯。
由于取代基位置不同,二甲苯有三种同分异构体。
它们之间的差别在于两个甲基在苯环上的相对位置不同,可分别用“邻”“间”和“对”来表示:
邻二甲苯间二甲苯对二甲苯
若将苯环上的6个碳原子编号,可以某个甲基所在的碳原子的位置为l号,选取最小位次号给另一甲基编号,则邻二甲苯也可叫做1,2—二甲苯,间二甲苯叫做1,3—二甲苯,对二甲苯叫做1,4—二甲苯。
四、研究有机化合物的一般步骤和方法
下面是研究有机化合物一般要经过的几个基本步骤:
测定相对分子质量确定分子式
波谱分析确定结构式
分离
提纯
元素定量分析确定实验式
1、分离、提纯
(1).蒸馏
蒸馏是分离、提纯液态有机物的常用方法。
当液态有机物含有少量杂质,而且该有机物热稳定性较强,与杂质的沸点相差较大时(一般约大于30℃),就可以用蒸馏法提纯此液态有机物。
(2).重结晶
重结晶的首要工作是选择适当的溶剂,要求该溶剂:
(1)杂质在此溶剂中溶解度很小或溶解度很大,易于除去;
(2)被提纯的有机物在此溶剂中的溶解度,受温度的影响较大。
该有机物在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出,等等。
(3).萃取
萃取包括液—液萃取和固—液萃取。
液一液萃取是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
液—液萃取是分离、提纯有机物常用的方法,分液漏斗是萃取操作的常用玻璃仪器。
一般是用有机溶剂从水中萃取有机物,常用的与水不互溶的有机溶剂有乙醚、石油醚、二氯甲烷等。
固一液萃取是用有机溶剂从固体物质中溶解出有机物的过程,在实验室和工厂中用专用的仪器和设备进行这一操作。
分离、提纯后的有机物经过纯度鉴定后,可用于进行元素组成的分析、相对分子质量的测定和分子结构的鉴定。
2、元素分析与相对分子质量的测定
(1).元素分析
元素定量分析的原理是将一定量的有机物燃烧,分解为简单的无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算出该有机物分子所含元素原子最简单的整数比,即确定其实验式。
【例题】某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,试求该未知物A的实验式。
元素分析只能确定组成分子的各原子最简单的整数比。
有了实验式,还必须知道该未知物的相对分子质量,才能确定它的分子式。
目前有许多测定相对分子质量的方法,质谱法是最精确、快捷的方法。
2).相对分子质量的测定——质谱法
质谱是近代发展起来的快速、微量、精确测定相对分子质量的方法。
它用高能电子流等轰击样品分子,使该分子失去电子
变成带正电荷的分子离子和碎片离子。
分子离子、碎片离
子各自具有不同的相对质量,它们在磁场的作用下到达检
测器的时间将因质量的不同而先后有别,其结果被记录为
质谱图。
右图中最右边的分子离子峰(CH3CH2OH)表示的
是上面例题中未知物质A的相对分子质量。
未知物A的相对分子质量为46,实验式C2H6O的式量是46,所以未知物A的实验式和分子式都是
C2H6O。
但是,符合此分子式的结构式应有两种:
二甲醚乙醇
究竟它是二甲醚还是乙醇?
只有鉴定分子结构才能够确定。
与鉴定有机物结构有关的物理方法有质谱、
红外光谱、紫外光谱、核磁共振谱等,我们在这里仅介绍红外光谱与核磁共振氢谱的应用。
3、分子结构的鉴定
(1).红外光谱
例如,上面例题中未知物A的红外光谱图(如下图)上发现有O—H键、C—H键和C—O键的振动吸收。
因此,可以初步推测该未知物A是含羟基的化合物,结构简式可写为C2H5—OH。
未知物A的红外光谱
2.核磁共振氢谱
未知物A(C2H5—OH)的核磁共振氢谱有三个峰(如图l—8),峰面积之比是1:
2:
3,它们分别为羟基的一个氢原子,亚甲基(>
CH2)上的二个氢原子和甲基上的三个氢原子的吸收峰。
而二甲醚(CH3OCH3)中的六个氢原子均处于相同的化学环境中,只有一种氢原子,应只有一个吸收峰(如下图)。
未知物A的核磁共振氢谱
二甲醚的核磁共振氢谱
从上述未知物A的红外光谱和核磁共振氢谱可以知道:
(1)红外光谱图表明有羟基—OH、C—O键和烃基C—H键红外吸收峰;
(2)核磁共振氢谱有三种类型氢原子的吸收峰。
因此,未知物A的结构简式应该是CH3CH2OH,而不是CH3OCH3。
一、各类烃的代表物的结构、特性
类别
烷烃
烯烃
炔烃
苯及同系物
通式
CnH2n+2(n≥1)
CnH2n(n≥2)
CnH2n-2(n≥2)
CnH2n-6(n≥6)
代表物结构式
H—C≡C—H
相对分子质量Mr
16
28
26
78
碳碳键长(×
10-10m)
1.54
1.33
1.20
1.40
键角
109°
28′
约120°
180°
120°
分子形状
正四面体
6个原子
共平面型
4个原子
同一直线型
12个原子共平面(正六边形)
主要化学性质
光照下的卤代;
裂化;
不使酸性KMnO4溶液褪色
跟X2、H2、HX、H2O、HCN加成,易被氧化;
可加聚
跟X2、H2、HX、HCN加成;
易被氧化;
能加聚得导电塑料
跟H2加成;
FeX3催化下卤代;
硝化、磺化反应
二、烃的衍生物的重要类别和各类衍生物的重要化学性质
类别
通式
官能团
代表物
分子结构结点
卤代烃
一卤代烃:
R—X
多元饱和卤代烃:
CnH2n+2-mXm
卤原子
—X
C2H5Br
(Mr:
109)
卤素原子直接与烃基结合
β-碳上要有氢原子才能发生消去反应
1.与NaOH水溶液共热发生取代反应生成醇
2.与NaOH醇溶液共热发生消去反应生成烯
醇
一元醇:
R—OH
饱和多元醇:
CnH2n+2Om
醇羟基
—OH
CH3OH
32)
C2H5OH
46)
羟基直接与链烃基结合,O—H及C—O均有极性。
β-碳上有氢原子才能发生消去反应。
α-碳上有氢原子才能被催化氧化,伯醇氧化为醛,仲醇氧化为酮,叔醇不能被催化氧化。
1.跟活泼金属反应产生H2
2.跟卤化氢或浓氢卤酸反应生成卤代烃
3.脱水反应:
乙醇
140℃分子间脱水成醚
170℃分子内脱水生成烯
4.催化氧化为醛或酮
5.一般断O—H键与羧酸及无机含氧酸反应生成酯
醚
R—O—R′
醚键
C2H5OC2H5
74)
C—O键有极性
性质稳定,一般不与酸、碱、氧化剂反应
酚
酚羟基
94)
—OH直接与苯环上的碳相连,受苯环影响能微弱电离。
1.弱酸性
2.与浓溴水发生取代反应生成沉淀
3.遇FeCl3呈紫色
4.易被氧化
醛
醛基
HCHO
30)
44)
HCHO相当于两个
—CHO
有极性、能加成。
1.与H2、HCN等加成为醇
2.被氧化剂(O2、多伦试剂、斐林试剂、酸性高锰酸钾等)氧化为羧酸
酮
羰基
58)
有极性、能加成
与H2、HCN加成为醇
不能被氧化剂氧化为羧酸
羧酸
羧基
60)
受羰基影响,O—H能电离出H+,受羟基影响不能被加成。
1.具有酸的通性
2.酯化反应时一般断羧基中的碳氧单键,不能被H2加成
3.能与含—NH2物质缩去水生成酰胺(肽键)
酯
酯基
HCOOCH3
88)
酯基中的碳氧单键易断裂
1.发生水解反应生成羧酸和醇
2.也可发生醇解反应生成新酯和新醇
硝酸酯
硝酸酯基
—ONO2
不稳定
易爆炸
RONO2
硝基化合物
硝基—NO2
一硝基化合物较稳定
一般不易被氧化剂氧化,但多硝基化合物易爆炸
R—NO2
氨基酸
RCH(NH2)COOH
氨基—NH2
羧基—COOH
H2NCH2COOH
75)
—NH2能以配位键结合H+;
—COOH能部分电离