最新初中科学竞赛辅导《酸碱盐》经典计算20题Word文档下载推荐.doc
《最新初中科学竞赛辅导《酸碱盐》经典计算20题Word文档下载推荐.doc》由会员分享,可在线阅读,更多相关《最新初中科学竞赛辅导《酸碱盐》经典计算20题Word文档下载推荐.doc(15页珍藏版)》请在冰豆网上搜索。
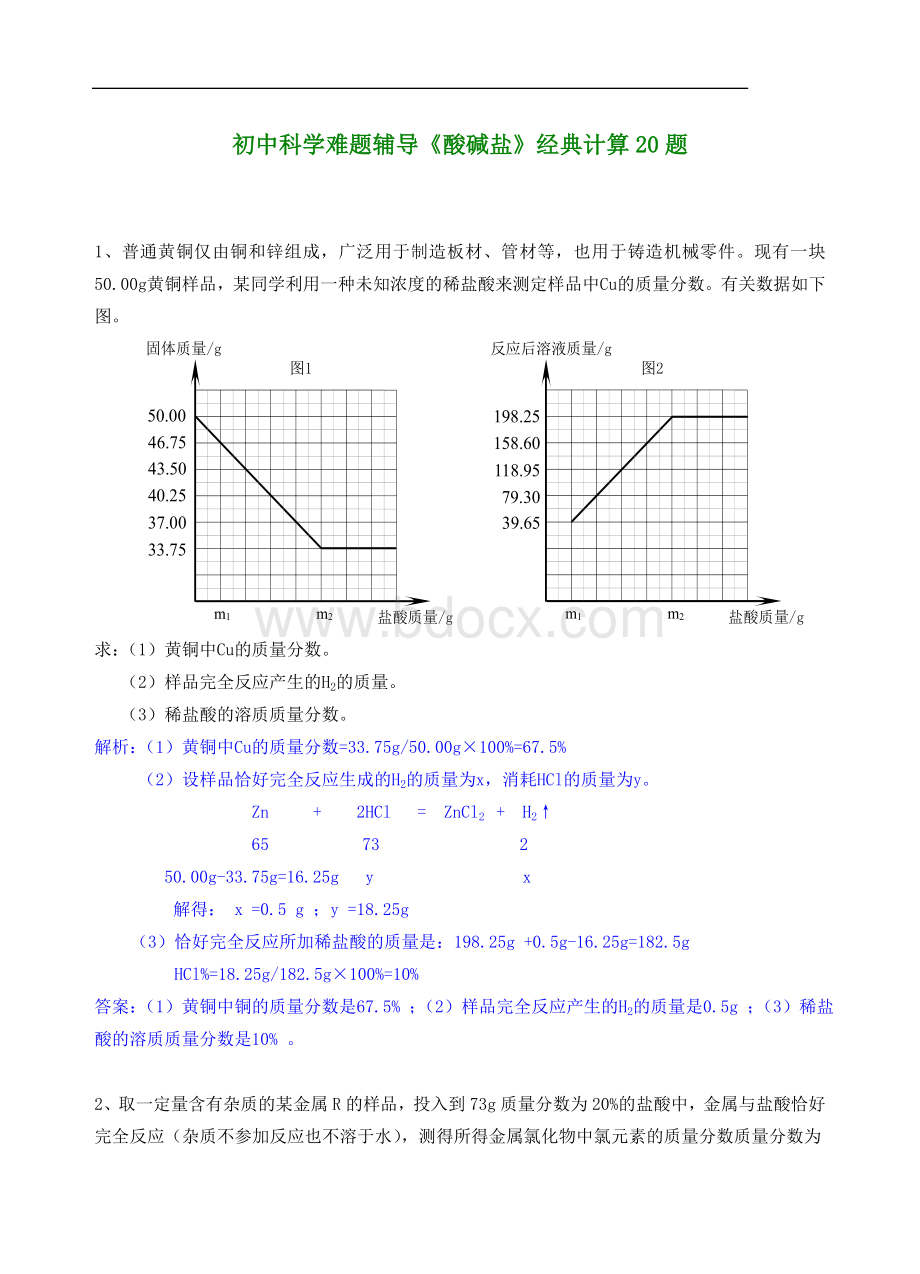
(1)黄铜中铜的质量分数是67.5%;
(2)样品完全反应产生的H2的质量是0.5g;
(3)稀盐酸的溶质质量分数是10%。
2、取一定量含有杂质的某金属R的样品,投入到73g质量分数为20%的盐酸中,金属与盐酸恰好完全反应(杂质不参加反应也不溶于水),测得所得金属氯化物中氯元素的质量分数质量分数为74.4%。
计算:
(1)样品中含金属R的质量?
(2)所得溶液中溶质的质量分数?
73g质量分数为20%的盐酸中HCl的质量=73×
20%=14.6g
其中含Cl=14.6×
35.5/(35.5+1)=14.2g
含H=14.6-14.2=0.4g
设样品中金属R的质量为m
依题意有14.2/(14.2+m)=74.7%
m=4.8g
所得溶液中溶质的质量分数=(4.8+14.2)/(4.8+73-0.4)×
100%=24.5%
3.某学生在课外活动中用一定量的二价金属R和稀硫酸反应来制取氢气,所做的五次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,气体体积在相同条件下测定)。
实验编号
R的质量/g
稀硫酸的体积/mL
生成H2的体积/L
1
1.5
50.0
1.47
2
2.0
1.96
3
2.2
2.16
4
2.5
5
3.0
根据上述实验结果回答下列问题:
(1)上述实验中,金属一定过量的组的编号是,稀硫酸一定过量的组的编号是。
(2)若在当时实验条件下,H2的密度为0.085g/L,则反应所用金属R的相对原子质量是多少?
(3)若所使用的稀硫酸密度为1.12g/cm3,则反应所用的硫酸溶液中溶质的质量分数是多少?
(1)根据数据和酸的量不变,酸过量时,金属质量和氢气的量成正比,酸不足时,氢气的量不变,则金属一定过量的是实验4和5,酸一定过量的是实验1和2;
(2)设金属的相对原子质量为X,则:
R+H2SO4═RSO4+H2↑
X
2
1.5
0.085×
X/1.5=2/(0.085×
1.47)
X═24
(3)设硫酸的质量分数为y,则
98
50×
1.12×
y
98/2=(50×
1.12y)/(0.085×
2.16)
解得y≈16%
(1)4和5;
1和2;
(2)所用金属R的相对原子质量是24;
(3)反应所用的硫酸溶液中溶质的质量分数是16%。
4、向49克稀硫酸中加入50克20.8%的氯化钡溶液,充分反应后,硫酸有剩余。
滤出沉淀,向滤液中加入32克25%的氢氧化钠溶液后,测得溶液正好呈中性,求硫酸的质量分数。
(1)常规解法:
H2SO4+BaCl2=BaSO4↓+2HCl
由氯化钡的质量10.4g,可求得硫酸的质量是4.9g,生成的HCl质量为3.65g;
HCl+NaOH=NaCl+H2O
由HCl质量为3.65g可算出与之反应的NaOH质量为4克;
H2SO4+2NaOH=Na2SO4+2H2O
由氢氧化钠的质量8g-4g,可算出与之反应的硫酸质量是4.9g
所以,硫酸的总质量是9.8g
质量分数=9.8/49×
100%=20%
(2)捷径解法
H2SO4~2NaOH
9880
x32×
25%g
解得x=9.8g
H2SO4=9.8/49×
5、现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:
Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:
NaHCO3+HCl=NaCl+CO2↑+H2O。
已知:
该温度下CO2密度为1.98g/L,实验测得产生
的CO2的与加入稀盐酸的数据如右图。
(1)当加入g盐酸时,才开始产生CO2;
图中V=mL。
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?
(1)查图可知,当加入5g盐酸时,才开始产生CO2;
图中V=444mL。
(2)①444mLCO2的质量为:
444mL×
1.98g/L=0.88g
设产生0.88gCO2时,消耗HCl的质量为xg
NaHCO3+HCl=NaCl+CO2↑+H2O
36.544
x0.88g
x=0.73g
HCl%=0.73÷
(15-5)×
100%=7.3%(方法可有多种)
②设加入5g盐酸时,有ygNa2CO3转化为zgNaHCO3。
Na2CO3+HCl=====NaHCO3+NaCl
10636.584
y5g×
7.3%z
y=1.06g.;
z=0.84g.
556mLCO2的质量为:
[556mL÷
(1000mL)]×
1.98g/L=1.10g
设放出556mLCO2时反应的NaHCO3质量为m。
则:
NaHCO3+HCl=NaCl+CO2↑+H2O
8444
m1.10g
m=2.10g
则原样品中NaHCO3的质量为:
2.1g-0.84g=1.26g
(1)5444
(2)①盐酸中HCl的质量分数为7.3%;
②原样品中有Na2CO31.06g.、NaHCO31.26g。
6.有一置于水中用特殊材料制成的密闭容器,气体分子可以通过该容器的器壁,而液体和固体则不能通过。
容器质量为1g,体积为0.04L。
容器内盛有32.5g质量分数为40%的稀硫酸,如果向其中加入锌粒,要想保持容器在水中不沉底,则锌粒的质量最大不能超过多少?
要使容器在水中不下沉,容器和它内部的物质产生的重力最大不能超过水对容器的浮力F,即:
[m(容器)+m(硫酸)+m(锌粒)-m(氢气)]g=F
设加入的锌粒的质量为x,由:
Zn+H2SO4==ZnSO4+H2↑
652
x2x/65
生成氢气的质量为x/32.5克
则有:
[32.5×
10-3kg+1×
10-3kg+x-(x/32.5)]×
9.8N/kg
=0.04×
10-3m3×
1000kg/m3×
x=6.5×
10-3kg=6.5g
加入锌粒的质量最大不能超过6.5g。
7.某学校科学兴趣小组为了探究实验室中久置的NaOH的变质程度,具体如下:
【研究方案】先称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。
从而进一步确定样品中NaOH的变质程度。
(变质程度是指已变质的NaOH在原NaOH
中的质量分数)
【解决问题】实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示。
此NaOH
的变质程度(用质量分数表示)是多少?
。
【继续探究】求实验过程中与NaOH反应所用的盐酸的质量是多少?
【发现问题】根据“与NaOH反应所用的盐酸的质量”,对照图像,你发现了什么问题(不必回答具体原因):
。
[解决问题]由反应产生2.2克CO2可算出Na2CO3的质量为5.3克;
进一步可算出变质的NaOH质量为4.0克;
故NaOH的变质程度为4.0/(13.3-5.3+4.0)×
100%=33.3%
[深入探究]m(NaOH)=13.3g-5.3g=8g
NaOH+HCl=NaCl+H2O
40
36.5
8g
m(HCl)’
m(HCl)’=8g×
36.5/40=7.3g
m[HCl(溶液)]=7.3g/14.6%=50.0g
[发现问题]NaOH被中和后,滴加盐酸,为什么没有立即产生CO2气体(其他合理答案也可)。
8.某化学兴趣小组在做Fe和CuS04溶液反应实验时,发现生成Cu的同时有气泡产生。
为了进一步研究做了如下实验:
①取8.5gFe粉放入一定量的CuS04溶液中,反应完成后,滤出固体,洗涤、干燥后称量,固体质量为9.2g。
②将9.2g固体与一定质量分数的稀盐酸充分反应,消耗盐酸50.0g,根据实验绘制反应产生氢气的质量与反应时间的关系图(见右图)。
(1)稀盐酸的质量分数,与稀盐酸反应的Fe的质量。
(2)与CuS04反应的Fe的质量。
(3)与CuS04反应的Fe的质量及与盐酸反应的Fe
的质量之和_______8.5g(选填“>
”、“<
”、“=”)。
对此结果作出你的解释。
(1)设9.2g固体中Fe的质量为x,盐酸的质量分数为w。
Fe+2HCI=FeCl2+H2
56732
x50.0g×
w0.10g
56:
2=x:
0.10g
x=2.8g
73:
2=50.0g×
w:
w=7.3%
(2)设与CuS04反应的Fe的质量为y
Fe+CuS04=FeS04+Cu
5664
y(9.2-2.8)g
64=y:
(9.2-2.8)g
解得y=5.6g
(3)2.8g+5.6g=8.4g<
8.5