人教版九年级化学中考流程题归纳Word文件下载.doc
《人教版九年级化学中考流程题归纳Word文件下载.doc》由会员分享,可在线阅读,更多相关《人教版九年级化学中考流程题归纳Word文件下载.doc(6页珍藏版)》请在冰豆网上搜索。
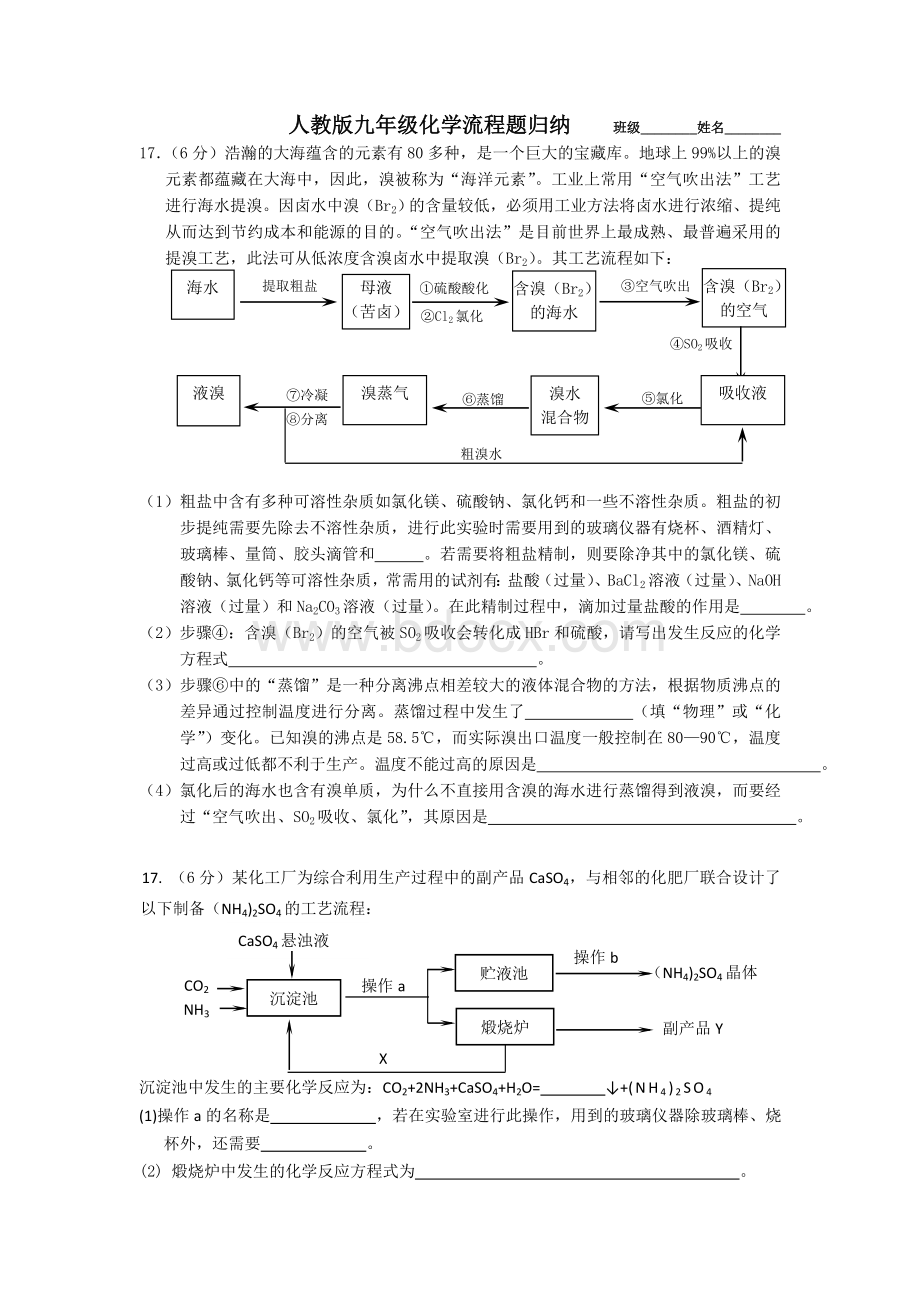
②Cl2氯化
④SO2吸收
⑦冷凝
⑧分离
⑥蒸馏
⑤氯化
吸收液
溴蒸气
液溴
粗溴水
(1)粗盐中含有多种可溶性杂质如氯化镁、硫酸钠、氯化钙和一些不溶性杂质。
粗盐的初步提纯需要先除去不溶性杂质,进行此实验时需要用到的玻璃仪器有烧杯、酒精灯、玻璃棒、量筒、胶头滴管和。
若需要将粗盐精制,则要除净其中的氯化镁、硫酸钠、氯化钙等可溶性杂质,常需用的试剂有:
盐酸(过量)、BaCl2溶液(过量)、NaOH溶液(过量)和Na2CO3溶液(过量)。
在此精制过程中,滴加过量盐酸的作用是。
(2)步骤④:
含溴(Br2)的空气被SO2吸收会转化成HBr和硫酸,请写出发生反应的化学方程式。
(3)步骤⑥中的“蒸馏”是一种分离沸点相差较大的液体混合物的方法,根据物质沸点的差异通过控制温度进行分离。
蒸馏过程中发生了(填“物理”或“化学”)变化。
已知溴的沸点是58.5℃,而实际溴出口温度一般控制在80—90℃,温度过高或过低都不利于生产。
温度不能过高的原因是。
(4)氯化后的海水也含有溴单质,为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”,其原因是。
17.(6分)某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程:
沉淀池
CO2NH3
CaSO4悬浊液
操作a
贮液池
煅烧炉
操作b
(NH4)2SO4晶体
副产品Y
X
沉淀池中发生的主要化学反应为:
CO2+2NH3+CaSO4+H2O=↓+(NH4)2SO4
(1)操作a的名称是,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要。
(2)煅烧炉中发生的化学反应方程式为。
(3)操作b的名称是,该工艺中可循环使用的为(填化学式)。
18.(6分)工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液)。
主要生产流程如下:
(已知2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是。
(2)若在实验室里分离“设备(I)”中的混合物,用到的操作的名称是。
(3)“沉淀池”中的反应是在加压的条件下不断向食盐水和饱和氨水溶液中通入二氧化碳气体,试分析该流程需要加压条件的原因是:
。
(4)“设备(Ⅱ)”中固体A与水反应的化学方程式是。
(5)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有(填写化学式)。
(6)请写出一个该生产流程的优点:
。
17.(5分)某工厂用CaSO4悬浊液、NH3和CO2制备(NH4)2SO4,其工艺流程如下:
(1)先通氨气再通二氧化碳的原因。
(2)硫酸铵在农业生产中的用途是____________,写出利用该流程制备(NH4)2SO4的化学方程式:
_______________________________________________________________。
(3)通过查阅溶解度曲线知(NH4)2SO4的溶解度随温度变化较大,那么提纯滤液以获得(NH4)2SO4晶体,必要的操作2中包含步骤有____________。
A.蒸干
B.蒸发
C.冷却结晶
D.过滤
(4)上述生成流程中,有关NH3的作用及说明正确的是______________。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产132g(NH4)2SO4,至少消耗34gNH3
18.某研究人员按下图所示流程进行“燃煤烟气的脱硫研究”。
实验中,SO2和O2混合气体连续通入,水和铁在起始时一次性加入,反应液多次循环。
吸收池
反应池
(1)吸收池中发生反应的化学方程式是2SO2+2H2O+O2====2H2SO4,吸收时,温度不宜过高的原因是。
(2)反应池中发生反应的化学方程式是
;
为确保反应液的循环吸收效果,反应池中的反应需控制在40℃左右进行,在此条件下欲加快该反应速率宜采取的措施有。
(3)随着反应液流入吸收池中,吸收液中H2SO4的生成速率明显加快,其原因可能是
。
(4)经过多次循环后,反应液可以用来制备FeSO4·
7H2O,它在医疗上常用于治疗
(选填字母)。
A.甲状腺肿大B.佝偻病C.龋齿D.贫血症
17.(6分)FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验。
该实验小组同学通过查阅资料,进行了尝试。
样品溶液
FeCl2
CuCl2
通入Cl2
溶液甲
FeCl3
HCl
加CuO
调pH
b
c
操作x
CuCl2溶液
Fe(OH)3沉淀
加稀盐酸
FeCl3溶液
d
a
【阅读资料:
】
不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。
下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3
Cu(OH)2
开始沉淀的pH
1.9
4.7
沉淀完全的pH
3.2
6.7
(1)操作x是。
(2)实验中,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式;
该反应属于反应(填基本反应类型)。
你认为步骤b调节溶液的pH到(填数值范围)比较合适。
(3)实验中,步骤d加稀盐酸前,因缺少(填操作名称)而使获得的氯化铁溶液不纯。
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用(用字母表示)最合理。
A.稀硝酸B.稀硫酸C.稀盐酸D.稀醋酸.
17.(6分)炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:
(1)操作1把废渣粉碎的目的。
(2)在废渣粉末中加入NaCl和O2的目的是:
CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式。
(3)
【查阅资料】:
操作3的名称是,其中用到玻璃棒的作用是。
在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是和水。
17、(共7分)醋酸钙[Ca(Ac)2]是国家允许使用的补钙制剂之一。
以蛋壳为原料回收膜并制备醋酸钙的一种工艺流程如下。
⑴写出煅烧时的化学方程式。
CO2的任意排放会引发的环境问题,可以将CO2与CH4一定条件下化合生成化工产品甲醛(HCHO),则此反应中CO2与CH4的最佳质量比是。
⑵在反应I中制备石灰乳,而不是制备澄清石灰水的目的是,写出熟石灰的一种用途。
⑶在反应II中醋酸过量的目的是,写出反应II的化学方程式。
⑷膜分离时,盐酸不能过量的主要原因是。
17.(6分)某矿石由MgO、Fe2O3、CuO、SiO2组成,用它制备氢氧化镁的流程示意图如
图所示:
(1)溶液A中共含有___种阳离子。
写出得到溶液A的一个化学方程式。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀。
该
实验条件下,使金属阳离子沉淀的相关pH数据见下表。
为保证产品纯度、减少产品损失,
并便于操作,溶液B的pH可容许的范围为_________。
氢氧化物
Mg(OH)2
1.5
4.2
8.6
完全沉淀的pH
11.1
(3)溶液B中一定含有的溶质为___________________。
(4)写出溶液B中加入熟石灰,生成产品的化学方程式:
____