人教版九年级化学下册第十单元酸和碱知识点总结文档格式.doc
《人教版九年级化学下册第十单元酸和碱知识点总结文档格式.doc》由会员分享,可在线阅读,更多相关《人教版九年级化学下册第十单元酸和碱知识点总结文档格式.doc(5页珍藏版)》请在冰豆网上搜索。
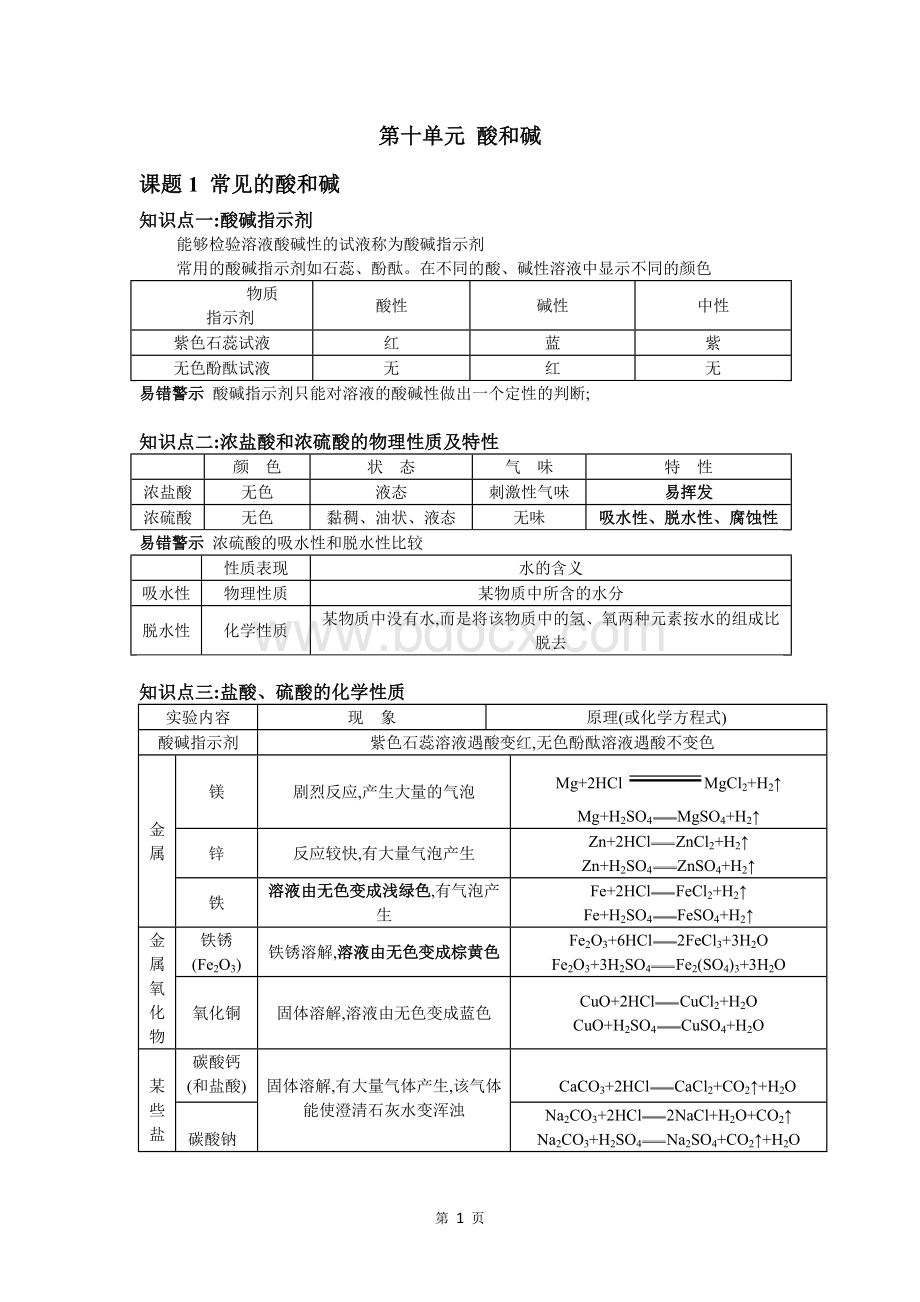
浓盐酸和浓硫酸的物理性质及特性
颜 色
状 态
气 味
特 性
浓盐酸
无色
液态
刺激性气味
易挥发
浓硫酸
黏稠、油状、液态
无味
吸水性、脱水性、腐蚀性
浓硫酸的吸水性和脱水性比较
性质表现
水的含义
吸水性
物理性质
某物质中所含的水分
脱水性
化学性质
某物质中没有水,而是将该物质中的氢、氧两种元素按水的组成比脱去
知识点三:
盐酸、硫酸的化学性质
实验内容
现 象
原理(或化学方程式)
紫色石蕊溶液遇酸变红,无色酚酞溶液遇酸不变色
金属
镁
剧烈反应,产生大量的气泡
Mg+2HCl
MgCl2+H2↑
Mg+H2SO4MgSO4+H2↑
锌
反应较快,有大量气泡产生
Zn+2HClZnCl2+H2↑
Zn+H2SO4ZnSO4+H2↑
铁
溶液由无色变成浅绿色,有气泡产生
Fe+2HClFeCl2+H2↑
Fe+H2SO4FeSO4+H2↑
氧化
物
铁锈
(Fe2O3)
铁锈溶解,溶液由无色变成棕黄色
Fe2O3+6HCl2FeCl3+3H2O
Fe2O3+3H2SO4Fe2(SO4)3+3H2O
氧化铜
固体溶解,溶液由无色变成蓝色
CuO+2HClCuCl2+H2O
CuO+H2SO4CuSO4+H2O
某些盐
碳酸钙
(和盐酸)
固体溶解,有大量气体产生,该气体能使澄清石灰水变浑浊
CaCO3+2HClCaCl2+CO2↑+H2O
碳酸钠
Na2CO3+2HCl2NaCl+H2O+CO2↑
Na2CO3+H2SO4Na2SO4+CO2↑+H2O
易错警示在与金属反应时,稀硫酸与金属反应可以生成H2;
浓硫酸有强氧化性,与金属反应不能生成H2。
知识点四:
浓硫酸的稀释
操 作
解 释
图(a)、图(b)操作错误。
液滴
四溅
水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅
图(c)操作正确。
将浓硫酸沿器壁慢慢注入水中,并不断搅拌
烧杯壁发热,
将密度大的浓硫酸缓慢注入水中,及时搅拌,产生的热得以迅速扩散,
拓展延伸
1如果不慎将浓硫酸沾到皮肤上或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
2图(b)中,双孔塞上的短玻璃导管的作用是平衡装置内外的压强,防止装置内的气压突增而发生事故。
3浓硫酸有吸水性,在实验室中常用它作干燥剂。
浓硫酸作干燥剂时,需干燥的气体一定从长管通入,从短管导出,即:
长进短出。
4选择干燥剂的原则是:
干燥剂只能吸收水分,不能与被干燥的物质发生反应。
浓硫酸常用来干燥O2、H2、CO2、CH4、CO等,不能用来干燥NH3。
知识点五:
氢氧化钠和氢氧化钙的物理性质
氢氧化钠和氢氧化钙的物理性质及特性见表7。
氢氧化钠(NaOH)
氢氧化钙[Ca(OH)2]
俗名
苛性钠、火碱、烧碱
熟石灰、消石灰
颜色、状态
白色块状固体
白色粉末状固体
溶解性
易溶于水,且放出大量的热
微溶于水
特性
易潮解;
强腐蚀性
较强腐蚀性
拓展延伸
1固体氢氧化钠曝露在空气中易吸收空气中的水分(可用作某些气体的干燥剂),表面潮湿并逐渐溶解,这种现象叫潮解。
潮解是一个物理变化过程,没有新的物质生成。
2氢氧化钙可由生石灰与水反应制得:
CaO+H2OCa(OH)2,反应放出大量的热。
生石灰常用作食品干燥剂。
知识点六:
氢氧化钠、氢氧化钙的化学性质
与指示剂作用
能使紫色石蕊溶液变蓝色,使无色酚酞溶液变红色
与某些非金属氧化物反应
CO2
CO2+2NaOHNa2CO3+H2O
CO2+Ca(OH)2CaCO3↓+H2O
SO2
SO2+2NaOHNa2SO3+H2O
SO2+Ca(OH)2CaSO3↓+H2O
SO3
SO3+2NaOHNa2SO4+H2O
SO3+Ca(OH)2CaSO4↓+H2O
与某些盐反应
FeCl3+3NaOHFe(OH)3↓+3NaCl
(常用于制不溶性碱)
CuSO4+2NaOHCu(OH)2↓+Na2SO4
Ca(OH)2+Na2CO3CaCO3↓+2NaOH
(工业制碱中用此法能制得纯度较高的NaOH)
1.能使酸碱指示剂变色的碱必须是可溶性的碱,有些难溶性的碱如Cu(OH)2(蓝色固体)、Fe(OH)3(红褐色固体)等不能使酸碱指示剂变色。
2.氢氧化钠密封保存的原因有两点:
一是易潮解,二是易吸收CO2发生变质。
拓展延伸
1
由于NaOH易溶于水,所以常用NaOH溶液吸收CO2;
常用Ca(OH)2溶液检验CO2。
2由于氢氧化钠能与CO2、SO2、HCl气体发生反应,因此不能用氢氧化钠固体干燥CO2、SO2、HCl气体,但H2、O2、CO等气体可以用氢氧化钠固体干燥。
课题2酸和碱的中和反应
酸和碱的反应实验
实验设计
1.原理:
氢氧化钠溶液与盐酸能发生反应,但没有明显的反应现象,需借助酚酞指示剂,通过观察颜色的变化,判断二者是否恰好反应。
2.仪器:
烧杯、玻璃棒、滴管。
3.药品:
NaOH溶液、稀盐酸、酚酞溶液。
4.步骤:
如图1所示,在烧杯中加入10mLNaOH溶液,滴入几滴酚酞溶液,此时烧杯中的溶液显红色,再用滴管慢慢滴入稀盐酸,不断用玻璃棒搅拌,至溶液颜色(红色)恰好变成无色为止。
图1
分析论证
在向变红的溶液中滴入盐酸时,红色逐渐变浅,说明在加入酸的过程中酸与碱发生了反应,使溶液中的碱逐渐减少,当溶液刚好变成无色时,说明碱没有了,酸与溶液中的碱恰好完全反应。
反应的化学方程式为:
NaOH+HClNaCl+H2O。
实验点拨
1.做此实验时应注意,烧杯内要先盛放氢氧化钠溶液,然后滴加酚酞试液,不要滴加石蕊试液,因为使用石蕊试液时溶液颜色变化不明显,不利于我们观察实验现象。
2.实验时用玻璃棒不断搅拌,可以使盐酸和氢氧化钠溶液充分接触,反应迅速、完全。
3.实验时用胶头滴管慢慢滴入盐酸,便于控制加入酸的量。
中和反应
盐:
由金属阳离子(或N)和酸根阴离子构成的化合物
易错警示
1.中和反应不是基本反应类型,它特指酸和碱作用生成盐和水的反应。
2.中和反应的生成物是盐和水,但生成盐和水的反应不一定是中和反应。
如Fe2O3+6HCl2FeCl3+3H2O、2NaOH+CO2Na2CO3+H2O
中和反应在实际中的应用
NaOH具有强烈的腐蚀性,在治疗胃酸过多和改良酸性土壤时不能使用NaOH。
氢氧化铝[Al(OH)3]是一种常用的中和胃酸过多的药物,但由于反应后生成的Al3+对人体有不良作用,已逐渐被其他药物取代。
溶液酸碱度表示方法——pH
1.溶液的酸碱度
溶液的酸碱度是指定量表示溶液酸碱性强弱程度的一种方法,常用pH表示。
2.pH与酸碱性的关系
pH的范围通常在0~14之间,如图所示:
(1)酸性溶液的pH<
7,
pH越小,酸性越强。
(2)中性溶液的pH=7。
(3)碱性溶液的pH>
7,pH越大,碱性越强。
1.pH表示溶液酸碱性的强弱程度,但不能确定是酸的溶液或碱的溶液。
溶液呈酸性不一定是酸的溶液,如NaHSO4是盐,但其溶液呈酸性。
溶液呈碱性不一定是碱的溶液,如Na2CO3是盐,但其溶液呈碱性。
pH是溶液中所含H+的浓度大小的一种表示方法。
pH<
7时,溶液中H+浓度越大,酸性越强,pH越小;
pH>
7时,OH-的浓度越大,则碱性越强,pH越大;
当溶液中H+浓度与OH-浓度相等时,则溶液的pH=7,呈中性。
pH的测定方法
1.测定溶液的pH最简便的方法是使用pH试纸
2.测定方法:
在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,即可得到溶液的pH。
易错警示
1.不能直接将pH试纸浸入待测的溶液中,因为将试纸直接浸入待测液会使待测液受到污染。
2.不能先用蒸馏水将pH试纸润湿,再向试纸上滴待测液。
如果将试纸先用蒸馏水润湿,则溶液就被稀释了,测得的pH可能就不准确。
3.用广泛pH试纸测溶液的pH比较粗略,读数为整数,测不出带小数的数值。
4.溶液的酸碱性可用酸碱指示剂或pH试纸测定,溶液的酸碱度不能用酸碱指示剂测定,只能用pH试纸或pH计等测定。
5检验气体的酸性或碱性,可将试纸润湿再用。
了解溶液酸碱度的实际意义
第5页