高中化学知识点铝及其化合物Word文档格式.docx
《高中化学知识点铝及其化合物Word文档格式.docx》由会员分享,可在线阅读,更多相关《高中化学知识点铝及其化合物Word文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
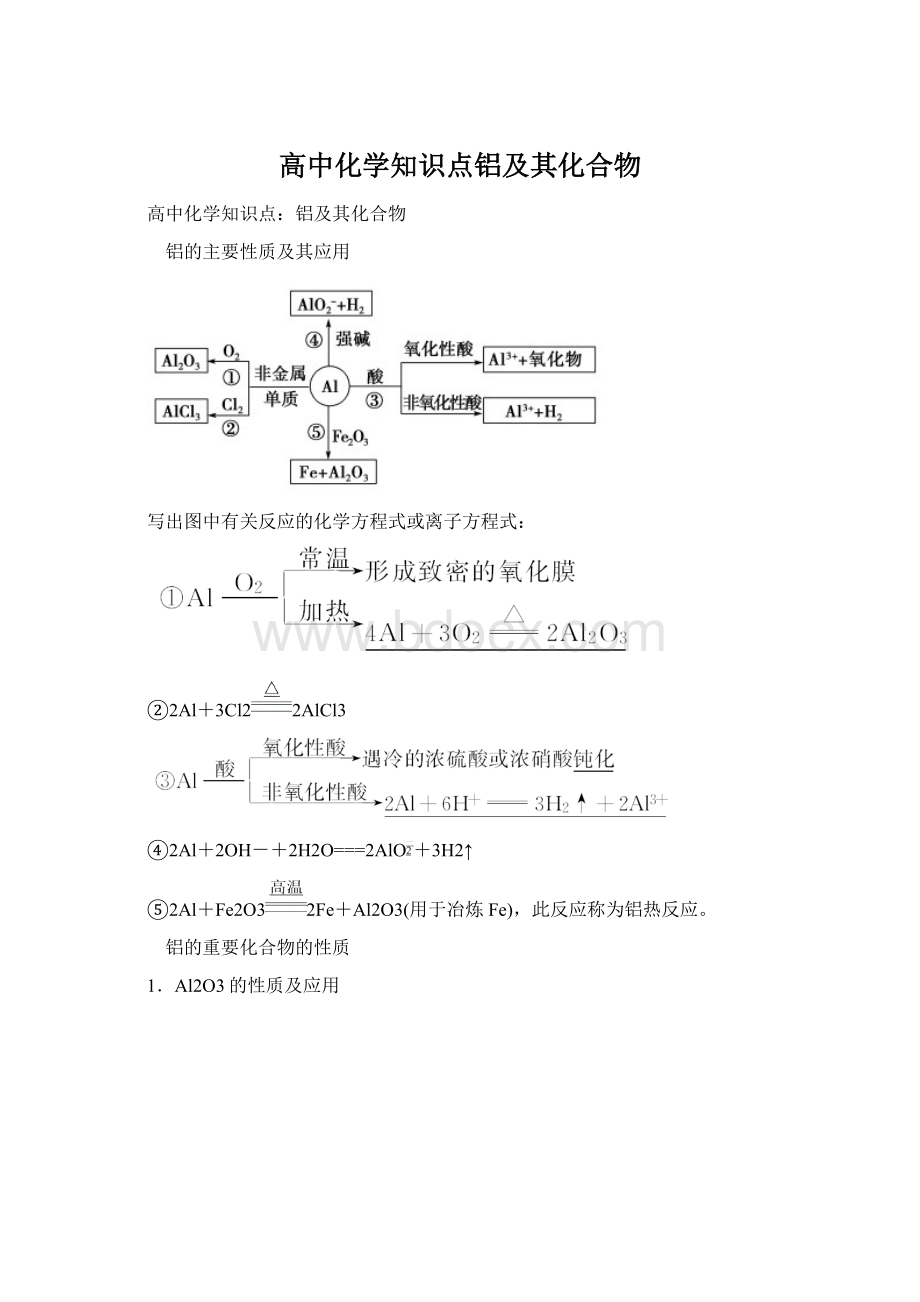
(3)应用:
净水。
净水原理为明矾电离出的Al3+在水中水解生成Al(OH)3胶体,吸附水中悬浮物而沉淀,使水净化。
其离子方程式为Al3++3H2OAl(OH)3+3H+。
1.易误诊断(正确的打“√”,错误的打“×
”)。
(1)铝制品在空气中能稳定存在是因为铝不活泼( )
(2)浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应( )
(3)铝与NaOH溶液反应中NaOH为氧化剂( )
(4)Al2O3具有两性,可溶于盐酸和NaOH溶液( )
(5)Al、Al2O3、Al(OH)3与强碱溶液反应均生成偏铝酸盐( )
(6)AlCl3溶液中加入过量氨水可生成Al(OH)3( )
【答案】
(1)×
(2)×
(3)×
(4)√ (5)√ (6)√
2.将Al2O3溶于稀盐酸,其离子方程式为____________;
向所得的溶液中加入足量氨水,其离子方程式为______,现象是________________;
再加入足量NaOH溶液,其反应的离子方程式_________。
【答案】 Al2O3+6H+===2Al3++3H2O
Al3++3NH3·
H2O===Al(OH)3↓+3NH 有白色沉淀产生 NH+OH-===NH3·
H2O、Al(OH)3+OH-===AlO+2H2O
3.用含有少量Mg的Al片制取纯净的Al(OH)3,下列操作中最恰当的组合顺序为________(填序号)。
①加盐酸溶解 ②加NaOH溶液 ③过滤 ④通入过量CO2生成Al(OH)3 ⑤加盐酸生成Al(OH)3 ⑥加过量氨水生成Al(OH)3
【答案】 ②③④③
两性化合物的2种表现
Al单质的2个特性
2Al+2OH-+2H2O===2AlO+3H2↑
2Al+Fe2O32Fe+Al2O3(铝热反应)
4组离子方程式
铝及其化合物的性质及其应用
1.铝及其化合物的转化关系
2.应用
(1)制取Al(OH)3(一般不用强碱或强酸)
H2O===Al(OH)3↓+3NH
AlO+CO2+2H2O===Al(OH)3↓+HCO
(2)离子共存问题
Al3+与OH-、AlO、CO、S2-等弱酸根阴离子因生成沉淀或发生水解相互促进的反应而不能大量共存;
AlO与H+、HCO以及弱碱阳离子Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加顺序不同,现象不同)
①AlCl3溶液中滴加NaOH溶液现象为:
先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:
开始无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分离提纯
①利用Al能溶于强碱溶液,分离Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分离Al2O3与其他金属氧化物。
③利用Al(OH)3能与强碱溶液反应,分离Al3+与其他金属阳离子。
(1)可溶性铝盐与强碱(如NaOH溶液)反应,铝元素的存在形式
(2)当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,NaOH先与H+反应,再与Mg2+、Al3+反应生成沉淀,再与NH反应,最后才溶解Al(OH)3沉淀。
一般是按生成水、沉淀、气体的顺序反应。
(2013·
大纲高考节选)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
铝土矿的主要成分是Al2O3和SiO2等。
从铝土矿中提炼Al2O3的流程如下:
回答下列问题:
(1)写出反应1的化学方程式______________________________________。
(2)滤液Ⅰ中加入CaO生成的沉淀是________,反应2的离子方程式为______________________。
(3)电解制铝的化学方程式是________________,以石墨为电极,阳极产生的混合气体的成分是________。
【解析】
(1)在加入NaOH溶液时,Al2O3和SiO2都能与NaOH反应,分别生成NaAlO2和Na2SiO3。
(2)加入CaO后,SiO与Ca2+结合生成难溶物CaSiO3;
滤液Ⅱ中主要含有AlO,通入CO2后生成沉淀Al(OH)3,煅烧后生成Al2O3。
(3)电解Al2O3制取金属铝,加入的冰晶石为助熔剂;
阳极产生的O2能与石墨电极反应生成CO2(可能含有CO)。
【答案】
(1)2NaOH+SiO2===Na2SiO3+H2O、2NaOH+Al2O3===2NaAlO2+H2O
(2)CaSiO3 2AlO+CO2+3H2O===2Al(OH)3↓+CO
(3)2Al2O3(熔融)4Al+3O2↑ O2、CO2(CO)
向偏铝酸盐溶液中通入CO2的两种反应:
一是通入少量CO2反应为2AlO+CO2+3H2O===2Al(OH)3↓+CO;
二是通入过量CO2反应为AlO+CO2+2H2O===Al(OH)3↓+HCO。
考向1 铝与酸、碱反应的相关计算
1.将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;
另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L。
则原合金样品中镁的质量为( )
A.4.8g B.6g C.9.6g D.12g
【解析】 由题意知Mg与盐酸反应生成的H2为11.2L-6.72L=4.48L,为0.2mol;
由Mg+2H+===H2+Mg2+知n(Mg)=0.2mol
m(Mg)=0.2mol×
24g/mol=4.8g。
【答案】 A
考向2 Al3+、AlO和Al(OH)3的转化
2.下列各组物质,不能按abc(“―→”表示反应一步完成)关系转化的是( )
选项
a
b
c
A
Al2O3
NaAlO2
Al(OH)3
B
AlCl3
C
Al
D
MgCl2
Mg(OH)2
MgO
【解析】 A、B、D三项中的转化关系分别为:
,,
,C项中Al不能经一步反应转化为Al(OH)3。
【答案】 C
考向3 与铝及其化合物性质有关的除杂
3.(2014·
遵义模拟)下列除杂质的方法不正确的是( )
A.镁粉中混有少量铝粉:
加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.FeCl3溶液中混有少量AlCl3:
加入过量的氨水,过滤洗涤沉淀,将沉淀再用适量盐酸溶解
C.Fe2O3中混有少量Al2O3:
加入过量NaOH溶液充分反应,过滤、洗涤、干燥
D.Al(OH)3中混有少量Mg(OH)2:
加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
【解析】 B项,加入过量氨水,Mg2+、Al3+均沉淀且均不溶于氨水,无法除去杂质。
【答案】 B
Al(OH)3沉淀图象及数量关系分析
1.可溶性铝盐溶液与NaOH溶液反应的图象及数量关系
操作
可溶性铝盐溶液中逐滴加入NaOH溶液至过量
NaOH溶液中逐滴加入可溶性铝盐溶液至过量
现象
立即产生白色沉淀→渐多→最多→渐少→消失
无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不变
图象
离子方程式
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO+2H2O
Al3++4OH-===AlO+2H2O
3AlO+Al3++6H2O===4Al(OH)3↓
2.向Mg2+与Al3+的酸性溶液中逐滴加入强碱溶液及数量分析
无明显现象→出现沉淀→沉淀最多→部分溶解→不变
H++OH-===H2O
Al3++3OH-===Al(OH)3↓
Mg2++2OH-===Mg(OH)2↓
Al(OH)3+OH-===AlO+2H2O
领悟2个数量关系
(1)沉淀Al3+所需n(OH-)与Al(OH)3溶解所需n(OH-)的比为3∶1。
(2)Al(OH)3溶解所需n(OH-)=n[Al(OH)3]。
(2014·
甘肃省河西部分普通高中高三第一次联考)有一块镁铝合金,其中镁与铝的质量比是8∶9。
加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )
【解析】 镁与铝的质量比是8∶9,则物质的量之比是1∶1,NaOH溶液至过量后Al(OH)3完全溶解,只有Mg(OH)2,B错;
等物质的量的Mg(OH)2与Al(OH)3的质量之比是58∶78,即剩余的Mg(OH)2的质量小于沉淀最大质量的1/2,排除C、D,选A。
考向1 Al(OH)3与酸或碱反应的图象分析
4.(2012·
安徽高考)已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。
向浓度均为0.1mol·
L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
【解析】 解答本题时应特别注意,难溶物的Ksp越大,在溶液中越难形成沉淀;
Al(OH)3能溶于过量的NaOH溶液。
由于Al(OH)3的Ksp比Fe(OH)3的Ksp大,故在混合液中加入NaOH溶液时,先生成Fe(OH)3沉淀,而不生成Al(OH)3沉淀,当Fe(NO3)3反应完全后再生成Al(OH)3沉淀,继续加入NaOH溶液,Al(OH)3沉淀又溶解,故只有C图像符合题意。
考向2 根据图象进行有关计算
5.现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液,得到的沉淀的量与加入NaOH溶液的体积的关系如下图所示,原溶液中Cl-、SO的物质的量之比为( )
A.1∶3 B.2∶3 C.6∶1 D.3∶1
【解析】 分析图像可知曲线下降的一段为NaOH溶解Al(OH)3的过程,而产生Al(OH)3与溶解Al(OH)3消耗的NaOH的物质的量之比为3∶1,故生成Al(OH)3沉淀需消耗0.3L的NaOH溶液,生成Mg(OH)2需消耗0.1L的NaOH,所以n(Al3+)∶n(Mg2+)=2∶1,故n(Cl-)∶n(SO)=6∶1。
Al(OH)3沉淀图象综合题的解题指导
黄冈高三第一次检测)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子
CO、SiO、AlO、Cl-
阳离子
Al3+、Fe3+、Mg2+、NH、Na+
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是________,ab段发生反应的离子是________,bc段发生反应的离子方程式为____