高考化学试题分类解析专题13 电化学综合应用Word下载.docx
《高考化学试题分类解析专题13 电化学综合应用Word下载.docx》由会员分享,可在线阅读,更多相关《高考化学试题分类解析专题13 电化学综合应用Word下载.docx(15页珍藏版)》请在冰豆网上搜索。
反应制备AlN。
在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 。
【答案】
(1)Al2O3+2OH-2AlO2-+H2O
(2)减小(3)石墨电极被阳极上产生的O2氧化
(4)4CO32–+2H2O-4e-4HCO3–+O2↑ H2
(5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
【解析】本题考查由铝土矿制备铝的工艺流程。
(1)Al2O3为两性氧化物,在NaOH溶液中会溶解生成NaAlO2。
(2)加入的NaHCO3与过量的NaOH反应,导致溶液的pH减小。
(3)电解Al2O3时阳极上生成O2,O2会氧化石墨。
(4)阳极上OH-失去电子生成O2,由H2O电离出的H+可以与CO32–反应生成HCO3–。
阴极上H2O放电生成H2。
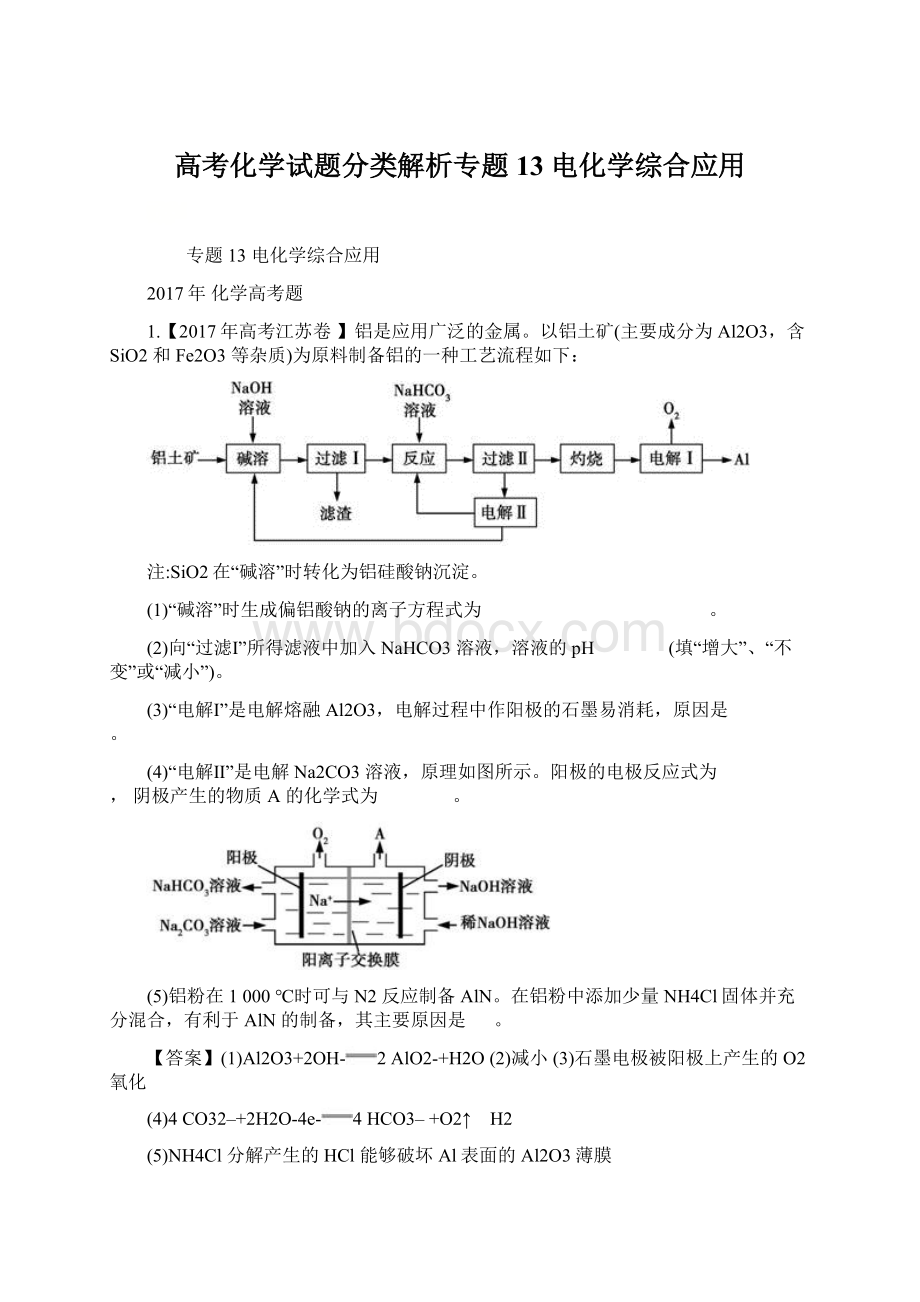
2.【2017年高考天津卷】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。
考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
回答Ⅰ和Ⅱ中的问题。
固体混合物分离利用的流程图
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 ,B→C的反应条件为 ,C→Al的制备方法称为 。
(2)该小组探究反应②发生的条件。
D与浓盐酸混合,不加热,无变化;
加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。
由此判断影响该反应有效进行的因素有(填序号) 。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1molCl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·
xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42–能从浆液中分离出来的原因是 ,分离后含铬元素的粒子是 ;
阴极室生成的物质为 (写化学式)。
(1)加热(或煅烧) 电解法
(2)ac
(3)2Cl2(g)+TiO2(s)+2C(s)TiCl4(l)+2CO(g) ΔH=-85.6kJ·
mol-1
(4)在直流电场作用下,CrO42–通过阴离子交换膜向阳极室移动,脱离浆液 CrO42–和Cr2O72– NaOH和H2
【解析】本题考查化工流程分析、热化学方程式书写及电解原理等。
(1)NaOH由Na+和OH-构成,电子式为。
根据题中图示转化关系,向溶液A中通入CO2,发生反应:
NaAlO2+2H2O+CO2Al(OH)3↓+NaHCO3,沉淀B为Al(OH)3,固体C为Al2O3,B→C的反应条件为加热或煅烧,Al2O3→Al的制备方法为电解熔融氧化铝。
(2)根据“D与浓盐酸混合,不加热,无变化;
加热有Cl2生成”知温度对反应有影响;
滴加硫酸,引入H+,又产生Cl2,说明溶液的酸度对反应有影响。
(3)该还原性气体为CO,易水解生成TiO2·
xH2O的液态化合物为TiCl4,反应的化学方程式为2Cl2(g)+TiO2(s)+2C(s)TiCl4(l)+2CO(g),结合题意知ΔH=-×
2=-85.6kJ·
mol-1。
(4)题图2中电解分离装置采用离子交换膜,根据电解时阴离子向阳极移动,则在直流电场作用下,CrO42–通过阴离子膜向阳极室移动,脱离浆液。
在阳极室,CrO42–发生可逆反应:
2CrO42–+2H+Cr2O72–+H2O,故分离后含铬元素的粒子是CrO42–、Cr2O72–。
在阴极室,H2O放电:
2H2O+2e-H2↑+2OH-,c(OH-)增大,且Na+向阴极室移动,故阴极室生成的物质为NaOH、H2。
2016-2013年化学高考题
1.【2015上海化学】
(12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。
下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为、。
(3)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出。
(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式。
(5)室温下,0.1mol/LNaClO溶液的pH0.1mol/LNa2SO3溶液的pH。
(选填“大于”、“小于”或“等于”)。
浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为。
已知:
H2SO3Ki1=1.54×
10-2Ki2=1.02×
10-7
HClOKi1=2.95×
10-8
H2CO3Ki1=4.3×
10-7Ki2=5.6×
10-11
(1)2Cl-+2H2OCl2↑+H2↑+2OH-
(2)阻止OH-进入阳极室,与Cl2发生副反应2NaOH+Cl2===NaCl+NaClO+H2O阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)ad
(4)2KClO3+H2C2O4+2H2SO4===2ClO2+2CO2+2KHSO4+2H2O
(5)大于SO32–>
CO32–>
HCO3–>
HSO3–
【解析】
(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应。
产生Cl2。
反应的离子方程式是2Cl-+2H2OCl2↑+H2↑+2OH-。
(2)图中的离子交换膜只允许阳离子通过,不能使阴离子通过,这样阻止了OH—进入阳极室,阻止Cl—进入阴极室,使在阴极区产生的NaOH纯度更高。
同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)随着电解的进行,溶质NaCl不断消耗,所以应及时补充。
精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;
水不断被消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
(4)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
则根据电子守恒及原子守恒,可得该反应的化学方程式是:
2KClO3+H2C2O4+2H2SO4===2ClO2+2CO2+2KHSO4+2H2O。
(5)NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>
c(H+),所以溶液显碱性。
形成盐的酸越弱,盐水解程度就越大。
消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。
由于H2SO3的Ki2=1.02×
10-7;
HClO的Ki1=2.95×
10-8,所以酸性:
HSO3->
HClO,因此溶液的pH:
NaClO>
Na2SO3。
由于电离程度:
H2SO3>
H2CO3>
HCO3-,浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,水解程度:
SO32–,所以离子浓度:
SO32–>
CO32–;
水解产生的离子浓度:
HCO3->
HSO3-。
但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。
所以在该溶液中SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为SO32–>
HSO3–。
【考点定位】考查电解原理的应用、氧化还原反应方程式的书写、电离平衡常数在比较离子浓度大小的应用的知识。
【名师点睛】氧化还原反应、电解原理、弱电解质的电离平衡理论、盐的水解、离子浓度大小比较是中学化学中的重要知识和理论,要掌握其反应原理、规律、方法、比较依据,再结合实际情况,进行正确的判断,得到相应的答案。
2.【2015北京理综化学】
(节选)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理:
。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。
处理至合格的方法是。
(4)①a室:
2H2O-4e-===
O2↑+4H+,H+通过阳离子膜进入b室,发生反应:
HCO3-+H+===CO2↑+H2O。
②c室的反应:
2H2O+2e-===2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至接近装置入口海水的pH
(4)海水pH>8,显碱性,需要H+中和来降低海水的碱性,a室发生阳极反应:
O2↑+4H+,c(OH—)下降,水电离平衡右移,c(H+)增大,H+从a室进入b室,发生反应:
HCO3-+H+===CO2↑+H2O。
②
c室的反应:
。
【考点定位】考查化学平衡移动、电解等。
【名师点晴】本题以CO2在海洋中的转移和归宿为素材,考查有关化学反应原理知识,难度不大,要求学生掌握弱电解质的电离、化学方程式的书写以及利用守恒观点配平方程式,第(4)问利用电化学利用理论从海水中提取CO2,有利于减少环境温室气体含量,体现了化学与环境保护、理论与实际相结合的特点。
3.【2015北京理综化学】
(15分)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-2Fe2++I2”反应中Fe3+和Fe2+的相互转化。
实验如下:
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到。
(2)iii是ii的对比试验,目的是排除有ii中造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。
用化学平衡移动原理解释原因:
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:
外加Ag+使c(I—)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01mol/LAgNO3溶液,产生的现象证实了其推测,该现象是。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是。
②与(4)实验对比,不同的操作是。
(6)实验I中,还原性