化学人教版必修2学案第2章 第2节 化学能与电能附答案Word文件下载.docx
《化学人教版必修2学案第2章 第2节 化学能与电能附答案Word文件下载.docx》由会员分享,可在线阅读,更多相关《化学人教版必修2学案第2章 第2节 化学能与电能附答案Word文件下载.docx(10页珍藏版)》请在冰豆网上搜索。
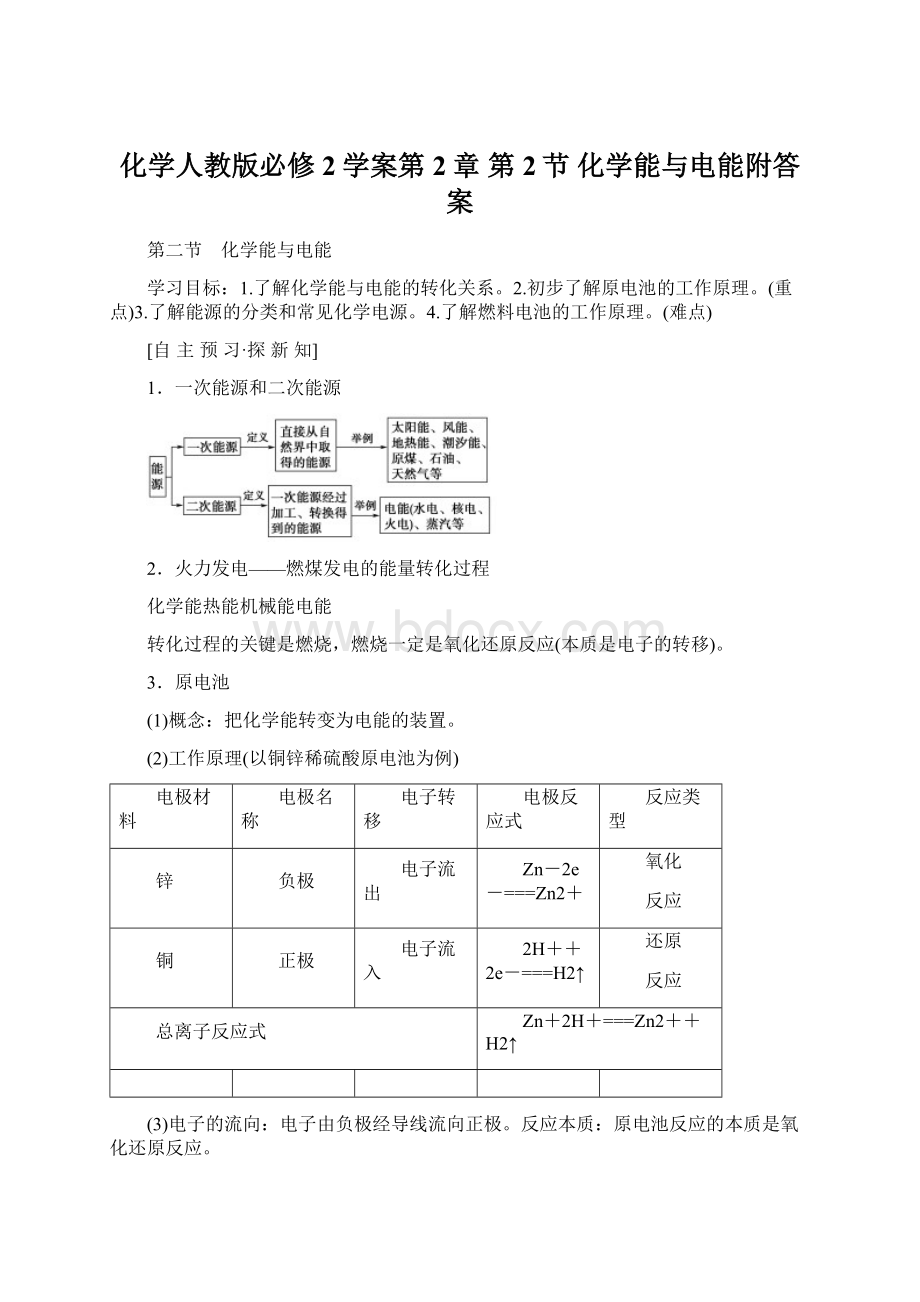
反应类型
锌
负极
电子流出
Zn-2e-===Zn2+
氧化
反应
铜
正极
电子流入
2H++2e-===H2↑
还原
总离子反应式
Zn+2H+===Zn2++H2↑
(3)电子的流向:
电子由负极经导线流向正极。
反应本质:
原电池反应的本质是氧化还原反应。
4.化学电源
(1)干电池
最早使用的化学电池是锌锰电池,它是一种一次性电池,放完电后不能再使用。
①锌锰电池
②碱性锌锰电池:
将锌锰干电池中的电解质NH4Cl换成湿的KOH,并在构造上作了改进。
(2)充电电池
充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
①铅蓄电池:
正极材料为PbO2,负极材料为Pb,电解质为稀硫酸。
②镍镉电池:
正极材料为NiO(OH),负极材料为Cd,电解质为KOH。
③碱金属中的Li是最轻的金属,活泼性极强,是制造电池的理想物质。
锂离子电池是新一代可充电的绿色电池。
(3)燃料电池
①燃料电池是通过燃料与氧化剂分别在两个电极上发生氧化还原反应,将化学能直接转化为电能的装置。
②燃料电池与火力发电相比,其燃料的利用率高、能量转化率高。
与干电池或者蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。
③以30%的KOH溶液为电解质溶液的氢氧燃料电池的电极反应如下:
负极:
2H2+4OH--4e-===4H2O(氧化反应);
正极:
O2+2H2O+4e-===4OH-(还原反应);
总反应:
2H2+O2===2H2O。
[基础自测]
1.判断对错(对的打“√”,错的打“×
”)。
(1)水能、风能和化石能源均属于一次能源( )
(2)火力发电过程经过了化学能转化为热能,热能转化为动能,动能转化为电能的过程( )
(3)原电池工作时电子从正极流出( )
(4)原电池中的阴离子移向正极( )
(5)充电电池的放电反应与充电反应互为可逆反应( )
【答案】
(1)√
(2)√ (3)×
(4)×
(5)×
2.把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上________(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来,组成一个原电池,负极为________,正极的电极反应式为_________________________。
【答案】 没有 锌片 2H++2e-===H2↑
[合作探究·
攻重难]
原电池的工作原理及应用
装置
实验现象
实验结论
①
铜片上________
铜与稀硫酸________
②
锌片上________
锌与稀硫酸________
③
铜片上________,锌片________,电流表指针________
该装置将________转化为________
【提示】 无气泡 不反应 有气泡 反应 有气泡 溶解偏转 化学能 电能
[问题思考]
(1)②③装置中反应速率谁大?
【提示】 ③反应速率大。
(2)③中SO移向什么极?
正极反应式如何写?
【提示】 SO移向负极,2H++2e-===H2↑。
(3)仿照③装置设计装置实现Zn+CuSO4===ZnSO4+Cu反应。
【提示】
(4)根据③装置可得Zn和Cu的活泼性谁强?
【提示】 Zn强。
(1)原电池的工作原理
(2)原电池原理的应用
①加快氧化还原反应的速率
原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
②比较金属活泼性强弱
一般原电池中,活泼金属作负极,发生氧化反应,不活泼金属作正极,发生还原反应。
【注意】 在判断原电池正负极时,不要只根据金属活动性的相对强弱还要考虑电解质溶液的特点。
a.Mg—Al和稀盐酸构成的原电池中,Mg作负极,Al作正极;
而若把稀盐酸换为NaOH溶液,Al作负极,Mg作正极。
b.Al—Cu和NaOH溶液构成的原电池中,Al作负极;
而若把NaOH溶液换为浓硝酸,Cu作负极。
③设计原电池
a.依据:
已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
b.示例:
以Fe+CuSO4===Cu+FeSO4为例。
[对点训练]
1.如图所示电流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C可分别为Zn、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
C [根据题意知A为负极,B为正极,C为酸液。
]
2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X、Y和稀盐酸组成原电池时,Y为原电池的负极。
X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>ZD.Y>Z>X
C [X浸入Z的硝酸盐溶液中,X的表面有Z析出,说明活泼性X>Z;
X、Y和稀盐酸组成原电池时,Y为电池的负极,说明活泼性Y>X。
故三种金属的活动性顺序为Y>X>Z。
3.某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
D [由2Fe3++Fe===3Fe2+得出负极反应式为Fe-2e-===Fe2+,正极反应式为2Fe3++2e-===2Fe2+,可知负极材料为铁,正极材料为比铁活泼性差的导体,电解质溶液中必须有Fe3+。
化学电源的原理分析
[典例导航]
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。
下列说法正确的是( )
A.Zn为电池的负极
B.正极反应式为2FeO+10H++6e-===Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH-向正极迁移
【思路点拨】 根据电极材料(K2FeO4和Zn)⇒Zn为负极,K2FeO4为正极⇒根据电解质溶液(KOH)得出两极反应,负极:
Zn-2e-+2OH-===Zn(OH)2;
2FeO+6e-+8H2O===2Fe(OH)3+10OH-。
A [Zn在反应中化合价升高为负极材料,A正确;
K2FeO4为正极材料,KOH溶液为电解质溶液,则正极电极反应方程式为2FeO+6e-+8H2O===2Fe(OH)3+10OH-,B错误;
该电池放电过程中生成OH-,电解质溶液浓度增大,C错误;
电池工作时阴离子OH-向负极迁移,D错误。
[母题变式]
(1)溶液的K+如何移动?
________。
(2)Zn极附近溶液的c(OH-)如何变化?
【答案】
(1)K+向正极移动
(2)c(OH-)减小
(1)电极反应式的书写
①原电池负极反应式的书写
a.较活泼金属作负极时,电极本身被氧化
(a)若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,如Zn-2e-===Zn2+,Cu-2e-===Cu2+。
(b)若生成的金属阳离子与电解质溶液反应,其电极反应为两反应合并后的反应。
如铅蓄电池负极反应为Pb+SO-2e-===PbSO4。
b.负极本身不反应
氢氧(酸性)燃料电池,负极反应为H2-2e-===2H+;
氢氧(碱性)燃料电池,负极反应为H2+2OH--2e-===2H2O。
②原电池正极反应式的书写
书写时总的原则是首先根据化合价变化或氧化性强弱判断得电子的微粒;
其次确定该微粒得电子后生成什么物质。
如氢氧(酸性)燃料电池,正极反应为O2+4H++4e-===2H2O
氢氧(碱性)燃料电池,正极反应为O2+2H2O+4e-===4OH-。
③书写复杂电极反应式的方法——加减法
a.写出总反应。
如Li+LiMn2O4===Li2Mn2O4。
b.写出其中容易写出的一个半反应(正极或负极)。
如Li-e-===Li+(负极)。
c.利用总反应与上述的一极反应相减,即得另一个电极的反应式,即LiMn2O4+Li++e-===Li2Mn2O4(正极)。
(2)一般电极反应式的书写思路
4.电池是人类生产和生活中的重要能量来源。
各式各样电池的发明是化学对人类的一项重大贡献。
下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池是将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
C [锌锰干电池中,碳棒作正极,电极本身不参加任何反应,故不会变细,A选项错误;
燃料电池是将化学能直接转化为电能,B选项错误;
氢氧燃料电池中的总反应为2H2+O2===2H2O,H2在负极被氧化,C选项正确;
太阳能电池的主要材料是半导体硅而不是SiO2,D选项错误。
5.据报道,锌电池可能将会取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。
其电池反应为:
2Zn+O2===2ZnO,原料为锌粒、电解质溶液和空气。
则下列叙述正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为:
Zn+2OH--2e-===ZnO+H2O
C.正极发生氧化反应
D.电解质溶液为强酸
B [Zn与O2反应的电子转移情况为,所以Zn作负极,负极发生氧化反应,Zn+2OH--2e-===ZnO+H2O。
O2是正极反应物,发生还原反应。
若电解质溶液是强酸,电池的化学反应不是:
2Zn+O2===2ZnO,而是:
Zn+2H+===Zn2++H2↑。
[当堂达标·
固双基]
1.下列叙述不正确的是( )
A.根据一次能源和二次能源的划分,氢气为二次能源
B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C.火力发电是将燃料中的化学能直接转变为电能的过程
D.在火力发电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化
C [氢气不能从自然界中直接取得,是二次能源,电能也是二次能源,且使用方便、污染最小,A、B两项正确;
以煤为原料,火力发电的能量转化过程为:
化学能热能机械能电能,C项错误,D项正确。
2.下列装置可以构成原电池的是( )
C [A项,两电极应是不同的金属;
B项,蔗糖溶液为非电解质溶液,不导电;
D项,电路不闭合。
3.在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的下列叙述不正确的是( )
A.碳棒上有气体放出,溶液pH变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
B [显然,电极a、b与电解质溶液稀H2SO4组成原电池。
因活泼性a>