物理化学问答题Word文档格式.docx
《物理化学问答题Word文档格式.docx》由会员分享,可在线阅读,更多相关《物理化学问答题Word文档格式.docx(18页珍藏版)》请在冰豆网上搜索。
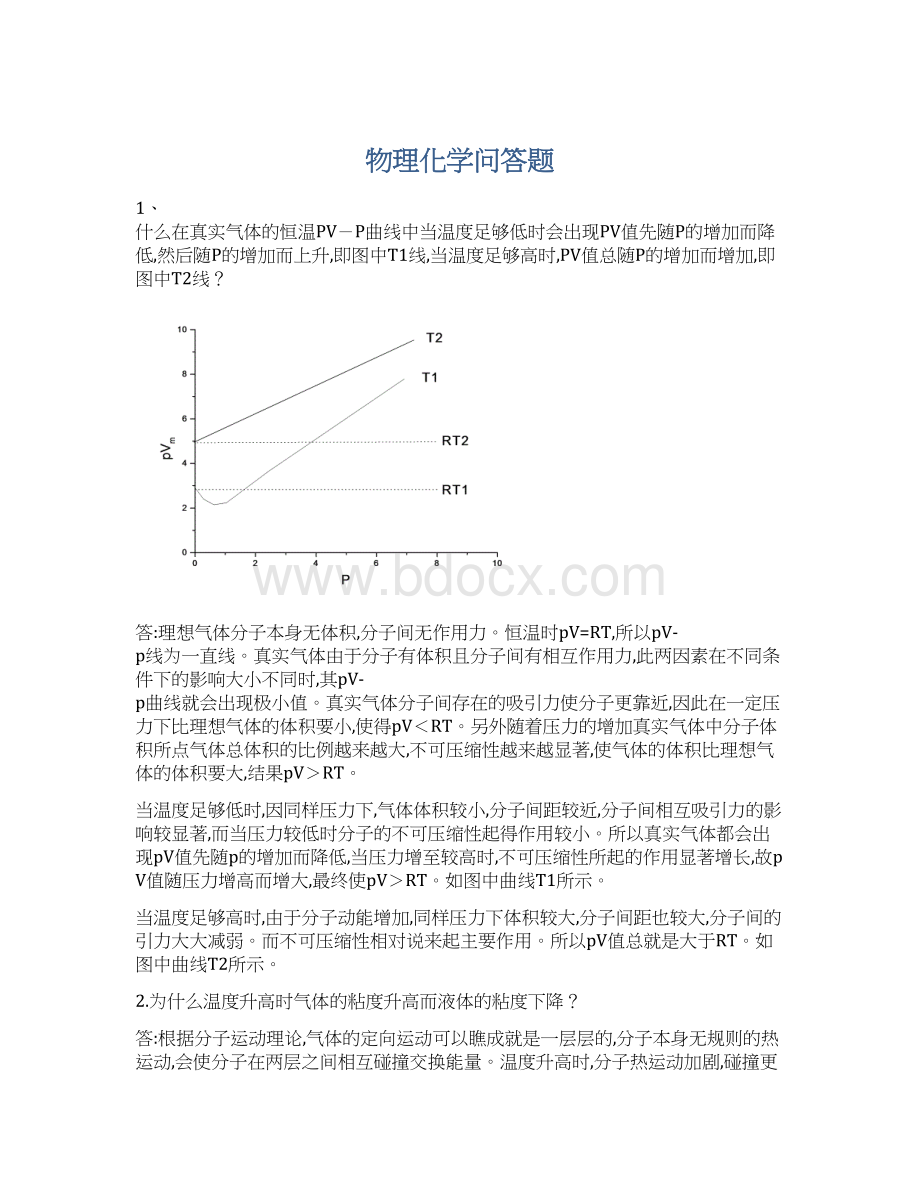
温度升高,分子间的作用力减速弱,所以粘度下降。
3.压力对气体的粘度有影响不?
压力增大时,分子间距减小,单位体积中分子数增加,但分子的平均自由程减小,两者抵消,因此压力增高,粘度不变。
4.两瓶不同种类的气体,其分子平均平动能相同,但气体的密度不同。
问它们的温度就是否相同?
压力就是否相同?
为什么?
温度相同。
因为气体的温度只取决于分子平移的动能,两种不同的气体若平移的动能相同则温度必然相同。
但两种气体的压力就是不同的,因为气体的压力与气体的密度就是成正比的。
两种气体的密度不同,当然它们的压力就不同。
1、
的物理意义就是什么?
体积V就是温度T与压力p的函数,V=f(T,P),当T,p同时发生微小变化时,所引起V的变化就是此两独立变化之与。
2.
上式表明,在恒压下改变温度而引起内能变化就是由两方面引起的,也就就是上式右端的两项。
一方面,就是由于恒容下改变温度而引起内能的变化。
此变化就是由于温度改变分子运动的动能改变,从而引起内能的变化;
另一方面,恒压下,温度改变会引起体积变化,使分子间距发生变化,引起势能变化,内能亦随之变化。
3.对理想气体来说ΔUT=0,就是否说明若水蒸气为理想气体则在25℃下将水蒸发成水蒸气时ΔUT=0?
温度不变内能则不变的说法只就是对理想气体才适用。
水蒸发变为水蒸气不符合此条件,故不成立。
实际上水蒸发过程需吸收热量q=ΔU-W,可见所吸之热一部分对外做功,一部分使内能增加。
4.说明下列有关功的计算公式的使用条件。
(1)W=-p(外)ΔV
(2)W=-nRTlnV2/V1
(3)W≈-pV=-nRT
(4)W=CvΔT
(5)
γ=Cp/Cv
由体积功计算的一般公式
可知:
(1)外压恒定过程。
则W=-p(外)ΔV。
(2)理想气体恒温可逆过程。
此时p(外)=p(内),pV=nRT,
。
(3)液体在恒温恒压p(外)=p(内)下蒸发成气体,此蒸气为理想气体,且液体体积与气体体积相比较可以略去。
(4)理想气体绝热过程。
ΔU=W=CvΔT
(5)理想气体绝热可逆过程。
代入功的积分式可得
5.从同一始态膨胀至体积相同的终态时,为什么理想气体的恒温膨胀功总大于绝热可逆膨胀功?
两过程中压力下降程度不同,理想气体恒温可逆膨胀过程中从环境吸热因此压力下降较小,而理想气体绝热可逆膨胀过程中无法从环境吸热故压力下降较大,因此理想气体恒温可逆膨胀过程所做的功总就是大于绝热可逆膨胀过程所做的功。
6.为什么膨胀功与压缩功均使用相同的公式
?
热力学中功就是以环境为基础,即以环境所留下的变化来衡量的。
膨胀时,系统抵抗外压对环境做功,环境得到功,相当于将一重物升高。
因此
当外压大于系统压力时,系统被压缩,环境对系统做功,相当于重物高度下降,环境损失掉做功的能力,本身做功的能力就减小。
因此压缩过程中,起作用的压力不就是内压而就是外压,外压决定了系统做功的大小,故其体积功的表达式仍为
7.理想气体恒温条件下反抗恒外压膨胀,则
ΔH=ΔU+Δ(pV),ΔU=0,Δ(pV)=0,故ΔH=0
ΔH=ΔU+pΔV,ΔU=0,pΔV≠0,故ΔH≠0
上面两个考虑问题的方法哪个就是正确的?
方法
(1)就是正确的。
理想气体内能只就是温度的函数,因恒温故ΔU=0,理想气体恒温下pV=nRT为常数,故Δ(pV)=0。
方法
(2)的错误在于H=U+pV中的p就是指系统的压力。
在反抗恒外压膨胀过程中,系统的压力既不就是常数亦不等于外压,因此不能认为Δ(pV)=pΔV。
8.系统经一个循环后,ΔH、ΔU、Q、W就是否皆等于零?
否。
其中H与U为状态函数,系统恢复至原态后其值复原,即ΔH=0、ΔU=0。
而热与功就是与途径有关的函数,一般不会正好抵消而复原,除非在特定条件下,例如可逆绝热膨胀后又可逆绝热压缩回至原态,或可逆恒温膨胀后又可逆恒温压缩回至原态等。
9.理想气体从p1绝热膨胀至p2时,W=ΔU,绝热膨胀时若外压为零则W=0,ΔU=0;
若外压不为零则ΔU≠0。
以上两ΔU不相等与U为状态函数的性质就是否矛盾?
不矛盾。
在本例中,从同一始态出发进行绝热膨胀,若外压不同则终态就是不可能相同的。
因此ΔU亦不会相同。
若外压不等于零时,系统的内能要消耗一部分用以转化为功,同时系统的温度要下降;
当外压等于零时,系统不对外做功,不消耗内能故ΔU=0,同时系统的温度也不变。
10.理想气体绝热膨胀时并不恒容,为什么仍可使用公式δW=CvdT?
对理想气体
故
或
因此在本例中
完全适用。
11.物系的Cv就是否有可能大于Cp?
有可能。
根据Cp与Cv的关系式:
一般情况下,
故Cp总大于Cv。
但有些系统如液体水在0℃至3、98℃其密度随温度的增加反而增大,即
此时Cv大于Cp。
12、25℃101、325Kpa下Cu-Zn电池放电做功时放热4561J。
问些反应的ΔH就是否就就是4561J?
Qp=ΔH的条件就是恒压、只做体积功。
此电池放电时做出电功,不符合上述条件,故ΔH≠Qp。
13.25℃100KPa下液态氮的标准摩尔生成热
为零不?
因为按规定只有25℃100Kpa下最稳定的单质的标准摩尔生成热才为零。
液态氮虽为单质,但在25℃100Kpa下不能稳定存在,故其
不等于零。
只有气态氮的
才为零。
14.下面的说法就是否正确,并说明理由?
系统的焓等于等压热。
系统的焓改变值ΔH等于等压热。
系统的焓等于系统的热量。
(1)不正确。
系统的焓H=U+pV。
焓具有能量的单位,但其绝对值就是不知道的,焓并没有明确的物理意义。
因此系统的焓不等于等压热。
(2)不正确。
ΔH=Qp的条件就是等压且不做其它功。
符合上述条件时ΔH才等于等压热。
(3)不正确。
焓为状态函数,状态一定焓有确定值。
而热就是与过程有关的函数。
只有ΔH(而不就是H)在等压与不做其它功的条件下才等于过程的热。
15.对于一定量的理想气体,温度一定时,内能与焓就是否一定?
就是否对所有气体来说温度一定,内能与焓都一定呢?
对理想气体来说,其内能与焓只就是温度的函数。
故温度一定内能与焓就一定。
其它气体内能与焓不仅就是温度的函数而且就是压力或体积的函数,故温度一定还要指定压力或体积内能与焓才有确定值。
16.1mol理想气体从0℃恒容加热至100℃与从0℃恒压加热至100℃,ΔU就是否相同?
Q就是否相同?
W就是否相同?
理想气体内能只就是温度的函数,故ΔU就是相同的。
因热与功就是与过程有关的,故Q与W就是不相同的。
恒容加热不对外做功,而恒压加热系统对外做体积功。
17.一个绝热气缸有一理想绝热活塞(无磨擦、无重量),其中含有理想气体,内壁绕有电阻丝,当通电时气体就慢慢膨胀。
因为就是一等压过程,Qp=ΔH,又因为就是绝热系统,Qp=0,所以ΔH=0。
这结论对不?
不对。
此过程因环境对系统做了电功,故Qp≠ΔH。
18、下列两个过程就是否都就是循环过程?
(1)由H2与O2合成水,然后再电解成H2与O2;
(2)金属铜在试管中氧化成氧化铜,然后再通入氢气,使氧化铜还原为铜(以铜为体系与以铜与氧为体系有何不同)。
(1)为循环过程。
(2)若以铜为系统,就是循环过程;
若以铜与氧为系统,则不就是循环系统。
因为若用氢气还原,氧生成水而未能还原成氧。
1、理想气体恒温膨胀做功时ΔU=0,故Q=-W,即所吸之热全部转化为功。
此与Kelvin说法有否矛盾?
Kelvin的说法就是:
“不可能从单一热源吸热使之全部转化为功而不引起其它变化”。
本例中,虽然热全部转化为功但却引起了系统的体积的变化。
2.孤立系统从始态不可逆进行到终态ΔS>0,若从同一始态可逆进行至同一终态时ΔS=0。
这一说法就是否正确?
不正确。
熵就是状态函数与变化的途径无关,故只要始态与终态一定ΔS必有定值。
孤立体系中的不可逆过程ΔS>0而可逆过程ΔS=0就是勿庸置疑的。
问题就是孤立体系的可逆过程与不可逆过程若从同一始态出发就是不可能达到相同终态。
3.有人认为理想气体向真空膨胀就是等熵过程。
因为理想气体向真空膨胀时温度不变,故dU=0;
对外不做功,故pdV=0。
所以由dU=TdS-pdV可得TdS=0。
因T≠0,故dS=0。
这样的分析正确不?
因为在dU=TdS-pdV中p指系统自身的压力,而膨胀功等于零就是指p(外)dV=0。
本例中p(外)≠p,所以pdV≠0,因此dS≠0。
上述过程不就是等熵过程。
4.理想气体向真空膨胀就是恒温过程,它的ΔS可通过设计一个在相同的始态与终态下的恒温可逆过程来计算。
理想气体向真空膨胀又就是绝热过程,那么它的ΔS就是否也可通过设计一个在相同的始态与终态下的绝热可逆过程来计算呢?
不可以。
因为理想气体向真空膨胀就是绝热不可逆过程,它与绝热可逆膨胀不可能达到同一终态。
这就是因为理想气体向真空膨胀时温度不变,而绝热可逆膨胀时对外做功消耗内能从而温度下降。
5.dU=TdS-pdV得来时假定过程就是可逆的,为什么也能用于不可逆的pVT变化过程?
因为在简单的pVT变化过程中,系统的状态只取决于两个独立的强度变量。
当系统从状态1变化至状态2时,状态函数U、S、V的改变就就是定值。
6.dG=-SdT+Vdp那么就是否101、325kPa、-5℃的水变为冰时,因dT=0、dp=0,故dG=0?
上述相变为不可逆相变,因此dG=-SdT+Vdp不适用。
7.下列求熵变的公式,哪些就是正确的,哪些就是错误的?
(1)理想气体向真空膨胀
(2)水在298K,101325Pa下蒸发ΔS=(ΔH-ΔG)/T
(3)在恒温、恒压条件下,不可逆相变
(1)正确。
因熵为状态函数,其熵变的计算与恒温可逆膨胀相同。
(2)正确。
由G=H-TS知,若恒温则ΔS=(ΔH-ΔG)/T。
(3)正确。
此式为Gibbs-Helmhotz方程。
使用条件就是恒压,化学反应或相变都可用。
8.冰在273K下转变为水,熵