公征意见采纳情况.docx
《公征意见采纳情况.docx》由会员分享,可在线阅读,更多相关《公征意见采纳情况.docx(29页珍藏版)》请在冰豆网上搜索。
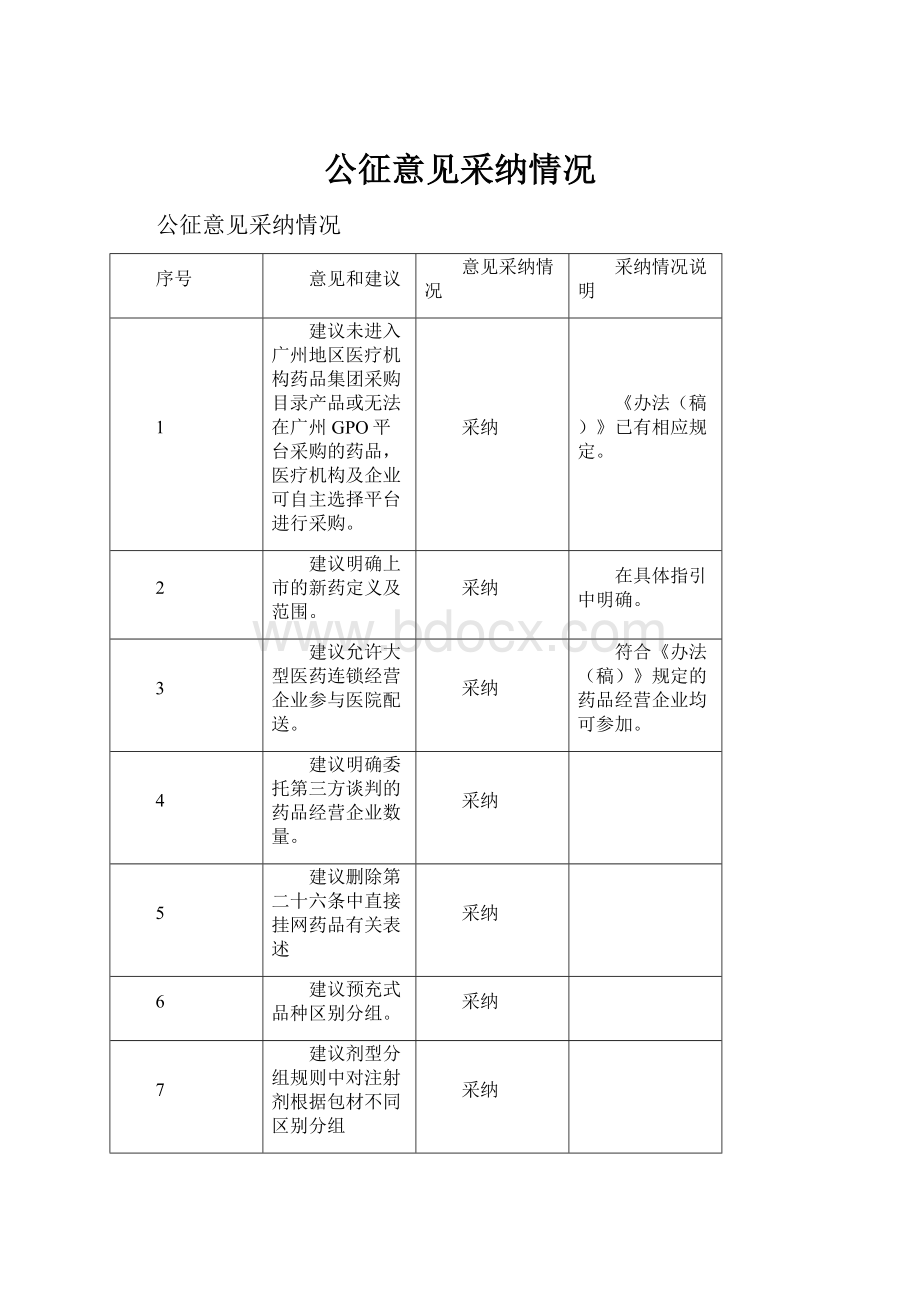
公征意见采纳情况
公征意见采纳情况
序号
意见和建议
意见采纳情况
采纳情况说明
1
建议未进入广州地区医疗机构药品集团采购目录产品或无法在广州GPO平台采购的药品,医疗机构及企业可自主选择平台进行采购。
采纳
《办法(稿)》已有相应规定。
2
建议明确上市的新药定义及范围。
采纳
在具体指引中明确。
3
建议允许大型医药连锁经营企业参与医院配送。
采纳
符合《办法(稿)》规定的药品经营企业均可参加。
4
建议明确委托第三方谈判的药品经营企业数量。
采纳
5
建议删除第二十六条中直接挂网药品有关表述
采纳
6
建议预充式品种区别分组。
采纳
7
建议剂型分组规则中对注射剂根据包材不同区别分组
采纳
8
建议将软胶囊(胶丸)、肠溶胶囊(软胶囊)与硬胶囊(胶丸)不列入同一目录剂型。
建议将肠溶微丸胶囊与目录剂型中的口服胶囊常释剂型分开分组。
采纳
9
建议剂型分组规则中增加“注射液(非调节水、电解质及酸碱平衡药)大于或等于50ml为大容量分组(同含量时不以容量再细分);小于50ml为小容量分组(同含量时不以容量再细分)”
采纳
10
建议增加“儿童用药判定依据药品法定说明书中明确仅限于适用于儿童的”。
采纳
在具体指引中明确。
11
建议溶液剂说明书上使用方法标注仅是外用才符合外用液体剂分组;如说明书上使用方法标注仅是口服用,则应该分到口服液体剂分组。
采纳
具体操作时确定。
12
建议增加“中成药其它剂型如在生产批件或药品质量标准上有明确有效成分含量(第一顺序有效成分)或有明确规格的,每一含量、规格均与同剂型最低含量、规格比,差异超过1倍的划分为不同组(按1、2、4、8、16的倍数划分,直至划分完毕)”
采纳
13
建议将医疗机构的采购量完成情况将纳入医疗机构年度考核、分级管理等级评定等相关考核办法。
采纳
《办法(稿)》已有相关规定。
14
双信封评审比例表没有说明2家以下报名产品的入围商务标的数量。
采纳
增加表述。
15
建议第二层次竞价失败的专利到期药产品,可选择接受转挂网条件或接受转集团谈判。
采纳
16
建议直接挂网采购药品不设入市价。
采纳
17
建议集团谈判品种与竞价品种配送方法保持一致。
采纳
《办法(稿)》已有相应规定。
18
建议对广州地区医疗机构药品集团采购的“分类采购成交价”、“医疗机构采购价”给予保密,不对外公示公布。
采纳
19
建议对集团采购目录、药品分类采购方式、集团谈判规则等进行公示,允许投标企业在规定时间内反馈意见
采纳
20
建议明确企业自报各省中标价或挂网价的标准
采纳
将在指引中明确。
21
建议乌鸡白凤胶囊(硬胶囊剂)和乌鸡白凤软胶囊等硬胶囊剂型与软胶囊剂型区别分组。
综合采纳
按统一规则执行。
22
建议当期采购周期内新上市的通过仿制药一致性评价药品纳入备案采购,并且不纳入备案采购金额计算范围;通过仿制药质量和疗效一致性评价品种直接挂网采购;通过质量与疗效一致性评价的仿制药随时增补进集团采购目录。
综合采纳
一、将在《办法(稿)》中增加如下内容:
当期采购周期内新通过质量和疗效一致性评价的仿制药纳入直接挂网采购范围。
二、通过仿制药质量和疗效一致性评价品种应通过适当的采购方式形成合理采购价格。
23
广州药品集团采购报名截止后新上市的产品且中标产品中无该通用名、剂型的产品允许补充报名或挂网采购、议价采购的机会。
不在集团目录的品种或者剂型,可由医疗机构自主上报新增。
综合采纳
《办法(稿)》规定,集团采购药品无法满足临床需要的,医疗机构可在广州药品集团采购平台备案后采购有关药品。
24
建议非基药非医保产品实施直接挂网、医疗机构自主议价或者参照按妇儿专科药、低价药等第三方谈判产品的采购方式等进行采购;特殊病患用药属于竞价采购范围且在我市临床使用最广泛的产品纳入第三方谈判品种;“第二类精神药品”、成本倒挂的国家基药医保甲类药品、0-3岁婴幼儿专属用药、腹膜透析液实施直接挂网采购。
综合采纳
药品分类采购方式按照国家、省有关规定确定。
25
无入市价药品品规由医疗机构直接与厂家议价采购。
综合采纳
修改为:
按规则仍无法计算入市价的药品品种直接挂网采购。
26
化学药中原材料价格大涨及原材料垄断的药品,市场供应紧张无法保障供应的,应列入短缺药品。
综合采纳
按国家、省有关规定统一执行。
27
建议对低价药按照市场销售价格实施动态挂网采购。
通用名在低价药清单、日治疗费用超出低价药范围的,可参与竞价或议价。
调整周期可界定为一年调整一次。
综合采纳
一、符合国家、省有关低价药定义的药品实施医疗机构自主谈判或第三方集团谈判;二、低价药名单将按有关规定实施动态调整机制,有关机制将在具体指引中明确。
28
建议集团采购目录建立新药、妇儿药、急救抢救药增补机制,动态调整。
综合采纳
《办法(稿)》规定,集团采购药品无法满足临床需要的,医疗机构可在广州药品集团采购平台备案后采购有关药品。
集团采购目录实行动态管理,原则上每年调整一次,并向社会公布。
29
建议药品生产企业能主动申报列入集团采购目录。
综合采纳
30
建议广州市集团采购目录应包含所有广州市医疗机构在用品种;建议把省交易平台已报名的产品都纳入;建议将3.1类及以上新药,符合临床必需、安全有效的药品以及根据临床专家意见认可的药品予以纳入采购目录。
综合采纳
按照临床常用必需、剂型规格适宜、安全有效、价格合理原则编制集团采购目录。
31
建议公示采购目录,给予反馈期。
允许医疗机构临床专家实名推荐增补目录。
综合采纳
属具体操作问题,将在目录制定时具体确定。
32
建议新进国家2017版医保目录的药品,省平台没有销售的,由医疗机构推荐进入采购目录。
建议以广东省中标挂网目录产品为基础编制目录。
建议临床必需且采购困难药品目录以《广东省基本药物临床必需且采购困难品种目录》和《广东省非基本药物临床必需且采购困难品种目录》为基础,另作增补。
建议集团目录选择适合临床用药且多家企业生产的常用规格。
建议进入国家医疗保险目录和广东省医疗保险目录产品均纳入本次集团采购目录,不按照上一年度采购金额排名制定采购目录。
建议低价药包括广东省2018年增补进入新低价药的产品。
建议广东省采购平台低价药均纳入集团采购目录。
综合采纳
属具体操作问题,将在目录制定时具体确定。
33
建议把广东省交易平台已报名的产品全部纳入,不做排他性的限制。
建议同一剂型分组中所有品规都列入采购目录。
综合采纳
按照临床常用必需、剂型规格适宜、安全有效、价格合理原则编制集团采购目录。
34
将医院的医保专家纳入专家库范围,重点提高三甲及以上医院、正高级专家的参与比例;建议集团谈判过程中,按专业属性设置不同专家组别,避免跨学科谈判
综合采纳
将在制定采购目录时综合考虑。
35
建议仅针对同生产企业已报名的品规参照药品差比价规则计算,未报名品种不纳入计算。
建议同企业同通用名不同剂型规格按照差比价计算入市价;不同企业之间不再进行剂型和规格差比。
综合采纳
未报名品种不纳入差比价计算范围。
剂型分组后,不同企业之间需进行剂型和规格差比。
36
建议将“不同剂型、不同含量规格药品的价格比较按照国家药品差比价规则计算”修改为“不同剂型、不同含量规格或包装规格药品的价格比较按照国家药品差比价规则计算”。
综合采纳
修改有关表述。
37
建议中成药口服制剂不纳入差比价范围。
建议低价药品、管制药品、中成药及国家另有规定的不纳入差比。
综合采纳
价格比较按照国家药品差比价规则计算。
38
建议在出口药的认定条件上增加出口总额限制和要求提供销售凭证材料。
同时扩大出口国家范围。
综合采纳
一、增加有关出口额度限额和销售凭证材料要求。
二、综合考虑出口药现状,不予扩大出口国家范围。
39
建议低价药品,按照日均费用标准(西药≤3元、中成药≤5元)制定入市价。
药品生产企业提供全国各省低价药的挂网最低价和最高价,作为议价参考价,通过第三方谈判或直接挂网、议价成交形成合理的采购价格。
综合采纳
为保障低价药品市场供应,按照国家、省对低价药品定义拟定入市价。
第三方集团谈判受委托企业在开展价格谈判时,根据不同药品不同情况,具体确定谈判价格。
40
建议以公开招标方式委托药品经营企业时,应设置评定标准,综合考虑企业实际能力。
综合采纳
将在制定招标条件时综合考虑。
41
低价药品谈判成交价不高于广州药品集团采购平台入市价和省药交中心药品生产企业报价。
综合采纳
调整有关内容。
42
建议妇儿专科非专利药品、急(抢)救药品、基础输液、低价药品、临床必需且采购困难目录药品,由医疗机构开展自主或联合谈判采购或直接采购。
综合采纳
《办法(稿)》规定,第三方谈判品种,医疗机构可以自主或联合谈判。
43
建议调整第三方谈判品种入市价规则。
综合采纳
调整有关内容。
44
建议将属于抗癌药增值税减免政策范围的药品纳入医保经办机构组织集团谈判。
综合采纳
按照国家、省有关部署执行。
45
建议将“竞价分组后上年度采购金额前30名且大于1000万元的独家报名药品”调整为“竞价分组后上年度采购金额前30名且大于1500万元的独家报名药品”或将分组后年采购额超过1000万的独家品种纳入谈判。
综合采纳
将适当扩大集团谈判品种数量。
46
建议明确医保经办机构组织的集团谈判各药品品种成交数量。
综合采纳
将在制定谈判规则时明确。
47
建议在剂型分组规则中删除“注射用乳剂”,在“注射用粉针”包含的剂型中增加“注射用干乳剂”
综合采纳
在“注射用粉针”包含的剂型中增加“注射用干乳剂”。
48
建议在剂型分组规则中增加“临床适应症完全不同的为不同组”;建议增加根据临床适应症不同区分为不同分组。
综合采纳
增加“临床适应症完全不同的为不同组”。
49
建议胰岛素按通用名分组招标。
综合采纳
具体操作问题,在制定采购目录时综合考虑。
50
建议脂微球注射剂、脂质乳注射剂、环糊精包裹注射剂等靶向制剂为不同分组。
综合采纳
增加:
脂微球注射剂、脂微球干乳剂、脂质体注射剂、环糊精包裹注射剂区分为不同分组。
51
建议同通用名、同剂型品种通过质量和疗效一致性评价的生产企业达到3家及以上的,广州GPO都不再采购未通过一致性评价的品种。
综合采纳
修改为:
同通用名、剂型、规格药品通过质量和疗效一致性评价的药品生产企业达到3家及以上的,不再接受未通过质量和疗效一致性评价品种报名。
52
建议差比价时充分考虑日均治疗费用。
建议同组竞价按报价剂型差比最低者中标。
综合采纳
按照国家差比价规则执行。
53
建议取消或者修改竞价及挂网调整系数表。
综合采纳
适当调整系数表。
54
建议经济技术标各指标得分均相同的品种,均进入商务标。
综合采纳
55
建议同一质量层次、同通用名、不同规格及不同厂家之间执行差比价规则。
综合采纳
将在制定差比价规则时综合考虑。
56
建议对按照第二层次药品交易规则转集团谈判的通过一致性评价的仿制药合理设置谈判控制价。
综合采纳
将在制定谈判规则时综合考虑。
57
建议通过一致性评价的品种若为低价药,则按国家和广东省低价药政策交易;若为非低价药品种,则不设定入市价,由医疗机构与生产企业议价成交。
同时通过一致性评价的品种不应该与未通过一致性评价的品种价格进行差比。
综合采纳
一、符合低价药定义标准的药品,按《办法(稿)》确定的低价药交易规则执行;二、按统一规则确定入市价;三、同一质量层次内药品按通用名、剂型分组规则、规格同组竞价,价格比较按照国家药品差比价规则计算。
58
建议调整医保经办机构组织谈判品种和竞价采购药品入市价确定规则
综合采纳
59
建议明确广州市GPO产品成交价格公开范围。
综合采纳
具体操作问题,在指引中明确。
60
建议第十五条部门内容修改为:
近两年未被列入国家、广东省、广州市药品监管部门药品违法违规企业黑名单。
未在国家企业信用信息公示系统有两条以上(含两条)行政处罚信息。
综合采纳
修改有关表述。
61
建议公示谈判相关流程、细则。
综合采纳
将在后续工作中相继印发。
62
建议已通过广东省药品交易中心报名审核的品种数据与广州地区医疗机构集中采购平台数据库对接。
综合采纳
将在相关业务环节与省平台互联互通。
63
建议禁止医疗机构在广州药品集团采购基础上再二次议价。
综合采纳
将在协议中明确。
64
建议取消对毒麻精放类药品入市价格限制
综合采纳
按国家有关规定执行。
65
建议调整产品报名时有关药品检验材料要求。
综合采纳
修改有关表述。
66
建议将“中国质量奖药品(含提名奖)”列入第一质量层次。
建议调整中国质量奖(含提名奖)企业赋分药品范围和分值。
综合采纳
将获最近一届“中国质量奖药品(含提名奖)”企业部分药品纳入集团谈判范围,并取消双信封竞价时的经济技术标准赋分。
67
建议调整国家重大新药创制专项药品有关认定条件。
综合采纳
调整有关内容。
68
建议将一个采购周期内备案采购金额不得超过该医疗机构本采购周期采购总金额的5%调整为不得超过该医疗机构本采购周期采购总金额的10%
不予采纳
5%的额度是根据医疗机构和专家意见确定。
69
建议第二层次专利到期的独家产品以全国最低价转挂网采购。
不予采纳
无充分市场竞争的药品品种需要引入价格谈判,引导采购价格合理形成。
70
建议不实施由医保经办机构组织开展集团谈判及相关内容。
不予采纳
医保部门开展价格谈判,能更好引导药品形成合理采购价格。
71
建议列入重点监控范围的药品不实施集团谈判。
不予采纳
重点监控范围药品应加强形成合理采购价格。
72
建议在“兼顾不同级别不同性质医疗机构、不同人群临床用药需求”后增加“以药品说明书为依据”表述
不予采纳
本条主要表述集团采购制定总体原则,不具体讲述细则。
73
建议将汉防己甲素片、乙酰半胱氨酸泡腾片纳入广州地区医疗机构药品集团采购目录
不予采纳
不属于本次征求意见范围的意见和建议。
74
建议第九条第(三)点增加优先使用价格低廉,临床疗效确切产品。
不予采纳
属于医疗机构临床选择用药问题。
75
建议以生产企业品种报名、分组结果为目录或以每个品种都含3剂型、每剂型含2个规格制定目录;建议将同一通用名、同一剂型分组中所有包含的剂型纳入采购目录。
不予采纳
按照临床常用必需、剂型规格适宜、安全有效、价格合理原则编制集团采购目录。
76
建议采集广州市公立医疗机构截止到2018年12月31日的销售记录作为采购目录制定基础数据。
不予采纳
采购目录需在开展集团采购前确定,无法采集到2018年底的数据。
制定采购目录时将充分考虑时间差的问题。
77
建议将“去甲硫氨酸”专利纳入层次划分中的第二层次
不予采纳
《办法(稿)》已明确有关专利规则。
78
建议将乌司他丁从广州市GPO集团谈判采购目录转归入竞价组分组。
建议将双唑泰阴道软胶囊的软胶囊剂型从广州地区药品集团采购目录剂型分组规则中的阴道栓目录中拆分。
不予采纳
按统一规则执行。
79
建议由医保经办机构建立的药学专家库专家明确急(抢)救药品、基础输液目录药品等范围。
妇儿专科非专利用药目录建议以产品说明书为依据,企业申报。
建议把中/长链脂肪乳注射液列入广州GPO的基础输液目录,选择经济技术标得分排名前3名的产品实行集中挂网,由医院直接采购。
不予采纳
按照国家、省有关目录确定。
80
建议在不同酸根、盐基的分组中明确基本药物和非基本药物。
基本药物不进行剂型、规格合并。
不予采纳
同一质量层次内药品按通用名、剂型分组规则、规格同组竞价,不按基本药物和非基本药物区别分组。
81
建议低价药按国家低价药目录确定,非国家低价药目录内的,只许进入,不许退出。
不予采纳
低价药名单将按有关规定实施动态调整机制,有关机制将在具体指引中明确。
82
在采集销售数据时,医院属下零售药房的销售数据,等同医院销售数据一样被认可。
不予采纳
广州地区药品集团采购实施范围暂只覆盖医疗机构。
83
建议医保经办机构以公开招标方式委托不少于5家或10家药品经营企业对第三方谈判品种进行集团谈判采购与配送,并与受委托企业签订协议。
不予采纳
考虑到第三方谈判药品品种范围、市场供应情况以及本项政策的试点性质,谈判组织不宜大幅扩大。
84
建议取消第三方谈判,由医疗机构自主或联合谈判。
不予采纳
《办法(稿)》已规定,第三方谈判品种,医疗机构可以自主或联合谈判。
85
建议妇儿专科非专利药品、急抢救药品、基础输液、低价药品、临床必需且采购困难目录药品,按照入市价直接挂网。
不予采纳
妇儿专科非专利药品、急抢救药品、基础输液、低价药品、临床必需且采购困难目录药品也应通过价格谈判形成合理的采购价格。
86
建议由医疗机构自主选择1家第三方谈判药品经营企业,打包进行集团谈判、采购、储存与配送;低价药中标入围生产企业不超过3家;低价药品由第三方谈判品种中标药品经营企业与药品生产企业进行谈判和配送。
不予采纳
属具体操作问题,将在制定第三方谈判规则时具体确定。
87
建议不由药品经营企业开展第三方集团谈判采购
不予采纳
在较科学、合理的规则下委托药品经营企业开展第三方谈判品种集团谈判,既能充分保障这些药品的临床稳定供应,又能形成合理采购价格。
88
“
(一)上年度采购金额前20名的药品(按通用名计算)”与“
(二)竞价分组后上年度采购金额前30名且大于1000万元的独家报名药品”对部分品种可能存在反复计算,建议取消“
(一)上年度采购金额前20名的药品(按通用名计算)”条款。
不予采纳
重复的药品品种可不重复谈判。
89
建议将目录剂型中的“口服片剂常释剂型”和“口服胶囊常释剂型”合并为“口服常释剂型”一组
不予采纳
剂型分组规则按照保障临床需要、形成合理竞争等原则制定。
90
建议复方制剂成分含量不同的分为不同竞价组。
建议将不同助溶剂的注射剂分为不同组。
建议“注射用水针”和“注射用粉针”合并为“注射剂”一组。
建议将凝胶剂与混悬剂划分为不同分组。
建议将缓释片与缓释胶囊划为不同分组。
建议将剂型分组中的阴道栓组拆分为三组,阴道片:
阴道片、阴道泡腾片;阴道栓:
阴道栓;阴道胶囊:
阴道胶囊、阴道软胶囊。
不予采纳
剂型分组规则按照保障临床需要、形成合理竞争等原则制定。
91
建议遴选用量最大、医院覆盖面最广、采购金额高、价格合理并占据主导地位的一种剂型单独分组;并对符合上述条件的上年度采购金额大于2000万的独家报名产品实行集团谈判。
不予采纳
按统一规则执行。
92
建议将“……同一层次内药品按通用名、剂型分組则、规格同组竞价”修改为“同一层次内同一通用名、剂型分组规则及规格的药品同组竞价”
不予采纳
部分药品的规格也可能需要合并。
93
建议抗生素类复方制剂中主要成分相同,通用名不同的,区别分组。
不予采纳
按统一规则执行。
94
建议删除第六十一条第(八)点“不实行药品线上交易的”表述
不予采纳
对线下交易应加强监管。
95
建议调整合同追加量的限额。
医疗机构未报量的品种,可与中标生产企业商定采购量。
不予采纳
《政府采购法》规定,追加量不得超过原合同量的10%。
医疗机构未按要求报量的,可备案采购。
96
建议第二层次出口药、通过一致性评价仿制药和(或)新注册分类3类、4类药品也参照降幅式成交考核。
不予采纳
第二层次出口药、通过一致性评价仿制药和(或)新注册分类3类、4类药品通过直接竞价产生采购价格。
97
建议经济技术标指标增加有效期、适应症、储藏条件等。
不予采纳
此类指标难以体现质量差异性。
98
建议下一周期开始,采用全国最低省级中标价进行价格联动。
不予采纳
按统一规则执行。
99
建议参比制剂与通过仿制药一致性评价药品区分质量层次。
建议通过一致性评价的仿制药直接挂网,不再参与竞价流程。
建议专利到期药和参比制剂不与GMP产品进行挂网调整系数进行比较降价。
不予采纳
通过质量和疗效一致性评价的药品应与参比制剂在同一质量层次。
通过一致性评价仿制药、参比制剂都需要通过适当竞争形成合理采购价格。
100
建议适当增加“特殊病患群体用药”在“双信封”评审中的成交品种数量。
不予采纳
按统一规则执行。
101
建议新增多包装产品可以随时报名并使用原包装单片中标价格。
不予采纳
按统一规则执行。
102
建议不实施过期专利药品比价交易,若专利到期药品未成交,允许医疗机构进行议价限量采购,但不超出一致性评价仿制药采购金额的20%。
建议专利到期药与落标的通过一致性评价药品执行相同转挂网采购条件。
建议新注册分类3和4类药与专利过期药进行直接比价。
建议取消未成交过期专利药转挂网采购条件。
不予采纳
规则设置应充分考虑患者和临床用药需要,应积极促进专利到期药、通过一致性评价药形成合理采购价格和鼓励仿制药开展一致性评价。
103
建议不同剂型不进行差比。
不予采纳
同一质量层次内药品按通用名、剂型分组规则、规格同组竞价,价格比较按照国家药品差比价规则计算。
104
建议药品质量标准起草单位对应药品由“以国家药品监督管理部门颁发的药品质量标准判定”修改为“以省级药品监督管理部门颁发的药品质量标准判定。
”
不予采纳
与其他经济技术标指标保持层级一致。
105
“双信封”评审中标规则建议以“经济技术分+商务评分”综合分最高者中标。
建议将商务标评审中标结果改为2个中标1个备选。
不予采纳
按照国家有关规定,双信封招标按照商务标书报价由低到高选择中标企业和候选中标企业。
106
建议出口、仿制药及新注册分类3、4类产品与专利过期药竞价失败后,不能转谈判或挂网采购。
不予采纳
根据国家有关规定,应积极鼓励医疗机构采购通过一致性评价的和质优价平的仿制药。
107
建议经济技术标评审时的配送时限计算以工作日计算。
不予采纳
与配送时限要求一致。
108
建议对于专利到期药,新采购周期按其他采购途径仍需转集团谈判药品的,按照广州药品集团采购平台上一采购周期成交价确定新成交价。
不予采纳
按统一规则执行。
109
建议同品种药品,出口药、仿制药(通过质量和疗效一致性评价)、及新注册分类3类、4类药品,合计达到3家及以上的,不再选用未通过质量和疗效一致性评价的品种。
不予采纳
只有通过质量和疗效一致性评价药品生产企业数量达到3家及以上的,才不选用其他未通过的。
110
建议考虑通过一致性评价企业超过3家以上,不再选用未通过质量和疗效一致性评价药品品种时市场供应、适应质量层次和药品范围问题。
不予采纳
一、按照国家有关规定执行。
二、同通用名、剂型、规格药品通过质量和疗效一致性评价的药品生产企业达到3家及以上的,不再接受未通过质量和疗效一致性评价品种报名。
111
建议按不同质量层次对药品中标价格进行调平处理。
不予采纳
不同质量层次不进行价格比较。
112
建议对竞价产品增加“报价不能超过同组入市价均值”的要求。
不予采纳
竞价品种采购价格由市场竞争形成。
113
建议为更好体现公平竞争的采购模式,医保品种与非医保品种应该分为不同竞价组
不予采纳
按照通用名、剂型分组、规则同组竞价。
114
建议将“95%×同组出口药、仿制药或新注册分