备战高考化学 铜及其化合物推断题 培优 易错 难题练习含答案及答案解析.docx
《备战高考化学 铜及其化合物推断题 培优 易错 难题练习含答案及答案解析.docx》由会员分享,可在线阅读,更多相关《备战高考化学 铜及其化合物推断题 培优 易错 难题练习含答案及答案解析.docx(21页珍藏版)》请在冰豆网上搜索。
备战高考化学铜及其化合物推断题培优易错难题练习含答案及答案解析
2020-2021备战高考化学铜及其化合物推断题培优易错难题练习(含答案)及答案解析
一、铜及其化合物
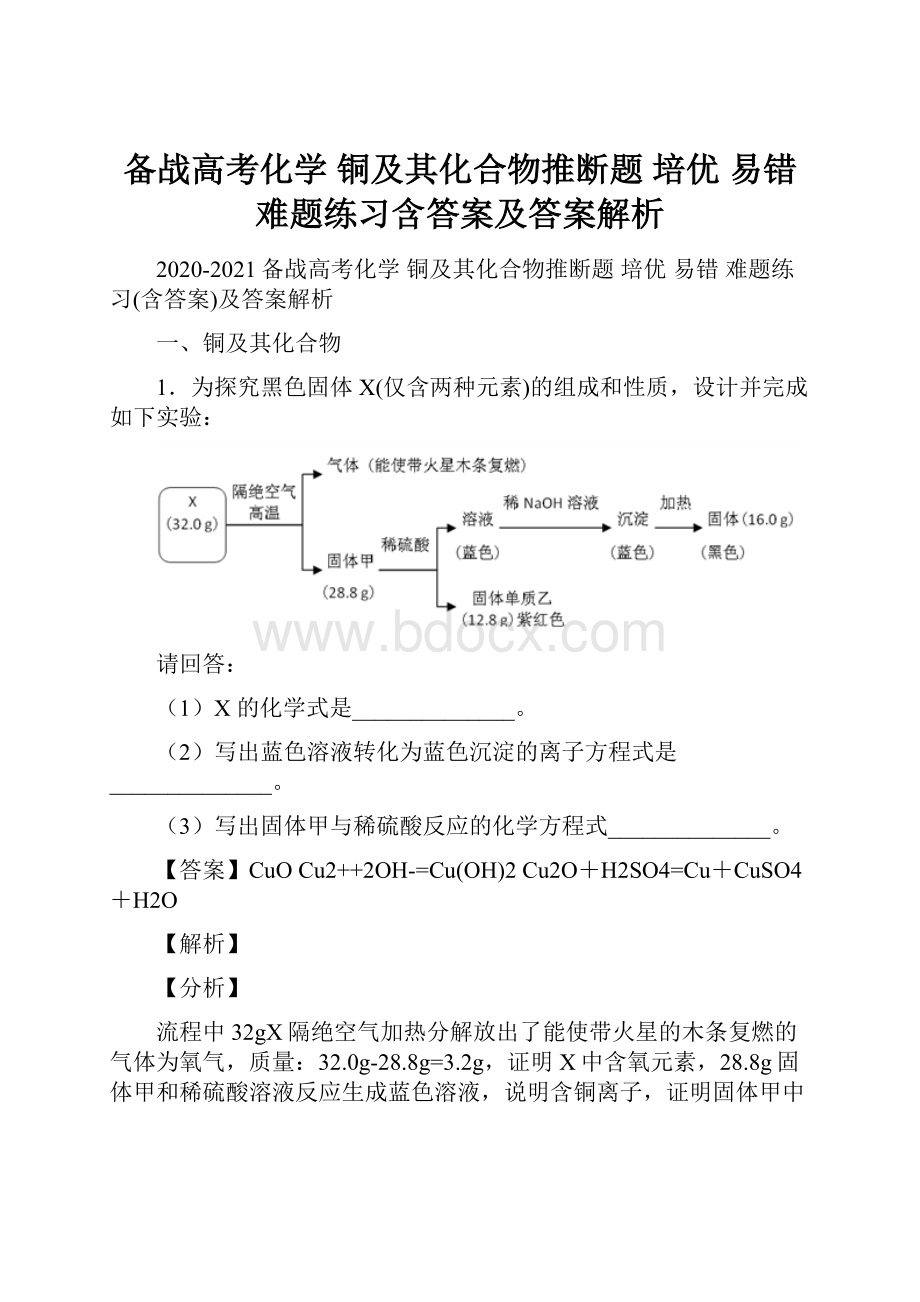
1.为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是______________。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________。
(3)写出固体甲与稀硫酸反应的化学方程式______________。
【答案】CuOCu2++2OH-=Cu(OH)2Cu2O+H2SO4=Cu+CuSO4+H2O
【解析】
【分析】
流程中32gX隔绝空气加热分解放出了能使带火星的木条复燃的气体为氧气,质量:
32.0g-28.8g=3.2g,证明X中含氧元素,28.8g固体甲和稀硫酸溶液反应生成蓝色溶液,说明含铜离子,证明固体甲中含铜元素,即X中含铜元素,铜元素和氧元素形成的黑色固体为CuO,X为氧化铜,n(CuO)=
=0.4mol,结合质量守恒得到n(O2)=
=0.1mol,氧元素守恒得到甲中n(Cu):
n(O)=0.4mol:
(0.4mol-0.1mol×2)=2:
1,固体甲化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜,加入氢氧化钠溶液生成氢氧化铜沉淀,加热分解得到16.0g氧化铜。
【详解】
(1)分析可知X为CuO,故答案为CuO;
(2)蓝色溶液为硫酸铜溶液,转化为蓝色沉淀氢氧化铜的离子方程式为Cu2++2OH-=Cu(OH)2,故答案为Cu2++2OH-=Cu(OH)2;
(3)固体甲为Cu2O,氧化亚铜和稀硫酸溶液发生歧化反应生成铜、二价铜离子和水,反应的化学方程式为:
Cu2O+H2SO4=Cu+CuSO4+H2O,故答案为Cu2O+H2SO4=Cu+CuSO4+H2O。
2.已知两种常见金属A(地壳中含量第二的金属)、B(红色金属)分别与两种酸X、Y发生反应,其转化关系如图所示,其中D为红棕色气体。
回答以下问题:
(1)反应③的离子反应方程式为___;
(2)6.4gB与过量X溶液(8mol/L、60mL)充分反应后,生成的还原产物有C、D,反应后溶液中所含X为nmol,此时溶液中所含X的阴离子的物质的量为___mol。
(3)常温下A与Y的稀溶液能发生反应生成盐W,关于固体W的转化关系如图所示(无关物质已略去)。
其中N是红棕色的化合物。
①M由两种化合物组成,其中含有F;将M通入BaCl2溶液,实验现象是___。
②若经反应I得到16g固体N,产生的气体M恰好被0.3L1mol·L-1NaOH溶液完全吸收得溶液1,则反应Ⅳ中发生反应的离子方程式是____。
【答案】SO2+NO2+H2O=2H++SO42-+NOn+0.2产生白色沉淀2Fe3++HSO3-+H2O=2Fe2++SO42-+3H+
【解析】
【分析】
常见金属A为地壳中含量第二的金属,确定为Fe、B为红色金属确定为Cu,根据D为红棕色气体,确定D为NO2,C为NO,X为HNO3;B为Cu,铜可以与浓硫酸反应生成硫酸铜,二氧化硫和水;生成的二氧化硫有还原性,可以与NO2反应生成硫酸和硝酸,确定B为Cu,Y为硫酸,F为SO2,G为CuSO4;(3)A(Fe)与Y(硫酸)的稀溶液反应生成硫酸亚铁和氢气,确定W为FeSO4,2FeSO4
Fe2O3+SO2↑+SO3↑,气体M为SO2和SO3的混合物,M与NaOH反应生成盐和水,N为Fe2O3,与稀硫酸反应生成硫酸铁和水。
Fe3+具有氧化性和+4价硫元素具有还原性,可以发生氧化还原反应生成硫酸亚铁,据此分析。
【详解】
(1)根据以上分析可知,反应③为SO2、NO2和水的反应,根据得失电子数相等和原子守恒配平,得离子反应方程式为SO2+NO2+H2O=2H++SO42-+NO;
答案:
SO2+NO2+H2O=2H++SO42-+NO
(2)6.4gB与过量X溶液(HNO3)充分反应后,生成的还原产物有NO2、NO,反应后溶液中所含HNO3为nmol,溶液中所含N
的物质的量为:
n(N
)=n(Cu2+)×2+n=
+n=n+0.2mol;
答案:
n+0.2
(3)①将M(SO2、SO3)通入BaCl2溶液,发生反应SO3+H2O+BaCl2=BaSO4↓+2HCl,有白色沉淀生成;
答案:
产生白色沉淀
②反应Ⅰ:
2FeSO4
Fe2O3+SO2↑+SO3↑;反应ⅢFe2O3+3H2SO4=Fe2(SO4)3+3H2O;
根据固体M(Fe2O3)的量计算出SO2和SO3的物质的量。
2FeSO4
Fe2O3+SO2↑+SO3↑
160g1mol1mol
1.6g0.01mol0.01mol
反应ⅡSO3+2NaOH=Na2SO4+H2O
1mol2mol1mol
0.01mol0.02mol0.01mol
SO2+NaOH=NaHSO3
1mol1mol1mol
0.01mol0.01mol0.01mol
溶液1为Na2SO4和NaHSO3的混合物;
反应Ⅳ:
硫酸铁具有氧化性,亚硫酸氢钠具有还原性,根据得失电子数相等和原子守恒得出离子方程式2Fe3++HSO3-+H2O=2Fe2++SO42-+3H+;
答案:
2Fe3++HSO3-+H2O=2Fe2++SO42-+3H+
3.有关物质的转化关系如下图所示(部分物质与条件已略去)。
已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65g•mol-1,C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱。
(1)B的化学式为__________________。
(2)K的电子式为__________________。
(3)写出反应①的化学方程式:
_________________________________________。
(4)写出反应②的离子方程式:
____________________________________。
【答案】NaN3
CuO+2NaN3
Cu+Na2O+3N23Cu+8H++2NO3- =3Cu2-+2NO↑+4H2O
【解析】C是空气中含量最多的单质,则C是N2;D是白色粉末且焰色反应呈黄色,则D中含有Na元素;E是一种紫红色金属,则E是Cu;结合转化关系图,结合其他已知条件可得:
A是CuO、B是叠氮化钠、D是Na2O、E是Cu、G是NO、H是NO2、I是H2O、J是HNO3、K是NaOH、L是Cu(NO3)2。
(1)叠氮化钠的化学式为NaN3;
(2)NaOH的电子式为
;
(3)反应①为叠氮化钠和CuO受撞击反应生成N2、Na2O和Cu,故化学方程式为:
CuO+2NaN3
Cu+Na2O+3N2;
(4)反应②为Cu和稀硝酸的反应,离子方程式为:
3Cu+8H++2NO3-=3Cu2-+2NO↑+4H2O。
点睛:
无机框图推断题,既能检查学生元素化合物基础知识的掌握情况,又能检查学生灵活应用知识的能力,更能考查学生的逻辑推理能力,难度较大。
解答无机框图推断题,应认真分析题干,找出明显条件和隐蔽条件。
通过已知条件找出突破口,正推法、逆推法、假设法、猜测法等得出结论。
4.为探究黄色固体A(仅含三种元素)的组成和性质,设计并完成如下实验:
已知:
a.气体C能使品红溶液褪色
b.溶液D遇KSCN溶液显血红色
c.溶液D中加入过量铁粉,充分反应后铁粉质量减少32g
请回答:
(1)A的化学式是_________。
(2)固体A与O2反应生成B和C的化学方程式_________。
(3)少量Mg在气体C中完全燃烧,产生的固体产物中含有单质、氧化物,有人认为还可能存在一种含氧酸盐,请推测该盐的成分,并设计实验方案验证_________。
【答案】FeCuS24FeCuS2+13O2
2Fe2O3+4CuO+8SO2MgSO3,取少量固体加盐酸溶液,有气体产生,证明存在MgSO3
【解析】
36.8g固体A与足量氧气加热条件下反应生成32g固体B,和气体C,气体C能使品红溶液褪色,说明C为二氧化硫,说明A中含有S元素;固体B被盐酸溶解生成溶液D,溶液D遇KSCN溶液显血红色,D中含有Fe3+,则B中含有氧化铁;溶液D中加入过量铁粉,生成固体E和氢气,其中含有红色固体,说明溶液D中还含有Cu2+、H+,因此固体B中还含有氧化铜,则A中含有Cu、Fe和S三种元素;
(1)假设溶液D中含有的Fe3+和Cu2+、H+的物质的量分别为x、y、z。
生成的氢气为0.5mol,则z=1mol。
根据固体B的质量为32g,有①
×160g/mol+y×80g/mol=32g,溶液D中加入过量铁粉,充分反应后铁粉质量减少32g,有②
×56g/mol+
×56g/mol-y×8g/mol=32g,根据①②解得,x=0.2mol,y=0.2mol,根据固体A的质量为36.8g,则S元素的物质的量为
=0.4mol,则A的化学式为FeCuS2,故答案为FeCuS2;
(2)固体A与O2反应生成B和C的化学方程式为4FeCuS2+13O2
2Fe2O3+4CuO+8SO2,故答案为4FeCuS2+13O2
2Fe2O3+4CuO+8SO2;
(3)少量Mg在二氧化硫中完全燃烧,产生的固体产物中含有单质、氧化物,可能是硫和氧化镁,有人认为还可能存在一种含氧酸盐,可能是氧化镁与二氧化硫化合生成的亚硫酸镁,验证是否为亚硫酸镁,可以取少量固体加盐酸溶液,有气体产生,证明存在MgSO3,故答案为MgSO3,取少量固体加盐酸溶液,有气体产生,证明存在MgSO3。
点睛:
正确推断出BCDE的成分是解题的关键。
难点是A的化学式的推断,要清楚溶液D中加入过量铁粉,充分反应后铁粉质量减少32g,发生的反应有铁与过量盐酸的反应、铁与铁离子的反应、铁与铜离子的反应,其中铁与铜离子的反应是铁粉质量增大的过程。
5.实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图:
已知:
①CuCl为白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl有水存在时在空气中易被氧化,在酸性条件下较稳定。
(1)“溶解”时选用约为0.5mol•L-1的硫酸,过程中无气体产生。
若硫酸浓度过大,反应会产生NO、NO2等有害气体,NH4NO3的用量会___(填“增大”或“减小”或“不变”)。
(2)“转化”步骤中发生反应的离子方程式为___。
加入的(NH4)2SO3需要适当过量的原因是__。
(3)氯化铵用量[
]与Cu2+沉淀率的关系如图所示。
随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是___。
(4)检验CuCl沉淀是否洗涤完全的方法是___。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
__。
(实验中可选试剂:
0.1mol•L-1盐酸、10mol•L-1盐酸、蒸馏水、无水乙醇)
【答案】增大2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+使Cu2+充分还原,保证Cu2+的还原速率,防止CuCl被空气氧化生成的氯化亚铜又溶解于氯化铵溶液中取少许最后一次洗涤液,滴入1~2滴氯化钡溶液,若不出现白色浑浊,表示已洗涤完全向产品中加入10mol•L-1盐酸溶液,不断搅拌,至固体不再溶解,过滤,向滤液中加蒸馏水至大量固体析出,过滤,再用无水乙醇洗涤2~3次,干燥
【解析】
【分析】
实验室流程中,海绵铜(主要成分为Cu和CuO)中加入硝酸铵和硫酸,酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,滤液中含有Cu2+,NH4+,H+,SO42-,NO3-。
过滤后在滤液中加入亚硫酸铵,发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+,得到的产品CuCl,据此分析。
【详解】
(1)若硫酸浓度过大,实际会发生浓硝酸与铜的反应,产生NO、NO2等有害气体,与相同质量的铜反应时,硝酸根消耗量增大,NH4NO3的用量增大。
(2)“转化”步骤中发生反应的离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+。
CuCl在酸性条件下较稳定,加入的(NH4)2SO3需要适当过量的原因是使Cu2+充分还原,保证Cu2+的还原速率,防止CuCl被空气氧化。
(3)步骤③中铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,CuCl可溶于氯离子浓度较大的溶液中。
当氯化铵用量增加到一定程度后,氯化亚铜的沉淀率减少,原因是生成的氯化亚铜又溶解于氯化铵溶液中;
(4)检验CuCl沉淀是否洗涤完全的本质是检查是否有Cu+残留,检验的方法是取少许最后一次洗涤液,滴入1~2滴氯化钡溶液,若不出现白色浑浊,表示已洗涤完全。
(5)由题目已知资料可知,CuCl难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
若CuCl产品中混有少量CaSO4,向产品中加入10mol•L-1盐酸溶液,不断搅拌,至固体不再溶解,过滤,向滤液中加蒸馏水至大量固体析出,过滤,再用无水乙醇洗涤2~3次,干燥即可得到纯净氯化亚铜。
6.过渡金属的单质及化合物很多有催化性能,氯化铜、氯化亚铜经常用作有机合成催化剂。
实验室中用氯气与粗铜(杂质只有Fe)反应,制备铜的氯化物的流程如下。
查阅资料:
氯化亚铜:
白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:
从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
①按气流方向连接各仪器接口顺序是:
a→_____、_____→h、i→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_____。
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是_____;
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_____。
aCu(OH)2bNH3·H2OcCuOdCuSO4
查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________。
(提示:
lg2=0.3)
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:
加少量盐酸、蒸发浓缩、________、_______、洗涤、干燥。
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式:
____________。
【答案】defgbAD抑制氯化铜、氯化铁水解ac43.3(或3+lg2)冷却到26~42℃结晶过滤4Cu2++4Cl-+N2H4
4CuCl↓+N2↑+4H+
【解析】
【分析】
⑴①A装置制取氯气,B除掉尾气,C除掉氯气中HCl杂质,D氯气与铜反应,E除掉氯气中水;②先反应生成氯气,不能先加热D,先加热会使铜与氧气反应。
⑵①固体甲是氯化铜和氯化铁的混合物,因此加稀盐酸溶解,溶解抑制氯化铜、氯化铁水解;②溶液甲可加试剂X用于调节pH以除去氯化铁杂质,应选择要保留的铜离子对应的难溶的物质;设溶液中CuSO4的浓度为3.0mol·L-1,先算氢氧根浓度,再酸氢离子浓度和pH,Fe3+完全沉淀时先根据溶度积算氢氧根浓度,再酸氢离子和pH;③根据题中意思要得到纯净CuCl2·2H2O晶体要冷却到26~42℃结晶。
⑶向溶液乙中加入适当的还原剂N2H4,并微热得到CuCl沉淀和氮气。
【详解】
⑴①A装置制取氯气,B除掉尾气,C除掉氯气中HCl杂质,D氯气与铜反应,E除掉氯气中水,因此按气流方向连接各仪器接口顺序是:
a→d、e→h、i→f、g→b,故答案为:
d;e;f;g;b。
②先反应生成氯气,不能先加热D,先加热会使铜与氧气反应,因此加热的顺序为先A后D,故答案为:
A;D。
⑵①固体甲是氯化铜和氯化铁的混合物,因此加稀盐酸溶解,溶解抑制氯化铜、氯化铁水解,故答案为:
抑制氯化铜、氯化铁水解。
②溶液甲可加试剂X用于调节pH以除去氯化铁杂质,应选择要保留的铜离子对应的难溶的物质即氢氧化铜、氧化铜、碱式碳酸铜、碳酸铜等,故答案为:
ac。
设溶液中CuSO4的浓度为3.0mol·L-1,
,
,
,因此Cu(OH)2开始沉淀时溶液的pH为10,Fe3+完全沉淀
,
,
,因此Fe3+完全沉淀时溶液的pH=lg5×10-4=4-lg5=3.3,故答案为:
3.3。
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:
加少量盐酸、蒸发浓缩、冷却到26~42℃结晶、过滤、洗涤、干燥,故答案为:
冷却到26~42℃结晶;过滤。
⑶向溶液乙中加入适当的还原剂N2H4,并微热得到CuCl沉淀和氮气,因此向乙溶液加入N2H4的离子方程式:
4Cu2++4Cl-+N2H4
4CuCl↓+N2↑+4H+,故答案为:
4Cu2++4Cl-+N2H4
4CuCl↓+N2↑+4H+。
7.工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体的流程如图:
(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为___。
(2)“酸化”步骤反应的离子方程式为___。
(3)“过滤”所得滤液中溶质的主要成分为___。
(4)“淘洗”所用的溶液A应选用___(填序号)。
a.稀硫酸b.浓硫酸c.稀硝酸d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为___。
②若不加10%H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式____。
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是___。
(相关物质的溶解度曲线如图所示)
【答案】2CuS+3O2
2CuO+2SO2CuO+2H+═Cu2++H2OFeSO4a2∶1Cu+4H++2NO3-=Cu2++2NO2↑+2H2O蒸发浓缩,降温至温度略高于26.4°C结晶
【解析】
【分析】
工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体,废料通入空气焙烧后,铜生成氧化铜,硫化铜转化为CuO和SO2,加入硫酸酸化生成硫酸铜,加入过量的铁发生置换反应生成铜,过滤得到滤渣铁和铜,用溶液A淘洗后加入20%的HNO3和10%的H2O2发生反应,蒸发浓缩,降温至温度略高于26.4°C结晶,从“反应”所得溶液中析出Cu(NO3)2•3H2O,据此分析解答。
【详解】
(1)CuS焙烧和氧气反应转化为CuO和SO2,反应的化学方程式为:
2CuS+3O2
2CuO+2SO2,故答案为:
2CuS+3O2
2CuO+2SO2;
(2)酸化过程为经过焙烧得到的氧化铜与稀硫酸反应生成铜离子,离子方程式为:
CuO+2H+═Cu2++H2O,故答案为:
CuO+2H+═Cu2++H2O;
(3)根据上述分析可知,过滤得到滤液主要为硫酸亚铁溶液,故答案为:
FeSO4;
(4)淘洗加入的酸不能具有强氧化性,否则会溶解铜。
a.稀硫酸,不能和铜反应,故a选;b.浓硫酸和铜在常温下不反应,但浓硫酸稀释会放出大量热,会和铜发生反应,故b不选;c.稀硝酸具有氧化性能溶解铜,故c不选;d.浓硝酸能溶解铜,故d不选;故答案为:
a;
(5)①“反应”一步所用的试剂是20%HNO3和10%H2O2,硝酸做酸,过氧化氢做氧化剂将Cu氧化生成硝酸铜,反应的化学方程式为:
Cu+H2O2+2HNO3=Cu(NO3)2+2H2O,理论上消耗HNO3和H2O2的物质的量之比为2∶1,故答案为:
2∶1;
②若不加10%H2O2,只用浓HNO3,铜和浓硝酸反应生成二氧化氮气体,反应的离子方程式为:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(6)根据图像中结晶水合物的溶解度随温度变化曲线可知,温度高于26.4°C从“反应”所得溶液中析出Cu(NO3)2•3H2O,从“反应”所得溶液中析出Cu(NO3)2•3H2O的方法是:
蒸发浓缩,降温至温度略高于26.4°C结晶,故答案为;蒸发浓缩,降温至温度略高于26.4°C结晶。
【点睛】
本题的易错点为(6),要注意图像中温度的临界点为26.4°C。
8.我国古代许多著作在化学学科知识上都体现出了一定水平的认识。
其中《管子•地数》中有记载:
“上有丹沙者,下有黄金;上有慈石者,下有铜金。
”
Ⅰ.“丹沙者丹砂也”,丹砂是古代炼丹的重要原料,也是实验室处理水银洒落后的产物。
你认为丹砂主要成分是_____;(填化学式)“慈石者磁石也”,请写出磁石溶于盐酸的离子方程式:
_____;
Ⅱ.“铜金者,斑岩铜矿也。
”
安徽宣城茶亭铜金矿床是长江中下游成矿带中新发现的一个大型斑岩型矿床。
斑岩铜矿中Cu主要以铜﹣铁硫化物(主要为CuFeS2)的形式存在。
以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4•7H2O)。
其主要流程如图:
已知:
①“反应1”:
4CuFeS2+2H2SO4+17O2═4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
沉淀物
Cu(OH)2
Fe(OH)3
Fe(OH)2
开始沉淀pH
4.7
2.7
7.6
完全沉淀pH
6.7
3.7
9.6
(1)“反应1”中,每生成1molCuSO4转移电子数为_____NA;
(2)“试剂a”是_____,“试剂b”是_____;
(3)“反应2”中加CuO调pH为3.7~4.7的目的是_____;
(4)“操作X”应为_____、_____、过滤、洗涤;请简述上述“操作X”中如何对所得FeSO4•7H2O晶体进行洗涤_____;
(5)简述如何判断“反应5”已进行完全:
_____。
【答案】HgSFe3O4+8H+=2Fe3++Fe2++4H2O17Fe粉稀硫酸使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀加热浓缩冷却结晶向漏斗中加入蒸馏水至浸没晶体,待水自然流下,重复2﹣3次取少量反应后滤液加入几滴硫氰化钾溶液,若无明显现象则证明反应进行完全
【解析】
【分析】
Ⅰ.实验室用硫磺粉处理洒落的水银,生成的产物为HgS;磁石的主要成分为四氧化三铁,与盐酸反应生成氯化铁、氯化亚铁和水;
Ⅱ.
(1)根据方程式中物质元素化合价的变化确定