化学人教版高中选修4 化学反应原理电化学原电池习题汇总.docx
《化学人教版高中选修4 化学反应原理电化学原电池习题汇总.docx》由会员分享,可在线阅读,更多相关《化学人教版高中选修4 化学反应原理电化学原电池习题汇总.docx(16页珍藏版)》请在冰豆网上搜索。
化学人教版高中选修4化学反应原理电化学原电池习题汇总
电化学(原电池)习题汇总
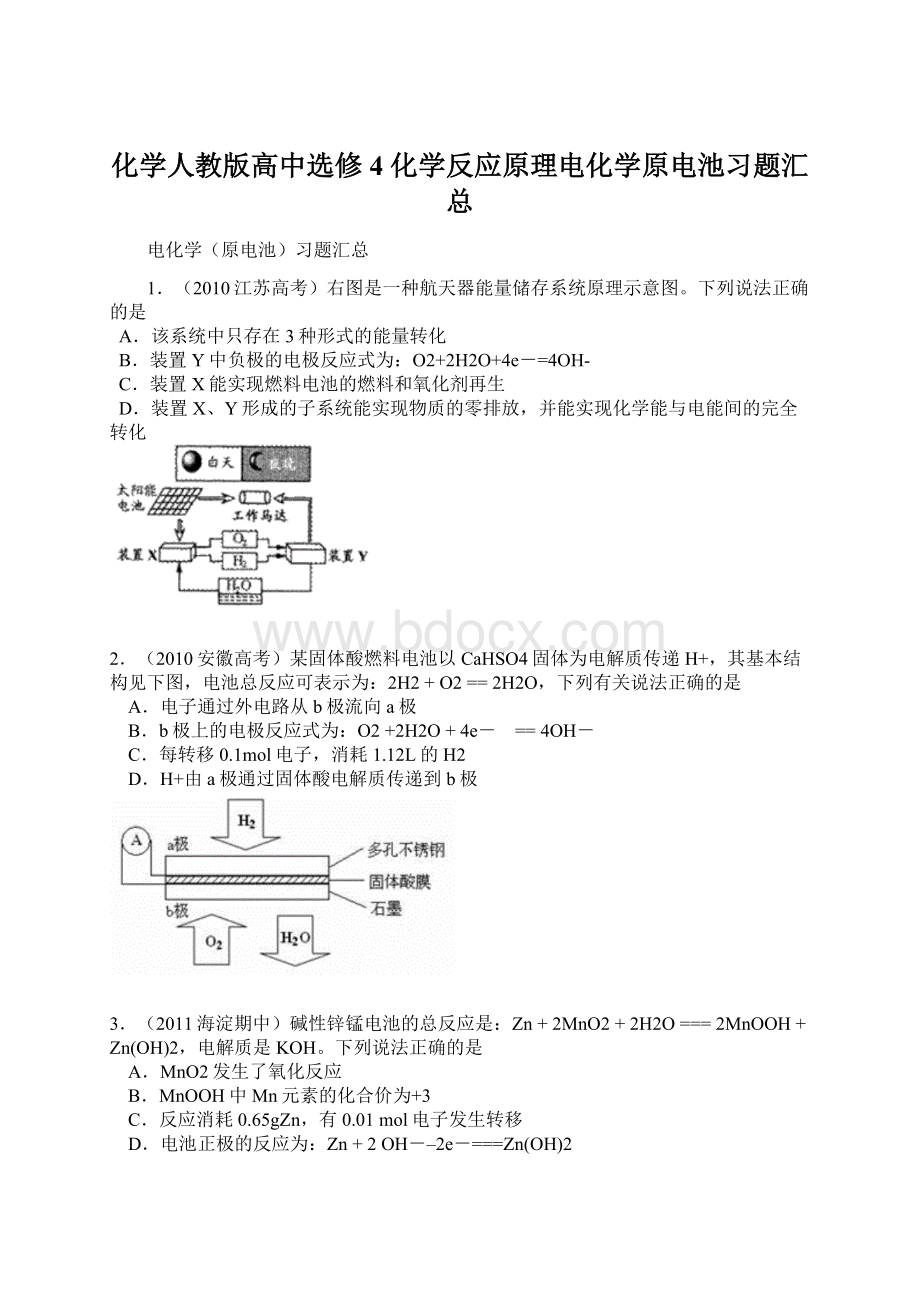
1.(2010江苏高考)右图是一种航天器能量储存系统原理示意图。
下列说法正确的是
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:
O2+2H2O+4e-=4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
2.(2010安徽高考)某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:
2H2+O2==2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:
O2+2H2O+4e- ==4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
3.(2011海淀期中)碱性锌锰电池的总反应是:
Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,电解质是KOH。
下列说法正确的是
A.MnO2发生了氧化反应
B.MnOOH中Mn元素的化合价为+3
C.反应消耗0.65gZn,有0.01mol电子发生转移
D.电池正极的反应为:
Zn+2OH-–2e-===Zn(OH)2
4.(2011海淀期中)直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101kPa时,1molCH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0kJ·mol-1
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g) △H2
已知H2(g)+
O2(g)===H2O(g) △H=-241.8kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。
甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
5.(2010广东高考)铜锌原电池工作时,下列叙述正确的是
A、正极反应为:
Zn—2e-=Zn2+
B、电池反应为:
Zn+Cu2+=Zn2++Cu
C、在外电路中,电子从负极流向正极
D、盐桥中的K+移向ZnSO4溶液
6.(2010全国高考I卷)右图是一种染料敏化太阳能电池的示意图。
电池的一个点极由有机光敏燃料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/s
TiO2/S+(激发态)
TiO2/S+
TiO2/S++e-
I3-+2e-
3I-
2TiO2/S++3I-
2TiO2/S+I3-
下列关于该电池叙述错误的是:
A.电池工作时,是将太阳能转化为电能
B.电池工作时,I-离子在镀铂导电玻璃电极上放电
C.电池中镀铂导电玻璃为正极
D.电池的电解质溶液中I-和I3-的浓度不会减少
7.(2010全国新课标)根据右图,可判断出下列离子方程式中错误的是
A.2Ag(s)+Cd2+(aq)==2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq)
D. 2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq)
8.(2010南京三模)某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如右图所示。
下列说法正确的是
A.电流方向为:
铝质易拉罐→导线→扬声器→导线→炭棒
B.铝质易拉罐将逐渐被腐蚀
C.电池总反应为:
4Al+3O2+6H2O=4Al(OH)2
D.炭棒上发生的主要反应为:
2H++2e-=H2↑
9.(2010宁德质检)科研人员设想用如图所示装置生产硫酸,下列说法正确的是
A.a为正极,b为负极
B.生产过程中a电极质量减轻
C.电子从b极向a极移动
D.负极反应式为:
SO2+2H2O→SO42-+4H++2e-
10.(2009广东高考)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。
下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:
O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:
Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
11.(2009江苏高考)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是
A.该电池能够在高温下工作
B.电池的负极反应为:
C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4/6L
12.(2009年天津高考)氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
(4)该电池工作时,H2和O2连续由外部供给,电池可连
续不断提供电能。
因此,大量安全储氢是关键技术之
一金属锂是一种重要的储氢材料,吸氢和放氢原理如
下:
Ⅰ.2Li+H2
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。
用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 。
13.(2009海南高考)Li-SOCl2电池可用于心脏起搏器。
该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。
电池的总反应可表示为:
4Li+2SOCl2=4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。
如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
14.(2009济南模拟)右图为一原电池的结构示意图,下列说法不正确的是
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
15.(2009福建质检)某原电池构造如右图所示。
下列有关叙述正确的是
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1mol电子,铜的质量理论上减小6.4g
D.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
16.(2009潍坊模拟)被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。
在纸内是离子“流过”水和氧化锌组成的电解液。
电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH)。
下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当O.1molZn完全溶解时,流经电解液的电子个数为1.204×1023
D.电池正极反应式为:
2Mn02+2e一+2H2O
2MnO(OH)+2OH-
17.(2009温州一测)我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是(设NA代表阿伏加德罗常数)
A.该氢氧燃料电池是一种具有应用前景的绿色电源
B.该电池工作一段时间后,电解液中KOH的物质的量不变
C.该氢氧燃料电池工作时氢气在负极被氧化
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,理论上有0.1NA电子转移
18.(2009无锡调研)肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
电池总反应为:
N2H4+O2=N2↑+2H2O。
下列关于该燃料电池工作时的说法正确的是
A.负极的电极反应式是:
N2H4+4OH--4e-=4H2O+N2↑
B.正极的电极反应式是:
O2+4H++4e-=2H2O
C.溶液中阴离子向正极移动
D.溶液中阴离子物质的量基本不变
19.(2008烟台诊断)熔融盐燃料电池具有高的发电效率,因而受到重视。
用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。
已知该电池总反应为:
2CO+O2=2CO2。
则下列说法中正确的是
A.通CO的一极是电池的正极
B.正极反应式为:
2CO+2CO32-→4CO2+4e-
C.负极反应式为:
O2+2CO2+4e-→2CO32-
D.该电池工作过程中需不断补充CO和O2,CO2可循环利用
20.(2008广州一测)甲醇(CH3OH)燃料电池可用于笔记本电脑、汽车等,一极通入甲醇,另一极通入氧气,电池工作时,H+由负极移向正极。
下列叙述正确的是
A.氧气为负极
B.甲醇为负极
C.正极反应为:
O2+4H++4e-==2H2O
D.负极反应为:
CH3OH+H2O+6e-==CO2↑+6H+
21.(2008广东高考)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。
以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:
Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
22.(2008北京高考)据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供腺务。
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
A.正极反应式为:
O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:
2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
23.(2008四川高考)在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
下列该电池的电极反应正确的是
A.负极反应为Zn-2e-=Zn2+
B.负极反应为Zn+2H2O-2e-=Zn(OH)2+H+
C.正极反应为2MnO2+2H++2e-=2MnOOH
D.正极反应为2MnO2+2H2O+2e-=2MnOOH+2OH-
24.(2007重庆高考)如右图所示,下列叙述正确的是
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X为滤纸接触处变红
25.(2007海南高考)依据氧化还原反应:
2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
26.(2007宁夏高考)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:
;
银片上发生的电极反应:
。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。
(已知NA=6.02×1023/mol,电子电荷为1.60×10-19C)
27.(2007广东高考)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。
电池负极反应为:
A、H2+2OH-=2H2O+2e- B、O2+4H++4e-=2H2O
C、H2=2H++2e- D、O2+2H2O+4e-=4OH-
28.(2007天津高考)天津是我国研发和生产锂离子电池的重要基地。
锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。
电池反应为LiCoO2+C6
CoO2+LiC6,下列说法正确的是
A、充电时,电池的负极反应为LiC6-e-=Li+C6
B、放电时,电池的正极反应为CoO2+Li++e-=LiCoO2,
C、羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D、锂离子电池的比能量(单位质量释放的能量)低
29.(2007广东高考)为了避免青铜器生成铜绿,以下方法正确的是
A、将青铜器放在银质托盘上 B、将青铜器保存在干燥的环境中
C、将青铜器保存在潮湿的空气中 D、在青铜器的表面覆盖一层防渗的高分子膜
30.(2007全国Ⅱ卷)在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A、正极附近的SO42―离子浓度逐渐增大
B、电子通过导线由铜片流向锌片
C、正极有O2逸出
D、铜片上有H2逸出
31.(2007山东高考)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将
(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 负投反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
氢氧化物开始沉淀时的pH
氢氧化物沉淀完全时的pH
Fe3+
Fe2+
Cu2+
1.9
7.0
4.7
3.2
9.0
6.7
提供的药品:
Cl2 浓H2SO4 NaOH溶液 CuO Cu
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。
请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
32.(2007朝阳二考)短周期元素X、Y、Z、W原子序数依次增大,常温时化合物XW是气体,遇氨气产生大量白烟。
化合物Z2Y2是淡黄色固体。
(1)写出离子化合物ZW的化学式 。
(2)写出Z2Y2与H2O反应的化学方程式 。
(3)如图装置所示,进行下列操作:
第一步:
将开关K1接通后,水槽中 附近先变红(填阴极或阳极)。
碳棒上的电极反应式为 。
第二步:
将开关K1断开,向水槽中滴入XW的溶液至红色恰好褪去,再接通开关K2,发现电流表指针偏转。
写出碳棒上的电极反应式 。
第三步:
一段时间后,将开关K2断开,向水槽中滴入酸性K3[Fe(CN)6]溶液,可以看到有蓝色沉淀Fe3[Fe(CN)6]2生成,标出化学式Fe3[Fe(CN)6]2中铁元素的化合价(在横线处化学式上标出)。
(4)Z2Y2可与氯化亚铁溶液反应产生红褐色沉淀和能使带火星木条复燃的气体,若沉淀和气体的物质的量之比为2:
1,反应的化学方程式是 。
33.(2007宣武二考)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为:
3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+
4KOH下列叙述不正确的是
A.放电时锌做负极
B.充电时氢氧化铁被氧化
C.放电时溶液的碱性增强
D.放电时转移3mole—1,有2molFeO42-被还原
34.(2007湖北三市)有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。
电池的总反应为:
2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2。
下列说法中正确的
A.正极反应为4OH--4e-=2H2O+O2↑
B.电池放电时,电池中CO32-的物质的量将逐渐减少
C.放电时CO32-向负极移动
D.电路中的电子经正极、负极、熔融的K2CO3后再加到正极,形成闭合回路
35.(2007东城二考)新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全。
已知电池总反应式为C2H5OH+3O2=2CO2+3H2O。
下列说法不正确的是
A.a极为电池的负极,该电极发生氧化反应
B.电池工作时电流由b极沿导线经灯泡到a极
C.电池正极的电极反应式为O2+2H2O+4e-=4OH
D.电池工作时,1mol乙醇被氧化转移12mol电子
36.(2007厦门适考)某研究小组对铁生锈进行研究。
(1)甲同学设计了A、B、C一组实验(如图),探究铁生锈的条件。
经过较长时间后,甲同学观察到的现象是:
A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是 ;
②铁钉发生电化腐蚀的正极电极反应式为 ;
③实验B所用的水要经过 处理;植物油的作用是 ;
④实验C中碱石灰的作用是 。
(2)乙同学为了达到同样目的,设计了实验D(如图),发现一段时间后,试管中的液面升高,其原因是
,该实验 (填“能”或“不能”)说明水对铁钉生锈产生影响。
(3)丙同学为了探究铁锈(Fe2O3·nH2O)的组成,将甲同学实验产生的铁锈刮下来,称取1.96g这种铁锈,按如图所示装置进行实验。
充分反应后,称得B装置的质量增加0.36g,C装置的质量增加1.32g,则根据实验数据,推断铁锈的化学式中n值为 。
(4)为了保证实验安全,实验开始时应先点燃 (填A或E)处的酒精灯。
37.(2007全国一联)不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔解的K2CO3,已知该电池的总反应为:
2H2+O2===2H2O,负极反应为:
H2+CO32――2e-==H2O+CO2,则下列推断中正确的是
A.正极反应为4OH-==O2+2H2O+4e- B.该电池的电极没有参加反应
C.电池供应1mol水蒸气,转移的电子数4mol D.O2从正极通入,发生氧化反应
38.(2007如皋调研)近年来,镁在汽车、航天、航空、机械制造、军事等产业中应用迅猛发展。
⑴新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,是由于镁合金具有 等优异性能。
⑵某研究性学习小组探究以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池(如右图所示)时发现,刚开始,电表指针向右偏转,镁条做负极;但随后很快指针向左偏转,镁条表面有极少量的气泡产生。
①开始阶段,负极发生的反应是 。
②随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:
2H2O+2e-=H2↑+2OH-,试写出镁电极发生的主要反应的极反应式______________________。
⑶经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如右图所示,溶液中的产物有Mg(NO3)2,NH4NO3和H2O。
某同学拟用1.2g镁与100mL硝酸反应制取二氧化氮,硝酸的物质的量物质的量浓度至少为 。
39.(2007湖南一联)燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图。
丁烷在催化剂作用下提供质子(H+)和电子。
电子经外电路、质子经内电路到达另一极与氧气反应。
电池总反应式为:
2C4H10+13O2=8CO2+10H2O。
下列说