九年级化学 酸碱盐综合知识讲解素材 沪教版.docx
《九年级化学 酸碱盐综合知识讲解素材 沪教版.docx》由会员分享,可在线阅读,更多相关《九年级化学 酸碱盐综合知识讲解素材 沪教版.docx(16页珍藏版)》请在冰豆网上搜索。
九年级化学酸碱盐综合知识讲解素材沪教版
酸碱盐综合知识专题讲解
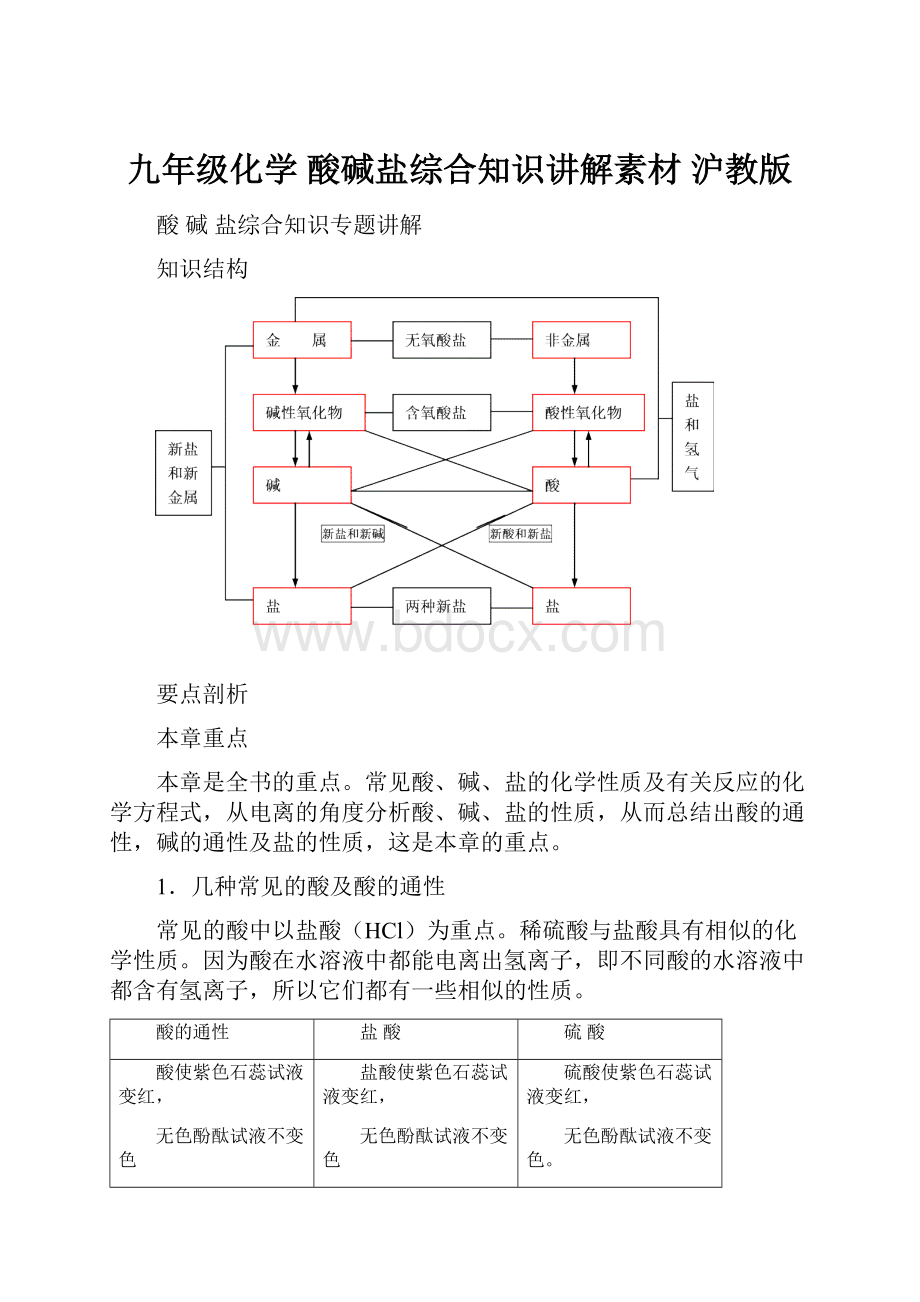
知识结构
要点剖析
本章重点
本章是全书的重点。
常见酸、碱、盐的化学性质及有关反应的化学方程式,从电离的角度分析酸、碱、盐的性质,从而总结出酸的通性,碱的通性及盐的性质,这是本章的重点。
1.几种常见的酸及酸的通性
常见的酸中以盐酸(HCl)为重点。
稀硫酸与盐酸具有相似的化学性质。
因为酸在水溶液中都能电离出氢离子,即不同酸的水溶液中都含有氢离子,所以它们都有一些相似的性质。
酸的通性
盐酸
硫酸
酸使紫色石蕊试液变红,
无色酚酞试液不变色
盐酸使紫色石蕊试液变红,
无色酚酞试液不变色
硫酸使紫色石蕊试液变红,
无色酚酞试液不变色。
金属+酸→盐+氢气
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑
碱性氧化物+酸→盐+水
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
碱+酸→盐+水
NaOH+HCl=NaCl+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
盐+酸→另一种盐+另一种酸
AgNO3+HCl=AgCl↓+HNO3
BaCl2+H2SO4=BaSO4↓+2HCl
常见的酸及酸的通性
注意:
在金属+酸→盐+氢气中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,不能生成氢气而生成了水;金属是指氢前面的活泼金属,氢后的金属不能置换酸中的氢。
通过金属跟酸的反应情况导出金属活动顺序表
KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu
金属活动性由强逐渐减弱
金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里。
你想想看为什么这样操作?
2.几种常见的碱及碱的通性
常见碱中以氢氧化钠(NaOH)为重点,其次是氢氧化钙〔Ca(OH)2〕。
碱在水溶液里都能电离而生成氢氧根离子,即不同的碱溶液里都含有相同的氢氧根离子,所以它们有相似的化学性质。
常见的碱及碱的通性
碱的通性
氢氧化钠
氢氧化钙
碱使紫色石蕊试液变蓝,
无色酚酞试液变红。
氢氧化钠使紫色石蕊试液变蓝,无色酚酞试液变红。
氢氧化钙使紫色石蕊试液变蓝,无色酚酞试液变红。
酸性氧化物+碱→盐+水
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
酸+碱→盐+水
NaOH+HCl=NaCl+H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
盐+碱→另一种盐+另一种碱
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
注意:
只有可溶性碱才能跟一些非金属氧化物发生反应,这些非金属氧化物是酸性氧化物。
酸性氧化物多数能溶于水,跟水化合生成酸。
盐和碱反应时,必须两者都是可溶的,且生成物之一是沉淀,反应才能进行。
3.几种常见的盐及盐的性质
在本章主要学习了三种盐,即氯化钠、碳酸钠和硫酸铜,要求同学掌握这三种盐的性质及用途。
依据常见盐的性质总结出盐的化学性质。
盐的性质
实例
盐溶液+金属→盐ˊ+金属ˊ
CuSO4+Zn=ZnSO4+Cu
盐+酸→盐ˊ+酸ˊ
BaCl2+H2SO4=BaSO4↓+2HCl
盐溶液+碱溶液→盐ˊ+碱ˊ
3NaOH+FeCl3=3NaCl+Fe(OH)3↓
盐溶液+盐溶液→盐ˊ+盐ˊ
AgNO3+NaCl=AgCl↓+NaNO3
注意:
在金属活动顺序表中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来。
但K、Ca、Na三种金属与盐溶液的反应特殊,这里不要求。
4.复分解反应及其发生的条件
定义:
由两种化合物相互交换成分,生成另外两种化合物的反应。
通式:
AB+CD=AD+CB
发生的条件:
两种物质在溶液中相互交换离子,生成物中如果有沉淀析出、气体放出或有水生成,复分解反应均可以发生。
本章难点
1.书写碱跟某些金属氧化物反应的化学方程式
关于这类反应化学方程式的书写有人感到很困难,为此,可先写出非金属氧化物跟水反应,生成含氧酸的化学方程式,再以含氧酸和碱相互交换成分写出生成物。
两式合并成一个化学方程式。
如,三氧化硫跟氢氧化钠反应:
2.运用复分解反应发生的条件,正确书写本章涉及的化学方程式。
有很多同学记住了酸、碱通性和盐的性质,但接触到具体物质发生的具体反应,用化学方程式来表达时,便感到困难。
解决这一难点的办法有二:
一是在学习酸的通性和碱的通性时,反复练习书写有关化学方程式,这两部分内容掌握了,学习盐的性质也就迎刃而解;二是要自学书后附录Ⅲ“部分酸、碱和盐的溶解性表”,从中找出溶与不溶的规律,再多练习书写有关反应的化学方程式,边写边巩固复分解反应条件。
这样多次练习,你会觉得书写复分解反应的化学方程式,是有规律可循的,并不是难事。
本章考点
1.金属活动顺序表的应用
根据金属活动顺序表判断金属的活动性,判断一些反应能否发生等都是中考的热点。
如,已知X、Y、Z三种金属,它们在溶液中能发生如下反应:
X+YCl2=XCl2+Y;
Z+XCl2=ZCl2+X;X+2HCl=XCl2+H2↑,则三种金属与H比较活动性由强到弱的顺序可能有
。
答案:
Z、X、(H)、Y或Z、X、Y(H)。
中考中有很多同学只能写出一种情况,而丢掉另一种情况。
2.溶液的酸碱性及pH
利用酸碱指示剂判断溶液的酸碱性。
pH表示溶液的酸碱度,它的范围通常在0~14之间,pH=7时,溶液呈中性;pH<7时,溶液呈酸性;pH>7时,溶液呈碱性。
如碳酸钠溶液,虽然它是盐溶液,但它的pH>7,溶液呈碱性,因此我们可用它中和面粉发酵时产生的酸。
碳酸钠溶液呈碱性的原因,待到高中学习。
如,向
蒸馏水、
稀硫酸、
石灰水中分别滴加石蕊试液,石蕊试液分别呈色、
色、色,三种液体的pH值由小到大的顺序(填序号)。
答案:
紫、红、蓝,
。
此题有很多同学认为石蕊试液滴入蒸馏水中,呈白色,有的写无色,还有写红色的,说明同学没作过实验,可见多动动手做实验,才会观察到真正的现象。
3.Cl-、
、
的检验(见下表)
实验操作
实验现象
实验结论
化学方程式
Cl-
取少量样品于试管中,滴加AgNO3溶液和稀HNO3
有不溶于稀硝酸的白色沉淀生成
样品含有Cl-
AgNO3+KCl=AgCl↓+KNO3
取少量样品于试管中,滴加Ba(NO3)2溶液和稀HNO3
有不溶于稀硝酸的白色沉淀生成
样品含有
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
取少量样品于试管中,滴加稀HCl,将生成的气体通入澄清石灰水
有无色气体生成,该气体使澄清石灰水变浑浊
样品含有
K2CO3+2HCl=2KCl+CO2↑+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
3.灵活运用复分解反应条件及溶解性表,解决一些简单的化学实际问题及综合试题。
本考点是历年各省中考必考的内容。
本章重点知识的灵活运用,可体现在化学的除杂、分离、鉴别、判定、推断等问题中,可见熟练地掌握和运用有关化学方程式是解决这类问题的关键。
例题详解
例1.下列物质是由金属与酸发生置换反应生成的是()
A.Zn(NO3)2B.CuSO4C.FeCl3D.Al2(SO4)3
分析:
根据金属与酸发生置换反应的规律,金属必须是在金属活动性顺序中氢前面的金属,铜是氢后的金属,铜与酸不能发生置换反应。
B应排除。
从酸来说,盐酸或稀硫酸能发生置换反应,而浓硫酸、硝酸与金属不能发生置换反应,A应排除。
在置换反应中铁生成正二价的化合物,所以C应排除。
D可由铝与稀硫酸发生置换反应生成。
正确答案为D。
例2.在硝酸银和硝酸铜的混合液中,加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后向滤液中滴加盐酸,有白色沉淀生成,则析出的少量金属是()
A.铜和铁B.铁和银C.银D.铜和银
分析:
根据金属和盐溶液的反应规律。
在金属活动性顺序表中,铁、铜、银的活动性由强到弱的顺序Fe>Cu>Ag,金属的活动性差异越大,置换反应越容易发生。
所以最易反应的是Fe+2AgNO3=Fe(NO3)2+2Ag,若还有Fe粉,则发生的反应是Fe+CuSO4=FeSO4+Cu。
反应后的滤液中加入盐酸有白色沉淀生成,说明滤液中仍有Ag+,而Fe已全部消耗掉,那么置换出的金属只能是Ag,而没有Cu。
例3.a、b、c、d、e属于酸、碱、盐的五种化合物,它们的溶液相互反应时关系如下:
(1)a+b=c+H2O
(2)c+H2SO4=d+a
(3)e+AgNO3=AgCl↓+c
下列推断正确的是:
A.a是硝酸,e是氯化钡B.a是硝酸,e是硝酸钡
C.a是硝酸,e是盐酸D.a是盐酸,b是氢氧化钠
分析:
此题用类推法分析。
已知a、b、c、d、e都是化合物,因而三个化学反应都属于复分解反应,根据复分解反应发生的条件,有水或有气体,或有沉淀生成,此反应就可以发生。
从第(3)个方程式可推知,e中有氯离子,c中有NO3-,从第
(2)个方程式可知c中的阳离子是Ba2+,c中的阳离子必定和
作用生成不溶性的BaSO4沉淀,所以c为Ba(NO3)2,d和a是BaSO4、HNO3。
而(3)中的e则为BaCl2,从第
(1)个方程式可知,能生成Ba(NO3)2和水,即盐和水的反应物定是酸和碱,所以a是HNO3,b是Ba(OH)2,A答案正确。
例4.A、B、C、D四种物质符合下列反应关系:
(1)B+H2=单质A+H2O
(2)B+H2SO4=C+H2O
(3)C+NaOH=蓝色↓D+Na2SO4
试判断出它们的物质名称:
A;B;C;D;
分析:
此题的突破口在(3)中的蓝色沉淀D,从物质在水中呈现出沉淀的颜色可知D为氢氧化铜,根据复分解反应规律可推断出C是硫酸铜,然后顺藤摸瓜,推出
(2)中的B物质中一定含有铜元素,且能和硫酸反应生成硫酸铜和水,一定是碱或碱性氧化物,而D已是氢氧化铜,所以B肯定是氧化铜,则
(1)中还原出的A是铜。
于是答案就显而易见:
A—铜;B—氧化铜;C—硫酸铜;D—氢氧化铜。
例5.有A、B、C、D、E五瓶已失去标签的溶液,各瓶可能是AgNO3、BaCl2、Na2CO3、Ca(NO3)2、HCl溶液中的一种,现将瓶内溶液各取少许,进行两两混合实验,实验结果如下表所示(说明:
表中“↑”表示有气体生成;“↓”表示有沉淀生成,“―”表示无明显现象或有微溶化合物生成),试根据实验结果判断出各瓶中装的是什么溶液(写化学式)
A
―
B
↓
↓
C
↓
↑
↓
D
―
―
―
↓
E
A;B;C;D;E。
分析:
推断此类题有两种方法:
方法一:
根据上图找出突破口在D,D能和三种物质生成沉淀,和一种物质产生气体,据题可知D为Na2CO3,则B为盐酸,能和盐酸反应生成沉淀的C则为AgNO3,那么A则应是BaCl2,E为Ca(NO3)2。
方法二:
一般采用将给定的物质横纵同序排列,将两两混合,写出相应的反应现象,然后对照原题相应的现象找出各物质的方法。
AgNO3
BaCl2
Na2CO3
Ca(NO3)2
HCl
AgNO3
↓
↓
―
↓
BaCl2、
↓
↓
―
―
Na2CO3
↓
↓
↓
↑
Ca(NO3)2
―
―
↓
―
HCl
↓
―
↑
―
例6.要完成下列变化,通过一步反应不能实现的是()
A.Ba(OH)2→NaOHB.Cu(NO3)2→CuCl2
C.MgCO3→MgCl2D.Ca(NO3)2→KNO3
分析:
A选项:
氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,过滤,可一步得到氢氧化钠;
B选项:
硝酸铜和氢氧化钠可得氢氧化铜沉淀和硝酸钠,氢氧化铜和盐酸作用生成氯化铜和水,通过两步得氯化铜;
C选项:
碳酸镁和盐酸作用,生成氯化镁、水和二氧化碳,一步得氯化镁;
D选项:
硝酸钙和碳酸钾作用生成碳酸钙沉淀和硝酸钾,过滤后一步得硝酸钾。
所以答案选B。
例7.在20℃时,向174.3g饱和碳酸钾溶液中,加入104g质量分数为20%的氯化钡溶液,恰好完全反应,计算:
(1)20℃时,硫酸钾的溶解度;
(2)完全反应后,生成物溶液中溶质的质量分数。
分析:
根据质量守恒定律,碳酸钾溶质质量+氯化钡溶质质量=碳酸钡沉淀的质量+生成氯化钾溶质的质量,由于碳酸钾溶液中溶剂质量和氯化钡溶液中溶剂质量在化学反应前后没有发生变化,也是守恒的,所以,碳酸钾溶液的质量+氯化钡溶液的质量=碳酸钡沉淀质量+氯化钾溶液的质量,即:
氯化钾溶液的质量=碳酸钾溶液质量+氯化钡溶液质量-碳酸钡沉淀的质量。
设硫酸钾饱和溶液中溶质质量为x,生成氯化钾质量为y,生成硫酸钡质量为z。
K2SO4+BaCl2=BaSO4↓+2KCl
174208233149
x104×20%zy
174∶208=x∶20.8x=17.4
208∶233=20.8∶zz=23.3
208∶149=20.8∶yy=14.9
(1)K2SO4的溶解度:
17.4÷(174.3-17.4)×100=11.1
(2)反应后生成氯化钾溶液质量:
174.3+104-23.3=255
氯化钾溶质质量分数:
14.9÷255×100%=5.8%
答:
略
跟踪训练
练习1.甲、乙两相邻化工厂,排放的污水经处理后,仍然溶有下列8种离子Ag+、Ba2+、Fe3+、Na+、Cl-、
、
、OH-中各不相同的4种,如果将甲、乙两厂的污水,按适当比例充分混合,经再沉淀后,排放出的污水转变成无色的澄清的硝酸钠稀溶液,污染程度大为降低,又经测定甲厂污水的pH大于7,试推断:
(1)甲厂污水中含有的4种离子是;
(2)乙厂污水中含有的4种离子是。
【分析】溶液中共存离子之间不能相互结合形成沉淀,气体或水。
本题中的Ba2+与
,Fe3+与OH-,Ag+与Cl-,Ag+与OH-它们一定分处在两种溶液中。
由于甲厂污水pH大于7,溶液显碱性,污水中含有大量OH-离子,因此Fe3+、Ag+只能存于乙厂污水中,则Cl-存在于甲厂污水中,又由于Ag2SO4微溶于水,不能大量共存于同一溶液,因
只能存在甲厂污水中,Ba2+只能存于乙厂。
而不管是甲厂、还是乙厂的污水中,阴、阳离子所带正、负电荷,相加应为零,所以,甲厂污水中必有Na+,乙厂污水中必有
。
甲、乙两厂污水同时排放,Ba2+与
结合成BaSO4沉淀,Fe3+与OH-结合成Fe(OH)3沉淀,Ag+与Cl-结合成AgCl沉淀等,只剩下NaNO3溶液了。
答案:
甲厂污水中含有4种离子是:
Na+、Cl-、
、OH-
乙厂污水中含有的4种离子是:
Ag+、Ba2+、Fe3+、NO3-
练习2.X、Y、Z三种物质,有如下转化关系:
试剂甲
NaOH溶液 盐酸 试剂乙
硝酸钡溶液
根据以上转化关系,写出下列物质的化学式,
【分析】此题开始是采用倒推法求X,根据复分解反应发生的条件,已知X和硝酸钡生成硝酸镁和另一种物质应是硫酸钡,倒推回去X应是硫酸镁,然后由硫酸镁正向推导,硫酸镁和氢氧化钠作用生成氢氧化镁沉淀和硫酸钠,所以Y是氢氧化镁沉淀。
氢氧化镁又和盐酸作用,生成氯化镁和水,那么Z应是氯化镁。
氯化镁再和硝酸银作用生成硝酸镁和氯化银沉淀,因而试剂乙是硝酸银,而由X转变为Z则为硫酸镁和氯化钡作用,生成硫酸钡沉淀和氯化镁,所以试剂甲为氯化钡。
答案:
X—MgSO4;Y—Mg(OH)2;甲—BaCl2;乙—AgNO3。
练习3.有六种物质分别为:
石灰水、铁、硫酸铜溶液,碳酸钾溶液,盐酸,氯化钡溶液,它们之间的反应关系如下图(凡连线两端的物质均能发生化学反应)。
试将上述六种物质的化学式分别填入答题纸图中的空格内。
【分析】根据单质、酸、碱、盐之间的相互关系和复分解反应发生的条件。
我们把以上六种物质按顺序写出它们的化学式,然后看第一种物质依次与它后面的物质两两结合,凡是能反应的用线桥连接在一起,以此类推,看第二种物质依次与它后面的物质两两结合,凡是能反应的也用线桥连接在一起……最后看每项中物质能和其它物质相互反应的线桥共有几条。
即
以上分析可知,都有4条线桥,所不同的是硫酸铜仅仅不与盐酸反应,碳酸钾仅不与铁反应,而能与盐酸相互反应有3条线桥,能与铁相互反应2条线桥。
从而很快确定了盐酸、铁、硫酸铜、碳酸钾的位置,剩余的氢氧化钙是3条线桥,氯化钡是两条线桥,自然它们的位置也就确定了。
答案:
练习4.100g的氢氧化钠溶液与100g36.5%的盐酸,恰好完全反应,求:
(1)反应前氢氧化钠溶液的质量分数;
(2)生成溶液溶质的质量分数。
【分析】根据化学方程式,已知纯盐酸的质量,可以求出氢氧化钠溶质的质量,又知氢氧化钠溶液的质量,即可求出氢氧化钠溶质质量分数。
根据质量守恒定律,氢氧化钠溶液和盐酸溶液的质量之和,等于反应后氯化钠溶液的质量。
又根据化学方程式可知氯化钠溶液的质量即可求出氯化钠溶质的质量分数。
设参加反应氢氧化钠的质量为X,生成氯化钠的质量为Y,
NaOH+HCl=NaCl+H2O
4036.558.5
x100×36.5%y
40∶36.5=x∶36.5x=40
36.5∶58.5=36.5∶xy=58.5
NaOH%=40÷100×100%=40%
NaCl%=58.5÷(100+100)=29.25%
答:
略
练习5.取粉末状碳酸钠样品(含杂质氯化钠)12g,放入50g14.6%的盐酸中恰好完全反应。
(1)求样品中碳酸钠的质量分数;
(2)反应后溶液中溶质的质量分数。
【分析】根据质量守恒定律,碳酸钠固体的质量+盐酸溶液中溶质质量=氯化钠质量+生成水的质量+二氧化碳气体质量。
由于盐酸中溶剂质量及样品中氯化钠质量在化学反应前后,其质量没有发生变化,也是守恒的,所以,样品的质量+盐酸溶液的质量=氯化钠溶液的质量+二氧化碳气体质量,即:
氯化钠溶液的质量=样品质量+盐酸溶液的质量—二氧化碳气体质量。
设:
样品中碳酸钠的质量为x,生成氯化钠质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1067311744
x50×14.6%yz
106∶73=x∶7.3x=10.6
碳酸钠质量分数:
10.6÷12×100%=88.3%
73∶7.3=117∶yy=11.7
样品中原有氯化钠质量:
12-10.6=1.4
氯化钠溶液中溶质总质量:
11.7+1.4=13.1
设生成的二氧化碳气体质量为z
73∶7.3=44∶zz=4.4
则反应后溶液的质量:
50+12-4.4=57.6
氯化钠溶液溶质的质量分数:
13.1÷57.6×100%=22.8%
练习6.取600g稀硫酸,分成六等份,另加入镁粉进行实验,下表中记录了四次实验的数据(实验中的误差忽略不计)。
实验序号
一
二
三
四
五
六
加入镁的质量/g
1
2
3
4
5
6
生成硫酸镁的质量/g
5
15
18
18
(1)推算第二、五次实验产生的硫酸镁的质量,将数据填入上表的空格;
(2)计算稀硫酸中溶质的质量分数。
【分析】根据质量守恒定律,从第一次和第三次的实验数据可知,第二次的2g金属全参加了反应,酸有一部分未参加反应,从生成硫酸镁的倍数关系可知,第二次实验生成的硫酸镁为10g。
若第四次的4g金属仍全部参加反应,那么,生成的硫酸镁则应为20g,但只生成18g硫酸镁,说明此次实验中金属没有全参加反应,而100g硫酸全反应完了,只能生成18g硫酸镁,所以,第五次实验中仍是金属没全参加反应,生成的硫酸镁也只能为18g,根据以上分析,设硫酸溶质质量为x,
Mg+H2SO4=MgSO4+H2
98120
x18g
98∶120=x∶18g得x=14.7g
H2SO4%=]14.7g÷(600g÷6)×100%=14.7%
答:
略