高考化学与铝及其化合物推断题有关的压轴题含答案1.docx
《高考化学与铝及其化合物推断题有关的压轴题含答案1.docx》由会员分享,可在线阅读,更多相关《高考化学与铝及其化合物推断题有关的压轴题含答案1.docx(23页珍藏版)》请在冰豆网上搜索。
高考化学与铝及其化合物推断题有关的压轴题含答案1
高考化学与铝及其化合物推断题有关的压轴题含答案
(1)
一、铝及其化合物
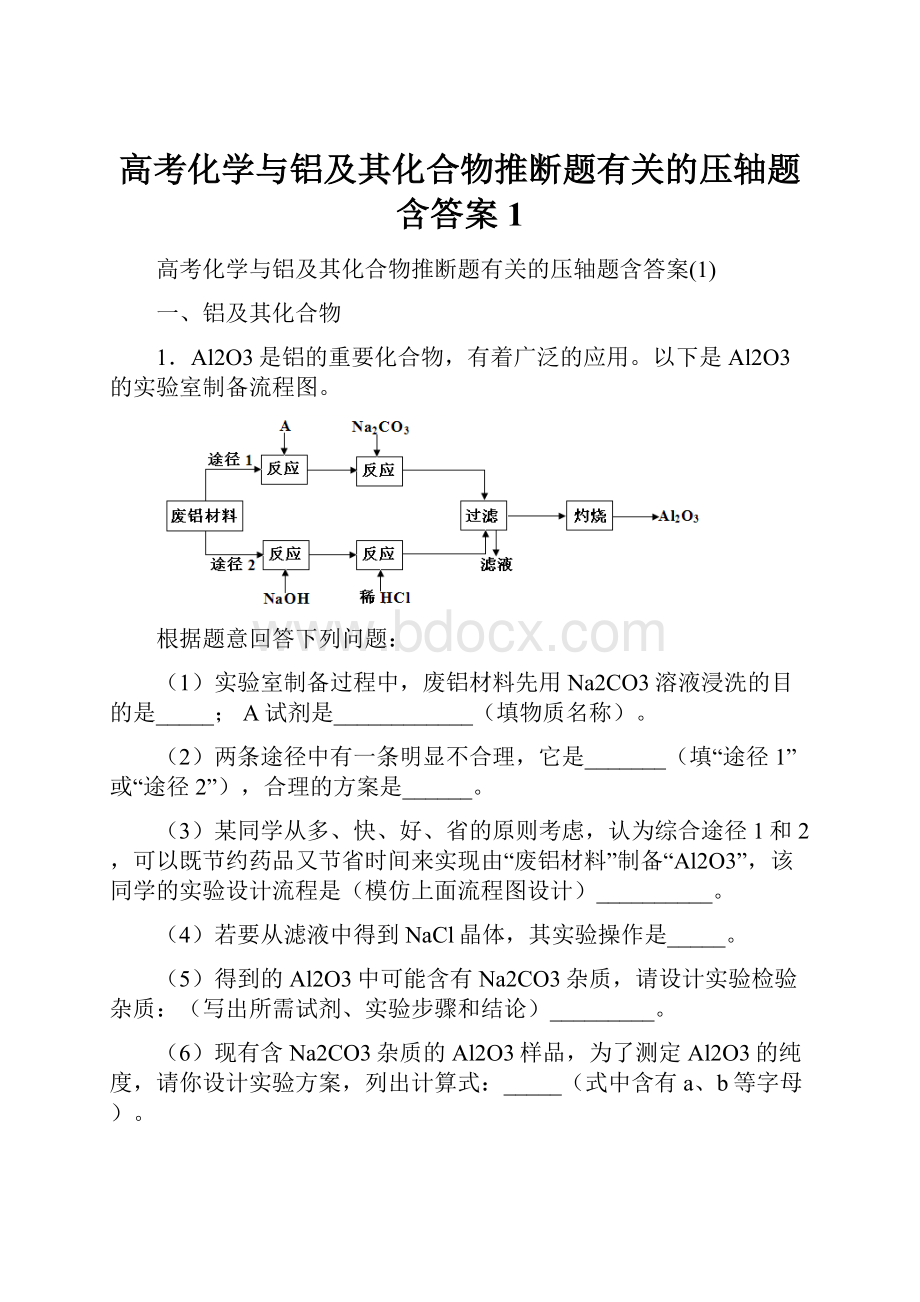
1.Al2O3是铝的重要化合物,有着广泛的应用。
以下是Al2O3的实验室制备流程图。
根据题意回答下列问题:
(1)实验室制备过程中,废铝材料先用Na2CO3溶液浸洗的目的是_____;A试剂是____________(填物质名称)。
(2)两条途径中有一条明显不合理,它是_______(填“途径1”或“途径2”),合理的方案是______。
(3)某同学从多、快、好、省的原则考虑,认为综合途径1和2,可以既节约药品又节省时间来实现由“废铝材料”制备“Al2O3”,该同学的实验设计流程是(模仿上面流程图设计)__________。
(4)若要从滤液中得到NaCl晶体,其实验操作是_____。
(5)得到的Al2O3中可能含有Na2CO3杂质,请设计实验检验杂质:
(写出所需试剂、实验步骤和结论)_________。
(6)现有含Na2CO3杂质的Al2O3样品,为了测定Al2O3的纯度,请你设计实验方案,列出计算式:
_____(式中含有a、b等字母)。
【答案】除去铝材表面的油腻稀盐酸途径2将稀盐酸改成通入过量CO2
蒸发结晶、趁热过滤、干燥取少量样品溶于水,取上层清液,加入氯化钡溶液,若出现白色沉淀,则证明有Na2CO3,反之则没有取样品质量为b,加水溶解后,加入足量的氯化钡溶液,沉淀完全以后,过滤、洗涤和干燥,称量(恒重)得沉淀ag。
计算式为:
【解析】
【分析】
从废铝材中提取氧化铝,途径1先用稀盐酸反应生成氯化铝,再与Na2CO3溶液发生双水解生成氢氧化铝,再灼烧分解生成氧化铝;途径2氧化铝先与氢氧化钠生成偏铝酸钠,再与盐酸生成氢氧化铝,再灼烧分解生成氧化铝,据此分析解答。
【详解】
(1)废铝材料先用Na2CO3溶液浸洗的目的是除去铝材表面的油腻,A为稀盐酸,故答案为:
除去铝材表面的油腻;稀盐酸;
(2)途径2不合理,因为盐酸的量不好控制,改进的方法是将稀盐酸改成通入过量CO2,故答案为:
途径2;将稀盐酸改成通入过量CO2;
(3)综合途径1和2,可以既节约药品又节省时间来实现由“废铝材料”制备“Al2O3”,应该用铝材先分别生成氯化铝和偏铝酸钠,两者再发生双水解生产氢氧化铝,流程为:
;
(4)氯化钠的溶解度受温度影响小,若要从若要从滤液中得到NaCl晶体,操作为:
蒸发结晶、趁热过滤、干燥,故答案为:
蒸发结晶、趁热过滤、干燥;
(5)得到的Al2O3中可能含有Na2CO3杂质,检测的方法为:
取少量样品溶于水,取上层清液,加入氯化钡溶液,若出现白色沉淀,则证明有Na2CO3,反之则没有,故答案为:
取少量样品溶于水,取上层清液,加入氯化钡溶液,若出现白色沉淀,则证明有Na2CO3,反之则没有;
(6)现有含Na2CO3杂质的Al2O3样品,为了测定Al2O3的纯度,可采用方案为:
取样品质量为b,加水溶解后,加入足量的氯化钡溶液,沉淀完全以后,过滤、洗涤和干燥,称量(恒重)得沉淀ag;BaCO3沉淀质量为ag,则n(BaCO3)=
=
mol=n(Na2CO3),则m(Na2CO3)=
mol
106g/mol=
,Na2CO3的纯度=
,Al2O3的纯度=
;故答案为:
取样品质量为m,加水溶解后,加入足量的氯化钡溶液,沉淀完全以后,过滤、洗涤和干燥,称量(恒重)得沉淀ag;计算式为:
。
【点睛】
本题考查物质分离和提纯,侧重考查元素化合物性质、氧化还原反应、物质分离和提纯实验操作,注意从整体上分析流程图中每一步发生的反应。
2.回答下列问题:
(1)锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。
下列有关锂及其化合物的叙述正确的是________。
ALi2SO4难溶于水
BLi与N2反应产物是Li3N
CLiOH易溶于水
DLiOH与Li2CO3受热都难分解
(2)与铝位于对角线位置的第二周期元素是________,能区别Be(OH)2和Mg(OH)2的一种试剂是________,反应的化学方程式是_________。
(3)门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下空位。
例如,他预测在铝的下方有一个与铝类似的元素“类铝”,后来被法国化学家于1875年发现,命名为镓。
镓的元素符号是________,它在周期表中的位置是___________。
(4)关于与镓同主族的第6周期元素性质的推测中不正确的是________。
A单质是银白色较软的金属
B其氢氧化物是两性氢氧化物
C在化合物中显+3价
D单质与盐酸的反应比铝剧烈
【答案】B铍(Be)NaOH溶液Be(OH)2+2NaOH=Na2BeO2+2H2OGa第四周期ⅢA族B
【解析】
【分析】
【详解】
(1)A.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质非常相似,硫酸镁易溶于水,所以硫酸锂易溶于水,故A错误;
B.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质非常相似,镁和氮气反应生成氮化镁,所以锂和氮气反应生成Li3N,故B正确;
C.氢氧化镁难溶于水,所以氢氧化锂属于难溶物质,故C错误;
D.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质非常相似,氢氧化镁和碳酸镁受热易分解,则氢氧化锂和碳酸锂受热也易分解,故D错误;
故答案为B;
(2)根据对角线规则,与铝位于对角线位置的第二周期元素是铍,有相似的化学性质,氢氧化铝具有两性,Be(OH)2也具有两性,可以与氢氧化钠反应,Mg(OH)2不可以与氢氧化钠反应,故可以用氢氧化钠来鉴别,类比氢氧化铝与氢氧化钠反应的化学方程式,则氢氧化铍与氢氧化钠反应的化学方程式为:
Be(OH)2+2NaOH=Na2BeO2+2H2O;
(3)同主族元素性质相似,铝下方的元素为镓,其元素符号为Ga,位于元素周期表中第四周期ⅢA族;
(4)A.与镓同主族的第六周期元素为铊,单质为银白色,质软,故A正确;
B.氢氧化物为两性的物质位于金属和非金属的临界处,如硼铝硅锗砷等,铊不是两性物质,其氢氧化物也不是两性氢氧化物,故B错误;
C.铊与铝同主族,具有相同的最外层电子数,所以铊在化合物中也显+3价,故C正确;
D.同主族元素自上到下金属性递增,该元素金属性大于铝,其单质与盐酸的反应比铝剧烈,故D正确;
故答案为B。
【点睛】
考查位置结构性质的相互关系应用,明确同主族元素性质的递变规律为解答关键,注意掌握对角线规则内容,结合Mg、Al单质及其化合物的性质,类推未知物的性质,试题侧重培养学生的分析、理解能力及知识的迁移能力。
3.A-J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置_________
(2)写出检验D溶液中阳离子的方法____。
(3)写出反应④的离子方程式________。
(4)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH_____7(填“>”、“<”或“=”),用离子方程式表示其原因:
______;
(5)若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:
1,则所得溶液中各离子物质的量浓度由大到小的关系是______。
【答案】第四周期Ⅷ族取少量D溶液,加KSCN溶液,出现红色2Al+2OH-+2H2O=2AlO2-+3H2↑<NH4++H2O
NH3·H2O+OH-c(NH4+)>c(SO42-)>c(H+)>c(OH-)
【解析】
【分析】
G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,C和碱、D和气体K反应生成E、F,则说明E、F都为氢氧化物,E能转化为F,应为Fe(OH)2→Fe(OH)3的转化,所以E为Fe(OH)2,F为Fe(OH)3,则C为FeCl2,D为FeCl3,K为NH3,B为Fe3O4,与Al在高温条件下发生铝热反应生成A,即Fe,结合对应单质、化合物的性质解答该题。
【详解】
(1)A、B、C、D、E、F六种物质中都含有铁元素,在周期表中位于周期表第四周期Ⅷ族,
(2)溶液D为氯化铁溶液,检验三价铁离子的存在,取少许D溶液于试管中,滴加KSCN溶液,溶液变红色,证明D溶液中含有Fe3+;
(3)反应④是金属铝和氢氧化钠溶液的反应,Al与NaOH溶液反应生成NaAlO2和H2,反应的离子方程式为:
;
(4)气体K的水溶液为一水合氨溶液,加入盐酸,使其恰好完全反应生成氯化铵和水,氯化铵在水溶液中水解显酸性,所以pH<7;反应的离子方程式为:
;
(5)若向气体NH3的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:
1,假设条件均为1L,发生反应:
,n(NH3•H2O)=0.1mol,n(H+)=0.1mol,所以一水合氨和硫酸反应生成硫酸铵溶液,铵根离子水解显酸性,溶液中离子浓度大小顺序为:
c(
)>c(
)>c(H+)>c(OH-)。
【点睛】
比较时溶液中粒子浓度紧扣两个微弱:
(1)弱电解质(弱酸、弱碱、水)的电离是微弱的,且水的电离能力远远小于弱酸和弱碱的电离能力,如在稀醋酸溶液中:
CH3COOH
CH3COO-+H+,H2O
OH-+H+,在溶液中微粒浓度由大到小的顺序:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-);
(2)弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度,如稀的CH3COONa溶液中:
CH3COONa=CH3COO-+Na+,CH3COO-+H2O
CH3COOH+OH-,H2O
H++OH-,所以CH3COONa溶液中:
c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)。
4.甲、乙、丙三种物质之间有如下转化关系:
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。
则甲是________(填化学式)。
写出“
”转化的离子方程式______________________。
(2)若乙溶液中加入
溶液,有血红色出现,则乙溶液中含有的离子是___________,甲的化学式为_____________。
【答案】
【解析】
【详解】
(1)甲和丙都是不溶于水的白色固体物质,按信息知甲为
、乙是硫酸铝,丙为
,则乙与氨水反应的离子方程式为:
;
(2)若乙溶液中加入
溶液,有血红色出现,则乙为硫酸铁,其溶液中含有铁离子,氧化物甲与硫酸反应得到硫酸铁溶液,因此甲为氧化铁。
【点睛】
铝离子与氨水反应的离子方程式容易出错,同学往往错误地把离子方程式写错成
。
5.工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图(金属单质E可由滤液C制取):
已知:
Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物B的成分是_____。
它与NaOH溶液反应的离子方程式为_____。
(2)滤液A中铁元素的存在形式为_____(填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____。
要检验该铁元素的离子的实验_____
(3)在滤液C中通入足量CO2的离子方程式为_____
(4)金属单质E从固体混合物F中置换出Cu的化学方程式为_____
【答案】SiO2和CuSiO2+2OH-=SiO32-+H2OFe2+Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+取少量溶液于试管中,滴加KSCN,溶液不变红,再加入氯水,溶液变为血红色,则有Fe2+OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-2Al+3CuO高温Al2O3+3Cu
【解析】
【分析】
氧化亚铜与盐酸反应生成铜和铜离子,二氧化硅与盐酸不反应,氧化铁与盐酸反应生成Fe3+,铁离子与铜反应生成亚铁离子,固体为二氧化硅和铜,滤液中含有铜离子、亚铁离子、铝离子,加入足量的氢氧化钠溶液,滤液C中含有偏铝酸根离子,金属E为铝,固体D为氢氧化铜和氢氧化铁的混合物,在空气中灼烧,F为氧化铜和氧化铁的混合物,粗铜为铜、铝、铁的混合物,经过电解可得到纯铜。
【详解】
(1)固体混合物B的成分是SiO2和Cu。
它与NaOH溶液即二氧化硅与氢氧化钠反应,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
(2)氧化亚铜与盐酸反应生成铜单质和铜离子,氧化铁与盐酸反应生成铁离子,与铜反应生成亚铁离子,有铜剩余,故铁离子完全转化为亚铁离子,滤液A中铁元素的存在形式为Fe2+,生成该离子与Fe元素有关的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+。
要检验该铁元素的离子的实验为取少量溶液于试管中,滴加KSCN,溶液不变红,再加入氯水,溶液变为血红色,则有Fe2+。
(3)在滤液C中含有偏铝酸钠和氢氧化钠,通入足量CO2的离子方程式为OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(4)金属单质E为铝,从固体混合物F为氧化铜和氧化铁的混合物,置换出Cu的化学方程式为铝热反应,2Al+3CuO高温Al2O3+3Cu。
6.以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。
已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如图:
(1)铝灰中氧化铝与硫酸反应的化学方程式为___。
(2)图中“滤渣”的主要成分为___(填化学式)。
加30%的H2O2溶液发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为___。
(4)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O]
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。
将产生的气体通过如图所示的装置。
①集气瓶中收集到的气体是___(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有__(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为___。
【答案】Al2O3+3H2SO4=Al2(SO4)3+3H2OSiO2静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。
或加KSCN溶液N2SO3、NH32MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】
【分析】
铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加入稀硫酸浸取,只有SiO2不溶而成为滤渣;加入30%H2O2,将Fe2+氧化为Fe3+,加入K4[Fe(CN)6]溶液,生成KFe[Fe(CN)6]蓝色沉淀;加入(NH4)2SO4,Al3+转化为NH4Al(SO4)2,再蒸发结晶,便可获得[NH4Al(SO4)2·12H2O,煅烧后得到
-Al2O3。
【详解】
(1)铝灰中氧化铝与硫酸反应生成硫酸铝和水,化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O。
答案为:
Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)由以上分析可知,图中“滤渣”的主要成分为SiO2。
答案为:
SiO2;
(3)验证“沉铁”后,溶液中是否还含有铁离子,可使用K4[Fe(CN)6]溶液检验,操作方法为静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。
或加KSCN溶液,观察溶液是否变为血红色;答案为:
静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。
或加KSCN溶液;
(4)煅烧后,所得气体为NH3、N2、SO3、SO2,通过NaHSO3溶液,可吸收SO3和NH3;通过KMnO4溶液,可吸收SO2,最后剩余N2和水蒸气,用排水法收集,气体主要为N2。
①集气瓶中收集到的气体是N2。
答案为:
N2;
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有SO3、NH3。
答案为:
SO3、NH3;
③KMnO4溶液褪色(MnO4-还原为Mn2+),则MnO4-与SO2反应生成Mn2+、SO42-等,发生的离子反应方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。
答案为:
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。
【点睛】
SO3通入NaHSO3溶液中,若NaHSO3溶液足量,则发生反应为SO3+2NaHSO3=Na2SO4+H2O+2SO2;若NaHSO3溶液不足量,则发生反应为SO3+NaHSO3=NaHSO4+SO2。
7.某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
请回答:
(1)步骤Ⅰ中,发生的氧化还原反应的离子方程式为___,涉及到的分离操作是___。
(2)试剂X是___;溶液D是___。
(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化___。
(4)在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。
为避免固体C减少,可采取的改进措施是___。
(5)工业上常用溶液E制取净水剂Na2FeO4,流程如图:
写出由Fe(OH)3制取Na2FeO4的离子方程式___。
(已知NaClO还原为NaCl)
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑过滤稀硫酸(或稀H2SO4;或硫酸)NaHCO3溶液(或碳酸氢钠溶液)取少量E溶液于试管中,滴入几滴硫氰化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化在通入CO2之前增加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl气体2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
【分析】
Cu、Fe和Al,少量Al2O3和Fe2O3,氢氧化钠与Al、Al2O3反应,而Cu、Fe和Fe2O3不反应,过滤得到滤渣为Cu、Fe和Fe2O3,滤液为偏铝酸钠溶液和氢氧化钠溶液,向滤液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,过滤,向沉淀中加入盐酸生成氯化铝溶液,最终得到氯化铝固体;向滤渣为Cu、Fe和Fe2O3中加入稀硫酸,生成硫酸亚铁,最终得到绿矾,过滤得到Cu,Cu与氧气、硫酸反应得到硫酸铜。
【详解】
⑴步骤Ⅰ中,发生的氧化还原反应的是铝和氢氧化钠反应生成偏铝酸钠和氢气,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,Fe、Cu、Fe2O3不和氢氧化钠溶液反应,因此涉及到的分离操作是过滤;故答案为:
2Al+2OH-+2H2O=2AlO2-+3H2↑;过滤。
⑵将Fe、Cu中Fe溶于溶液中生成硫酸亚铁,因此试剂X是硫酸;溶液A为偏铝酸钠溶液,向溶液中通入过量二氧化碳,反应生成氢氧化铝沉淀和碳酸氢钠溶液,因此D是碳酸氢钠;故答案为:
稀硫酸(或稀H2SO4;或硫酸);NaHCO3溶液(或碳酸氢钠溶液)。
⑶溶液E在空气中易被氧化,亚铁离子被氧化生成铁离子,铁离子常用KSCN溶液来检验,因此简单的实验方案检验溶液E是否被氧化的实验为取少量E溶液于试管中,滴入几滴硫氰化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化;故答案为:
取少量E溶液于试管中,滴入几滴硫氰化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化。
⑷在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,减少的主要原因是浓盐酸易挥发,挥发出的HCl与沉淀反应,为避免固体C减少,先用饱和碳酸氢钠溶液除掉挥发的HCl,再通入CO2;故答案为:
在通入CO2之前增加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl气体;故答案为:
在通入CO2之前增加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl气体。
⑸Fe(OH)3与NaClO反应生成NaCl和Na2FeO4,其制取Na2FeO4的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42−+3Cl-+5H2O;故答案为:
2Fe(OH)3+3ClO-+4OH-=2FeO42−+3Cl-+5H2O。
8.马日夫盐[Mn(H2PO4)2·H2O]主要用作磷化剂。
以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O]的化学名称为______。
在反应中,Mn2+若再失去一个电子比Fe2+再失去一个电子难,从原子结构解释其原因_______。
(2)“浸锰”过程中主要反应的离子方程式为_______。
滤渣X主要成分为_________。
检验“沉锰”已完成的实验操作及现象是_________。
步骤五产生马日夫盐晶体的化学方程式为_________。
(3)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为__________。
(4)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是__________(用相关化学用语回答)。
【答案】二水合磷酸二氢锰Mn2+外围电子为3d5的半充满稳定状态,而Fe2+外围电子为3d6,可失去一个电子变为3d5的半充满稳定状态2FeO+MnO2+8H+=2Fe3++Mn2++4H2O、SO2+MnO2=
+Mn2+Al(OH)3在上层清液中继续滴加Na2CO3溶液,若无沉淀生成则说明沉锰已经完成MnCO3+2H3PO4+H2O=Mn(H2PO4)2·2H2O+CO2↑pH=1.7下萃取60min
【解析】
【分析】
软锰矿(主要成分为MnO2,还含有少量的FeO、Al2O3和SiO2)用稀硫酸浸取,MnO2、FeO、Al2O3被溶解,同时MnO2“氧化”Fe2+,剩余的二氧化锰被通入的二氧化硫还原,反应为2FeO+MnO2+8H+=2Fe3++Mn2++4H2O、SO2+MnO2=SO42-+Mn2+,SiO2不溶,过滤,滤渣为SiO2,滤液含有:
Mn2+、Fe3+、Al3+,加入有机萃取剂,除去Fe3+,调节水层的pH除去Al3+,滤渣X为Al(OH)3,滤液主要含有硫酸锰,加入碳酸钠溶液沉锰,得到碳酸锰,碳酸锰与磷酸反应,净化得到Mn(H2PO4)2•2H2O,据此分析解答。
【详解】
(1)马日夫盐[Mn(H2PO4)2•2H2O的化学名称为二水合磷酸二氢锰;Mn2+外围电子为3d5的半充满稳定状态,而Fe2+外围电子为3d6,可失去一个电子变为3d5的半充满稳定状态,因此Mn2+若再失去