葡萄中酵母菌的筛选及菌株鉴定.docx
《葡萄中酵母菌的筛选及菌株鉴定.docx》由会员分享,可在线阅读,更多相关《葡萄中酵母菌的筛选及菌株鉴定.docx(12页珍藏版)》请在冰豆网上搜索。
葡萄中酵母菌的筛选及菌株鉴定
葡萄中酵母菌的筛选及菌株鉴定
作者:
冯炘
来源:
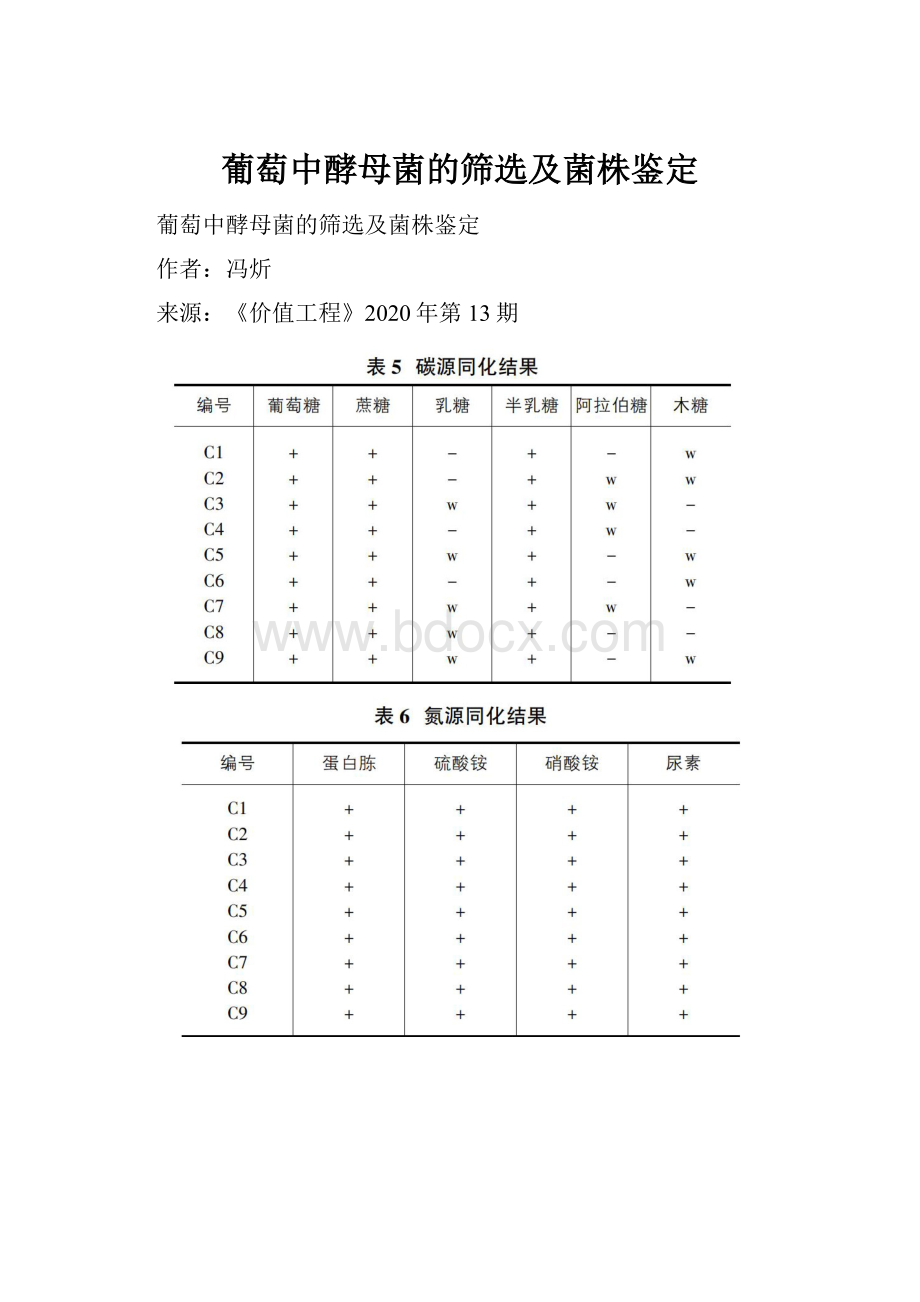
《价值工程》2020年第13期
摘要:
以葡萄为菌源,分别在葡萄发酵的前期、中期、后期取一定的发酵液进行稀释涂布,后经过YPD培养基对涂布后的菌株进行分离纯化。
将分离纯化后的菌株进行WL培养基聚类分析及生理生化实验,并用TTC培养基对菌株进行初筛,选取红色最深的菌株作为复筛菌株。
对复筛菌株进行发酵性能测定筛出发酵性能较好菌株,编号为Y1,并对此菌株进行分子生物学鉴定。
Y1菌株的26SrDNA鉴定结果表明其为酿酒酵母(Saccharomycescerevisiae),此菌株为后续发酵实验提供了基础。
Abstract:
Withgrapeasthesourceofbacteria,acertainfermentationbrothwasdilutedandcoatedintheearly,middle,andlatestagesofgrapefermentation,andthecoatedstrainwasseparatedandpurifiedbyYPDmedium.TheisolatedandpurifiedstrainsweresubjectedtoWLcultureclusteranalysisandphysiologicalandbiochemicalexperiments,andthestrainswerepre-screenedwithTTCmedium.Thereddeststrainwasselectedasthere-screeningstrain.Thefermentationperformanceofthedouble-screenedstrainwasdetermined,andthestrainwithbetterfermentationperformancewasscreenedout,andthenumberwasY1,andmolecularbiologyidentificationwasperformedonthestrain.The26SrDNAidentificationofY1strainshowedthatitwasSaccharomycescerevisiae,whichprovidedabasisforsubsequentfermentationexperiments.
关键词:
酵母菌;分离鉴定;发酵特性;生理生化
0;引言
酵母菌是一类被广泛应用在发酵工业中的单细胞真菌,它广泛分布在自然界各处[1]。
酵母菌是以芽孢繁殖为主的单细胞真核微生物,大部分的酵母菌是腐生的,生活在含糖量较高、偏酸性的环境中,如生长在花朵、植物果实表面等,还有很大一部分生活在蔬菜园、水果园园的土壤中;小部分为寄生的[2,3]。
酵母菌的生长繁殖速度较快、也比较容易分离纯化。
酵母常用于酿酒、食品制作等,是人类最早应用于生活的微生物之一。
随着人们对酵母菌研究的逐步深入,酵母菌也逐渐被应用在酶制剂、物料生产、医药工业以及环境保护等各个方面。
目前,酵母菌主要应用在构建基因工程菌、酿酒及其他发酵产业。
酿酒酵母可以发酵不同来源的植物碳水化合物,例如:
水果汁等。
葡萄果实甜度高、颗粒饱满、营养丰富,适合微生物的生长繁殖,酵母菌在有氧和无氧的环境中都能生长,即酵母菌是兼性厌氧菌,在有氧的情况下,它把糖分解成二氧化碳和水且酵母菌生长较快;在缺氧条件下,细胞进行无氧酵解,在酶的作用下,葡萄糖代谢为丙酮酸,丙酮酸在无氧条件下,在细胞内丙酮酸脱羧酶和乙醛脱氢酶作用下,生成乙醇和二氧化碳[4-6]。
微生物菌株是生产乙醇的主力军,在以木质纤维素为原材料的发酵生产乙醇的工艺中,酵母菌的筛选显得格外重要[7-10]。
本文以葡萄为菌源,通过稀释涂布、YPD分离纯化、WL培养基聚类分析、生理生化、TTC培养基初筛及菌株发酵性能测定得到發酵性能较高的菌株,为之后课题组对秸秆发酵液产乙醇的工艺提供了基础。
1;材料与方法
1.1培养基与试剂
1.1.1培养基
YPD培养基:
葡萄糖20g,蛋白胨20g,酵母浸粉10g,琼脂粉25g,蒸馏水1000mL,pH自然,115℃灭菌20min。
TTC培养基:
上层:
葡萄糖5g,2,3,5-三苯基氯化四氮唑0.5g,琼脂15g、蒸馏水1000mL;下层:
YPD琼脂培养基,121℃灭菌20min。
WL培养基:
葡萄糖50g,蛋白胨5g,酵母浸粉5g,氯化钾0.425g,磷酸二氢钾0.55g,氯化钙0.125g,氯化铁0.0025g,硫酸锰0.0025g,硫酸镁0.125g,溴甲酚绿0.022g,琼脂粉20g,蒸馏水1000ml,pH5.5,121℃灭菌20min。
活化培养基:
葡萄糖20g,蛋白胨20g,酵母浸粉10g,蒸馏水1000mL,pH自然,115℃灭菌20min。
发酵培养基:
葡萄糖40g,蛋白胨20g,酵母浸粉10g,蒸馏水1000mL,pH5.0,115℃灭菌20min。
1.1.2实验试剂
葡萄糖,蛋白胨,酵母浸粉,琼脂粉,2,3,5-三苯基氯化四氮唑,溴甲酚绿,KH2PO4,KCL,CaCL2,MgSO4,FeCL3,MnSO4,NaNO3,NaCL,CaCO3等均为分析纯。
1.1.3菌株来源
本研究的菌株分离自葡萄自然发酵的前期、中期和后期。
1.2方法
1.2.1酵母菌的分离与纯化
称50g新鲜成熟度好的葡萄,捣碎,放入50mL已灭菌的蒸馏水中,30℃静置培养。
分别于发酵的初、中、后期取一定浓度的发酵汁0.1mL,梯度稀释至10-7倍均匀涂布于YPD琼脂培养基,27℃培养48h。
随机挑取15-20个单菌落,以划线方式在YPD平板上分离纯化。
此过程重复3-5次。
菌株于4℃冰箱保存。
1.2.2菌株的WL聚类分析
将分离菌株划线接种于WL培养基上,28℃恒温培养箱培养24h,观察菌落形态及颜色,可对照《酵母菌的特征及鉴定手册》对菌株进行初步分类鉴定[11]。
1.2.3菌株的生理生化实验
根据《酵母菌的特征与鉴定手册》可知,酵母菌的生理生化实验主要包括:
氮源同化、碳源同化以及糖发酵实验[12]。
1.2.4TTC筛选法
将保藏的酵母菌株用YPD液体培养基活化后,一一对应涂布于TTC底层培养基上,在28℃恒温箱中培养48h。
待灭菌后的上层培养基已冷却为45~50℃时倒在底层培养基上,于30℃无光条件下培养2-4h后,取出立即观色,根据菌落呈色情况挑选菌种。
1.2.5酵母菌发酵性能测定
酵母菌在无氧条件下通过呼吸作用,将糖类转化为乙醇,并放出二氧化碳,以上过程可表示为C6H12O6→2C2H5OH+2CO2。
由此式可知,通过CO2产生的量可以对菌种的发酵能力进行推断,继而表征发酵效率[13]。
配制100mLYPD发酵培养基,按10%的接种量接入种子液,同时将未接种的发酵培养基作为对照,称重后放入培养条件为28℃、120r/min的摇床培养箱中,发酵过程中每隔12h取出称重,直至发酵液前后质量差与对照组质量差相当,即认为发酵终止。
计算排气前后重量差,即CO2释放量。
1.2.6菌株的分子生物学鉴定
将菌种送宝生物工程(大连)有限公司进行26srDNA区扩增及序列测定[14-16]。
根据测序结果,通过NCBI核酸序列数据库中BLAST进行相关序列搜索進行同源序列搜索,比较测序菌株与已知酵母菌相应序列的相似程度[17]。
2;结果与分析
2.1分离纯化结果
通过数代的分离纯化,共获得能在YPD培养基上良好生长的菌株9株将其统一编号为C1-C9,酵母菌形态描述见表1。
2.2镜检结果
将菌株一一对应制作成水玻片,再将制好的装片放在显微镜下进行观察,由低倍镜到高倍镜,镜检结果描述见表2。
由表2可知:
初筛得到的菌株细胞形态大多为椭圆形或圆形,另外还有少数呈柠檬形,皆为多端出芽的无性繁殖,无假菌丝出现且有子囊孢子。
2.3WL培养基聚类
生长于WL培养基上的酵母菌的菌落形态和颜色会因为种类不同而出现较明显的区别[18]。
WL培养基菌落形态见表3。
依据表3的菌落颜色及形态与《酵母菌:
特征与鉴定》第三版中的菌株特征对照,初步鉴定出C1为中间型酒香酵,C2为葡萄汁有孢汉逊酵母,C3、C6、C8为酿酒酵母菌,C4为戴尔有孢圆酵母[19,20]。
剩余菌株暂无鉴定结果。
2.4生理生化分析
由表4可知,9株菌都可以利用葡萄糖进行发酵,几乎不能利用阿拉伯糖和木糖进行发酵。
至于其它几种糖,分别呈阳性、弱阳性、阴性。
由表5可知,9株菌株均可在以葡萄糖、蔗糖和半乳糖为碳源的液体培养基中生长,呈阳性;至于乳糖、阿拉伯糖、木糖则呈阳性、弱阳性、阴性等。
由表6可看出,这9株不同菌株都可以在以蛋白胨、硫酸铵、硝酸铵或尿素的培养基上生长,且生长状况良好,呈阳性。
2.5TTC筛选结果
TTC平板显色结果如图1所示。
比较图1中的显色结果可知,C2、C5、C7培养基中菌落呈现深红色,其余的则偏粉红色和浅白色。
将显色反应更为明显即显色后颜色更为深红的菌株划线分离后并将其分别重新编号得到Y1、Y2、Y3,筛得的3株菌株即为发酵产乙醇能力较强的菌株。
2.6CO2释放量测定
由图2可知,3株酵母菌的CO2释放量均随着发酵时间的增加而逐渐减少,即在发酵过程的前24h时,发酵效率最大,随后产生的CO2含量减少,即单位时间发酵产生的乙醇含量减少。
因此前24h的CO2释放量作为发酵效率高低的比较指标。
图中Y1在24h时的CO2释放量明显高于其它两株菌,初步推断Y1菌株的发酵效率高于其它两株。
2.7分子生物学鉴定结果
使用MEGA-X软件进行多序列对位排列,并采用N-J方法构建系统发育树,分离菌株Y1与标准菌株SaccharomycescerevisiaeNRRLY-12632的同源性超过99%,表明其具有较近的亲缘性。
菌株Y1鉴定为酿酒酵母(Saccharomycescerevisiae)。
3;结论
通过YPD培养基分离纯化出9株酵母菌,分别编号为C1-C9。
对9株酵母菌进行碳源同化、氮源同化和糖发酵实验。
结果表明,9株酵母菌都可以利用葡萄糖进行发酵,几乎不能利用阿拉伯糖和木糖进行发酵,且均可在以葡萄糖、蔗糖和半乳糖为碳源的液体培养基和以蛋白胨、硫酸铵、硝酸铵或尿素的培养基上生长,生长状况良好,呈阳性。
通过WL培养基聚类分析初步判断C3、C6、C8为酿酒酵母(Saccharomycescerevisiae)、C4为戴尔有孢圆酵母(Torulasporadebrueckii)、C2为葡萄汁有孢汉逊酵母(Hanseniasporauvarum),其它菌株暂无分类结果。
通过TTC培养基筛选出3株乙醇高产菌株,重新命名为Y1、Y2、Y3。
通过CO2释放量测定表明Y1的发酵性能最。
通过对Y1菌株的分子生物学鉴定表明,分离菌株Y1与标准菌株的同源性超过99%,表明其具有较近的亲缘性,菌株Y1鉴定为酿酒酵母(Saccharomycescerevisiae)。
参考文献:
[1]杨清香,王哲.酵母菌在自然界中的生态分布及功能[J].环境科学与技术,2009(4):
92-97.
[2]崔小亮,邵小兵,钟和平,等.多粮浓香型白酒生产过程中可培养酵母菌多样性分析与优质功能菌筛选[J].中国酿造,2019,38(7):
105-110.
[3]李海涛,刘艳环,苗利光,等.东北山葡萄酿酒酵母的分离与鉴定[J].特产研究,2019(3):
27-30.
[4]HeinzK.Renewableresources:
Buildabiomassenergymarket[J].Nature.2013,494(7435):
29.
[5]ZhaoW,ZhaoF,ZhangS,etal.Ethanolproductionbysimultaneoussaccharificationandcofermentationofpretreatedcornstalk[J].Journalofbasicmicrobiology.2019,59(7):
744-753.
[6]陈燕,王小芬,金伟,等.产纤维素酶霉菌的筛选及初步鉴定[J].武汉轻工大学学报,2011,30(3):
6-8.
[7]TalebniaF,MighaniM,RahimnejadM,etal.Ethanolproductionfromsteamexplodedrapeseedstrawandtheprocesssimulationusingartificialneuralnetworks[J].BiotechnologyandBioprocessEngineering.2015,20
(1):
139-147.
[8]XiaJ,YangY,LiuCG,etal.EngineeringZymomonasmobilisforRobustCellulosicEthanolProduction[J].Trendsinbiotechnology.2019,37(9):
960-972.
[9]HuangD,WangM,GuanG,etal.EthanolproductionfromcornstoverusingmixedculturesofZymomonasmobilisandCandidashehatae[J].FoodandFermentationIndustries.2017,43
(1):
31-36.
[10]ZhaoC,ZouZ,LiJ,etal.Anovelandefficientbioprocessfromsteamexplodedcornstovertoethanolinthecontextofon-sitecellulaseproduction[J].Energy.2017,123:
499-510.
[11]刘爱国.宁夏贺兰山东麓葡萄酿酒酵母菌的分离及其分类鉴定[D].西北农林科技大学,2008.
[12]陶森,王雅玲,叶林,等.腌鱼中耐盐酵母菌的分离鉴定及其生理生化特性[J].食品工业科技,2019,40(02):
136-141,147.
[13]张本旭,于红霞,李夏云,等.海葵基底附生酵母的分离鉴定与乙醇发酵效率研究[J].酿酒科技,2019(8):
33-39.
[14]曹亚璞,王豪杰,白斌锦,等.拉萨市蔡公堂乡大棚果蔬酵母菌的分离与鉴定[J].保鲜与加工,2019,019(001):
140-146.
[15]LiuXZ,WangQM,GokerM.TowardsanintegratedphylogeneticclassificationoftheTremellomycetes[J].StudiesinMycology.2015,81:
85-147.
[16]NisiotouAA,SpiropoulosAE,NychasG-JE.YeastCommunityStructuresandDynamicsinHealthyandBotrytis-AffectedGrapeMustFermentations[J].Applied&EnvironmentalMicrobiology.2007,73(21):
6705-6713.
[17]HeshamAEL,AlrummanSA,Al-DayelMA,etal.Screeningandgeneticidentificationofacidicandneutralprotease-producingyeastsstrainsby26SrRNAgenesequencing[J].Cytology&Genetics.2017,51(3):
221-229.
[18]周春艷,张秀玲,王冠蕾.酵母菌的5种鉴定方法[J].中国酿造,2006(08):
55-58.
[19]PallmannCL,BrownJA,OlinekaTL,etal.UseofWLMediumtoProfileNativeFloraFermentations[J].2016,52(3):
198-203.
[20]杨莹,徐艳文,薛军侠,等.WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J].微生物学杂志,2007(5):
81-84.