中国药物分类标准.docx
《中国药物分类标准.docx》由会员分享,可在线阅读,更多相关《中国药物分类标准.docx(9页珍藏版)》请在冰豆网上搜索。
中国药物分类标准
中国药物分类标准
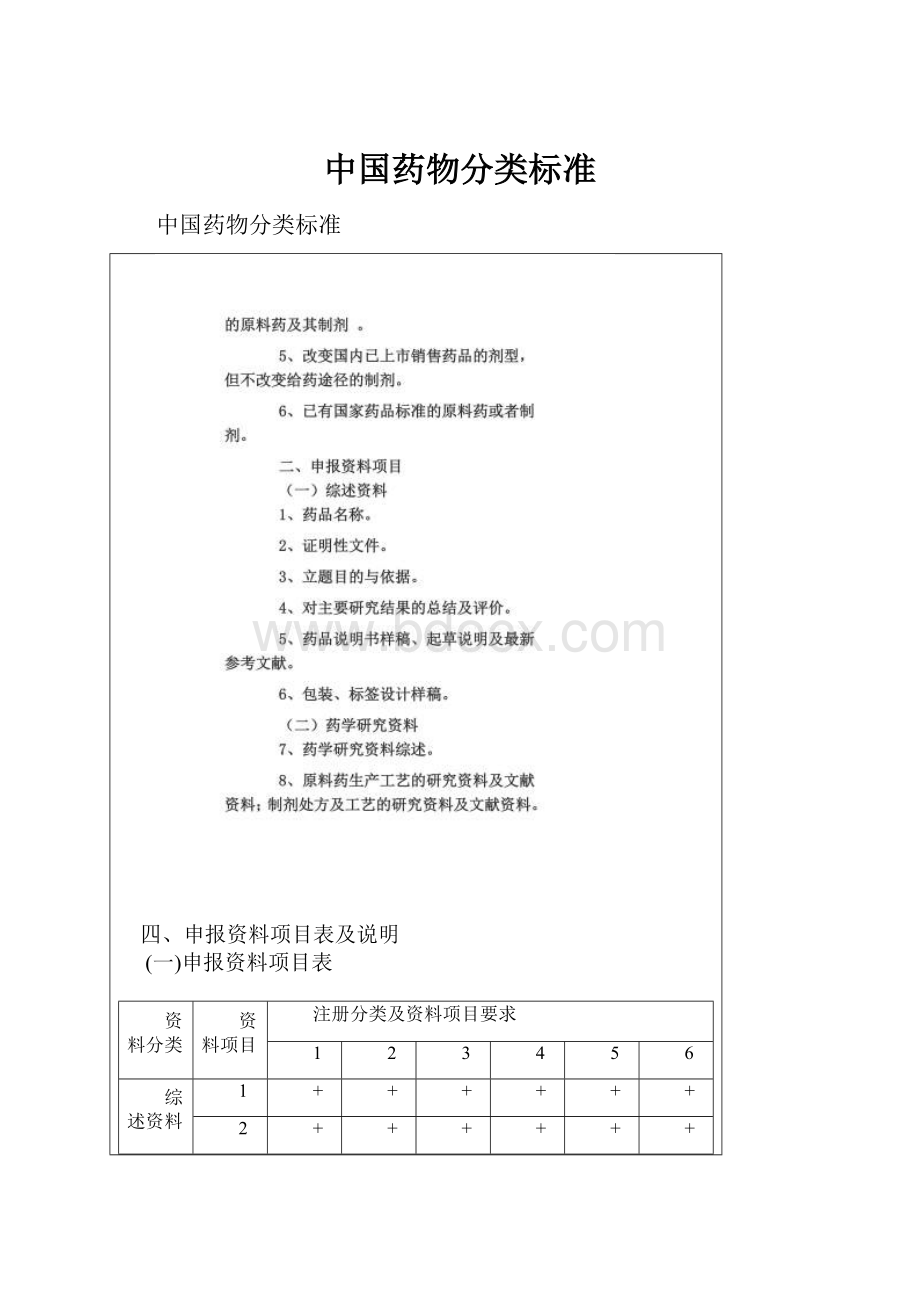
四、申报资料项目表及说明
(一)申报资料项目表
资料分类
资料项目
注册分类及资料项目要求
1
2
3
4
5
6
综述资料
1
+
+
+
+
+
+
2
+
+
+
+
+
+
3
+
+
+
+
+
+
4
+
+
+
+
+
+
5
+
+
+
+
+
+
6
+
+
+
+
+
+
药学研
究资料
7
+
+
+
+
+
+
8
+
*5
+
+
*5
*5
9
+
+
+
+
-
+
10
+
+
+
+
+
+
11
+
+
+
+
+
+
12
+
+
+
+
+
+
13
+
+
+
+
+
+
14
+
+
+
+
+
+
15
+
+
+
+
+
+
药理毒理研究资料
16
+
+
+
+
+
+
17
+
*16
±
*18
-
-
18
+
*16
±
*18
-
-
19
+
*16
±
*18
-
-
20
+
*16
±
*18
-
-
21
*19
*19
*19
*19
*19
*19
22
*13
-
-
-
-
-
23
+
±
±
±
-
-
24
+
±
±
±
-
-
25
*8
-
*8
*8
-
-
26
*9
-
-
-
-
-
27
+
*20
-
+
*20
-
临床研究资料
28
+
+
+
+
+
+
29
+
+
+
+
+
△
30
+
+
+
+
+
△
31
+
+
+
+
+
△
32
+
+
+
+
+
△
注:
1、“(”:
指必须报送的资料;
2、“(”:
指可以用文献综述代替试验资料
3、“(”:
指可以免报的资料;
4、“*”:
按照说明的要求报送资料,如*8,指见说明之第8条。
5、“△”:
按照本附件“五、临床研究要求”中第4条执行。
(二)说明
1、注册分类1~5的品种为新药,注册分类6的品种为已有国家标准的药品。
2、申请注册新药,按照《申报资料项目表》的要求报送资料项目1~30(资料项目6除外);临床研究完成后报送的资料项目包括重新整理的综述资料1~6、资料项目12和14、临床研究资料28~32以及其他变更和补充的资料,并按申报资料项目顺序排列。
3、申请注册已有国家标准的药品,按照《申报资料项目表》的要求报送资料项目1~16和28-30。
需进行临床研究的,在临床研究完成后报送资料项目12和资料项目28~32以及其他变更和补充的资料,并按申报资料项目顺序排列。
4、申请注册已有国家标准的药品,原料药质量研究资料应当包括与已上市销售的原料药进行各项测试对比的数据,如有关晶型、异构体及生产工艺中带入的原标准规定以外杂质的质控数据。
对于不能用理化手段测定结构和纯度的药品,其原材料和生产工艺应当与已上市销售药品相同。
制剂的质量研究资料,应当与已上市销售药品进行各项测试对比,口服固体制剂应当提供溶出度、释放度等项目的比较研究资料。
5、单独申请药物制剂,必须提供原料药的合法来源证明文件,包括原料药生产企业的《营业执照》、《药品生产许可证》、《药品生产质量管理规范》认证证书、销售发票、检验报告书、药品标准等资料复印件。
使用进口原料药的,应当提供《进口药品注册证》或者《医药产品注册证》、口岸药品检验所检验报告书、药品标准等复印件。
所用原料药不具有药品批准文号、《进口药品注册证》或者《医药产品注册证》的,必须经国家药品监督管理局批准。
6、同一活性成份制成的小水针、粉针剂、大输液之间互相改变的药品注册申请,应当由具备相应剂型生产范围的药品生产企业申报。
7、对用于育龄人群的药物,应当根据其适应症和新药特点(如避孕药、性激素、性功能障碍治疗药、促精子生成药、致突变试验阳性或者有细胞毒作用的新药)报送相应的生殖毒性研究资料。
8、下列新药应当报送致癌试验资料:
(1)新药或其代谢产物的结构与已知致癌物质的结构相似的;
(2)在长期毒性试验中发现有细胞毒作用或者对某些脏器、组织细胞生长有异常促进作用的;
(3)致突变试验结果为阳性的。
9、作用于中枢神经系统的新药,如镇痛药、抑制药、兴奋药以及人体对其化学结构具有依赖性倾向的新药,应当报送药物依赖性试验资料。
10、属注册分类1的新药,可以在重复给药毒性试验过程中进行毒代动力学研究。
11、属注册分类1中“用拆分或合成等方法制得的已知药物中的光学异构体及其制剂”,应当报送消旋体与单一异构体比较的药效学、药代动力学和毒理学(一般为急性毒性)研究资料或者相关文献资料。
在其消旋体安全范围较小、已有相关资料可能提示单一异构体的非预期毒性(与药理作用无关)明显增加时,还应当根据其临床疗程和剂量、适应症、以及用药人群等因素综合考虑,提供单一异构体的重复给药毒性(一般为3个月以内)或者其他毒理研究资料(如生殖毒性)。
12、属注册分类1中“由已上市销售的多组份药物制备为较少组份的药物”,如其组份中不含有本说明8所述物质,可以免报资料项目23~25。
13、属注册分类1中“新的复方制剂”,应当报送资料项目22。
14、属注册分类1中“新的复方制剂”,如长期毒性试验显示其毒性不增加,毒性靶器官也未改变,可免报资料项目27。
15、属注册分类1中“新的复方制剂”,如其动物药代动力学研究结果显示无重大改变的,可免报资料项目23~25。
16、属注册分类2的新药,其药理毒理研究所采用的给药途径应当与临床拟用途径一致。
必要时应当提供与原途径比较的药代动力学试验或者相关的毒理研究资料(如局部毒性试验或者重复给药毒性试验)。
17、属注册分类3中“改变给药途径,已在境外上市销售的制剂”,主要应当重视制剂中的辅料对药物吸收或者局部毒性产生的影响,必要时提供其药代动力学试验或者相关毒理研究资料。
18、属注册分类4的新药,应当提供与已上市销售药物比较的药代动力学、主要药效学、一般药理学和急性毒性试验资料,以反映改变前后的差异,必要时还应当提供重复给药毒性和其他药理毒理研究资料。
如果改变已上市销售盐类药物的酸根、碱基(或者金属元素)而制成的药物已在国外上市销售,则按注册分类3的申报资料要求办理。
19、局部用药除按所属注册分类及项目报送相应资料外,应当报送资料项目21,必要时应当进行局部吸收试验。
20、速释、缓释、控释制剂应当同时提供与普通制剂比较的单次或者多次给药的动物药代动力学研究资料。
五、临床研究要求
1、属注册分类1和2的新药,应当进行临床试验。
(1)临床试验的病例数应当符合统计学要求和最低病例数要求;
(2)临床试验的最低病例数(试验组)要求:
I期为20至30例,II期为100例,III期为300例,IV期为2000例;
(3)避孕药的I期临床试验应当按照本办法的规定进行;II期临床试验应当完成至少100对6个月经周期的随机对照试验;III期临床试验完成至少1000例12个月经周期的开放试验;IV期临床试验应当充分考虑该类药品的可变因素,完成足够样本量的研究工作。
2、属注册分类3和4的新药,应当进行人体药代动力学研究和至少100对随机对照临床试验。
多个适应症的,每个主要适应症的病例数不少于60对。
3、属注册分类5的新药,临床研究按照下列原则进行:
(1)口服固体制剂应当进行生物等效性试验,一般为18至24例;
(2)难以进行生物等效性试验的口服固体制剂及其他非口服固体制剂,应当进行临床试验,临床试验的病例数至少为100对;
(3)速释、缓释、控释制剂应当进行单次和多次给药的人体药代动力学的对比研究和临床试验,临床试验的病例数至少为100对;
(4)同一活性成份制成的小水针、粉针剂、大输液之间互相改变的药品注册申请,给药途径和方法、剂量等与原剂型药物一致的,一般可以免临床研究。
4、对于注册分类6中的口服固体制剂,可仅进行生物等效性试验,一般为18至24例;难以进行生物等效性试验的,可仅进行溶出度、释放度比较试验。
注射剂等其他非口服固体制剂,所用辅料和生产工艺与已上市销售药品一致的,可以免临床研究。
5、临床试验对照药品应当是已在国内上市销售的药品。
六、进口化学药品申报资料和要求
(一)申报资料项目要求
1、申报资料按照化学药品《申报资料项目》要求报送。
申请未在国内外获准上市销售的药品,按照注册分类1的规定报送资料;其他品种按照注册分类3的规定报送资料。
2、资料项目5药品说明书样稿、起草说明及最新参考文献,尚需提供生产国家或者地区药品管理机构核准的原文说明书,在生产国家或者地区上市使用的说明书实样,并附中文译本。
资料项目6尚需提供该药品在生产国家或者地区上市使用的包装、标签实样。
3、资料项目28应当报送该药品在生产国家或者地区为申请上市销售而进行的全部临床研究的资料。
4、全部申报资料应当使用中文并附原文,其他文种的资料可附后作为参考。
中文译文应当与原文内容一致。
5、药品标准的中文本,必须符合中国国家药品标准的格式。
(二)资料项目2证明性文件的要求和说明
1、资料项目2证明性文件包括以下资料:
(1)生产国家或者地区药品管理机构出具的允许药品上市销售及该药品生产企业符合药品生产质量管理规范的证明文件、公证文书及其中文译本。
申请未在国内外获准上市销售的药物,本证明文件可于完成在中国进行的临床研究后,与临床研究报告一并报送;
(2)由境外制药厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件。
境外制药厂商委托中国代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国代理机构的《营业执照》复印件;
(3)申请的药物或者使用的处方、工艺等专利情况及其权属状态说明,以及对他人的专利不构成侵权的保证书。
2、说明:
(1)生产国家或者地区药品管理机构出具的允许药品上市销售及该药品生产企业符合药品生产质量管理规范的证明文件应当符合世界卫生组织推荐的统一格式。
其他格式的文件,必须经所在国公证机关公证及驻所在国中国使领馆认证;
(2)在一地完成制剂生产由另一地完成包装的,应当提供制剂厂和包装厂所在国家或地区药品管理机构出具的该药品生产企业符合药品生产质量管理规范的证明文件;
(3)未在生产国家或者地区获准上市销售的,可以提供在其他国家或者地区获准上市销售的证明文件,并须经国家药品监督管理局认可。
但该药品生产企业符合药品生产质量管理规范的证明文件由生产国家或者地区药品管理机构出具;
(4)原料药可提供生产国家或者地区药品管理机构出具的允许药品上市销售及该药品生产企业符合药品生产质量管理规范的证明文件,也可提供该原料药主控系统文件DMF(DrugMasterFile)的资料和文件。
(三)在中国进行临床研究的要求
1、申请未在国内外获准上市销售的药物,应当按照注册分类1的规定进行临床研究。
所申请的药物,应当是已在国外进入II期或者III期临床试验的药物。
2、申请已在国外上市销售但尚未在中国境内上市销售的药品,应当按照注册分类3的规定进行临床研究。
3、申请已有国家药品标准的原料药或者制剂,如果其资料项目28符合要求,可以按照注册分类6的规定进行临床研究;不符合要求的,应当按照注册分类3的规定进行临床研究。
4、单独申请进口尚无中国国家药品标准的原料药,应当使用其制剂进行临床研究。
七、放射性药品申报资料和要求
(一)申报资料项目要求
1、申请放射性药品,应当按照核素、原料药、药盒及制剂分别组织申报资料,并按照化学药品相应类别及《申报资料项目》要求报送,其中资料项目22、26可以免报。
2、申请诊断用放射性药品,可免报资料项目23、24、25。
3、申请放射性核素、原料药及药盒,可免报资料项目18。
(二)申报资料项目说明
1、资料项目8按下列要求报送:
(1)放射性药品中的放射性核素,应当提供该核素的生产方式的选定、照射条件、核反应式、辐照后靶材料的化学处理工艺(附化学反应式及工艺流程图),详细操作步骤,可能产生的放射性核杂质,精制(纯化)方法,靶材料和其他所用化学试剂的规格标准及分析测试数据,国内外有关文献资料;
(2)放射性药品中原料药如为化学合成,应当提供合成路线的选定,合成工艺流程的详细化学反应式,反应条件和详细操作步骤,注明投料量、收得率及可能产生或夹杂的杂质,各步中间体质控方法,最终产品精制(纯化)的方法,原料的质量标准,国内外有关文献资料;
(3)放射性药品中的药盒,应当提供药盒的选定及其制备工艺、路线、反应条件、操作步骤的试验依据,各组分原料药应是药用规格并提供质量标准;
(4)非药盒类放射性药品,应当提供合成路线、反应条件、操作步骤、精制或纯化的方法、原料的质量标准及分析测试数据及有关文献资料。
2、资料项目9按下列要求报送:
(1)放射性药品中的放射性核素若《中国药典》尚未收载,应当提供该核素的衰变纲图,确证具核性质的试验数据(或图谱)以及与国内外公认的该核素的核性质进行比较的试验资料及文献资料;
(2)放射性药品中的原料药如为化学合成,应当提供确证其化学结构的试验数据,包括元素分析、红外吸收光谱、紫外吸收光谱、核磁共振谱、质谱等资料。
各图谱应为原图的复印件或照片(要求清晰尺寸适当)并附各图谱的峰位解析表及详细的文字解析。
各图谱应注明使用仪器的型号、测试条件、供试品的批号、样品浓度、所用溶剂、内标物等并进行综合解析;
(3)放射性药品中的药盒,应当提供药盒的详细组分及其用量,并说明各组分在药盒中的作用;
(4)非药盒类放射性药品,应当提供确证其化学结构的试验数据,如确有困难,应说明理由,并进行合理推断可能的化学结构或引用文献依据。
3、资料项目10按下列要求报送:
(1)放射性药品中的放射性核素(除《中国药典》收载外),应当提供放射性核纯度及主要核杂质的含量、放射性活度、化学纯度、溶液pH值等的测试方法,试验数据及规定限度的依据;
(2)放射性药品中的原料药,应当根据样品的特性和具体情况,确定理化常数研究项目(如熔点、比旋度、粘度、吸收系数等)。
纯度检查内容(如氯化物、重金属、反应中间体、副产物或残留溶剂等)以及含量测定方法筛选过程与方法确定的依据等,并提供详细测试方法与测定数据;
(3)放射性药品中的药盒,应当提供性状、鉴别、溶液的澄清度与颜色、酸(碱)度等分析测试方法、原理及数据,其中原料药、还原剂或氧化剂,或其他主要添加剂含量测定方法的选定及试验研究数据。
药盒的无菌、细菌内毒素检查方法及限度的研究资料;
(4)非药盒类放射性药品,应当提供理化性质、性状、鉴别方法及原理、pH值、放射性核纯度(包括主要核杂质)、放射化学纯度、放射性活度、化学纯度。
若为注射液,应当提供无菌、细菌内毒素检查方法、数据、规定限度的依据等资料。
4、资料项目14按下列要求报送:
(1)放射性核素溶液可以性状、pH值、放射化学纯度、放射性核纯度等为考察指标;
(2)原料药可以性状、熔点、降解产物、含量等为考察指标;
(3)药盒可以性状、放射化学纯度、还原剂或氧化剂含量(颗粒度)等为考察指标;
(4)药品制剂可以性状、pH值、放射化学纯度等为考察指标。
5、资料项目17按下列要求报送:
(1)诊断用放射性药品,应当提供家兔、狗或灵长类的靶器官及全身平面显像或模拟临床功能测定试验的研究方法、试验条件和结果解释等资料,试验观察各时限的显像或功能测定结果的图像照片或其复印件;
(2)治疗用放射性药品,应当提供治疗主要适应症的动物模型,以大、中、小三个剂量组并设阳性药对照组,观察实验动物反应情况的试验资料,并提供本品或同类药物国内外有关药效学研究的详细文献资料。
放射性核素、原料药及药盒作为原料药不报送本项资料。
6、资料项目19按下列要求报送:
除注册分类1和3放射性药品的原料药,应当进行小鼠急性毒性外,放射性核素、药盒及制剂可进行异常毒性试验,方法及判定标准应当符合《中国药典》附录“异常毒性检查法”,供试品的给药剂量可根据临床用量(放射性活度与体积)的一定倍数计算。
若原料药的合成精制产量有限,临床用量又极微,也可采用异常毒性试验。
7、资料项目20按下列要求报送:
(1)属注册分类1的放射性药品,应当提供大鼠和狗的长期毒性试验资料及医学内照射吸收剂量(MIRD)的试验资料或文献资料;
(2)属注册分类1的诊断、治疗用放射药品,应当提供药品中放射性核素完全衰变后的内照射吸收剂量,人体靶器官和非靶器官的吸收剂量的估算或国外相同或同类药物的文献资料。
(三)临床研究要求
放射性药品的临床研究,按照化学药品相应类别的要求进行。