高考电极反应式的书写专题训练.docx
《高考电极反应式的书写专题训练.docx》由会员分享,可在线阅读,更多相关《高考电极反应式的书写专题训练.docx(31页珍藏版)》请在冰豆网上搜索。
高考电极反应式的书写专题训练
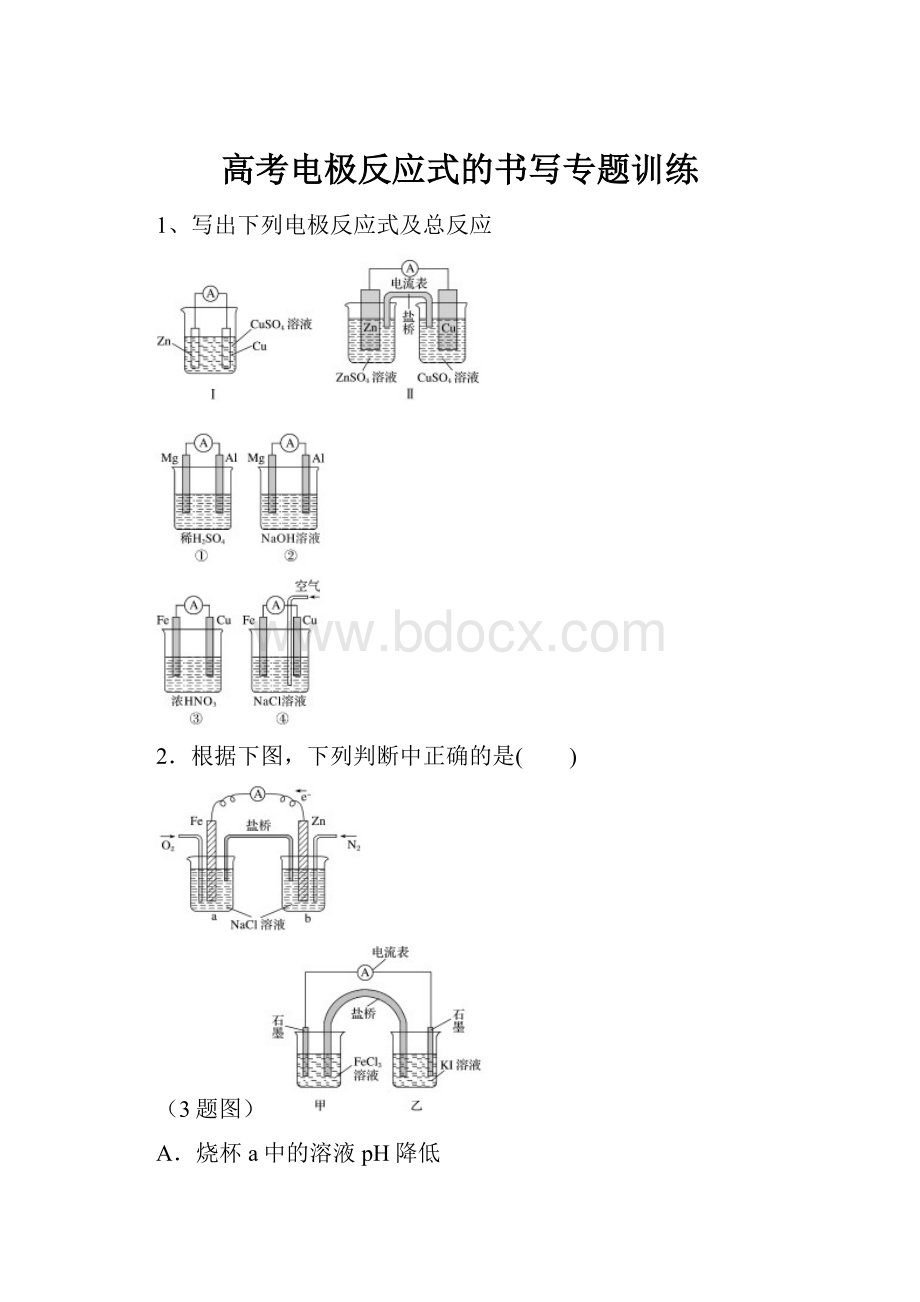
1、写出下列电极反应式及总反应
2.根据下图,下列判断中正确的是( )
(3题图)
A.烧杯a中的溶液pH降低
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2↑
D.烧杯b中发生的反应为2Cl--2e-===Cl2↑
3.控制适合的条件,将反应2Fe3++2I-≒2Fe2++I2设计成如下图所示的原电池。
下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流表读数为零时,反应达到化学平衡状态
D.电流表读数为零后,在甲中加入FeCl2固体,乙中的石墨电极为负极
4.银器日久表面会逐渐变黑,这是因为生成了硫化银。
有人设计用原电池原理进行“抛光”,其处理方法:
将一定浓度的氯化钠溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去,而银器恢复光泽,且不会损失。
试回答:
(1)氯化钠溶液的作用是________________________________________________。
(2)在此原电池反应中,负极发生的电极反应为___________________,正极发生的电极反应为
________________________________________________________________________。
(3)反应过程中产生臭鸡蛋气味的气体,溶液中发生的反应为________________________,原电池总反应方程式为________________________________________________________________________。
答案
(1)为电解质溶液,起导电作用
(2)2Al-6e-===2Al3+ 3Ag2S+6e-===6Ag+3S2-
(3)2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑ 3Ag2S+2Al+6H2O===6Ag+2Al(OH)3↓+3H2S↑
5、铅蓄电池是最常见的二次电池,负极材料是,正极材料是。
①放电时的反应
a.负极反应:
b.正极反应:
c.总反应:
②充电时的反应
a.阴极反应:
b.阳极反应:
c.总反应:
6、以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法。
(1)酸性条件
总反应式:
______________________________________________________________;
正极反应式:
________________________________________________________________;
负极反应式:
________________________________________________________________。
(2)碱性条件
总反应式:
__________________________________________________________________;
正极反应式:
_______________________________________________________________;
负极反应式:
________________________________________________________________。
(3)固体电解质(高温下能传导O2-)
总反应式:
__________________________________________________________________;
正极反应式:
_________________________________________________________________;
负极反应式:
____________________________________________________________。
(4)熔融碳酸盐(如熔融K2CO3)环境下
总反应式:
___________________________________________________________________;
正极反应式:
_______________________________________________________________;
负极反应式:
__________________________________________________________________。
答案
(1)CH4+2O2===CO2+2H2O2O2+8H++8e-===4H2OCH4-8e-+2H2O===CO2+8H+
(2)CH4+2O2+2OH-===CO
+3H2O2O2+4H2O+8e-===8OH-CH4+10OH--8e-===CO
+7H2O
(3)CH4+2O2===CO2+2H2O2O2+8e-===4O2-CH4+4O2--8e-===CO2+2H2O
(4)CH4+2O2===CO2+2H2O2O2+4CO2+8e-===4CO
CH4+4CO
-8e-===5CO2+2H2O
7.普通锌锰干电池的简图如图所示,它是用锌皮制成的锌筒作电极,中央插一根碳棒,碳棒顶端加一铜帽。
在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液。
该电池工作时的总反应为Zn+2NH
+2MnO2===[Zn(NH3)2]2++Mn2O3+H2O。
下列关于锌锰干电池的说法中正确的是( )
(8题图)
A.当该电池电压逐渐下降后,利用电解原理能重新充电复原
B.电池负极反应式为2MnO2+2NH
+2e-===Mn2O3+2NH3+H2O
C.原电池工作时,电子从负极通过外电路流向正极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
8.锂锰电池的体积小、性能优良,是常用的一次电池。
该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
回答下列问题:
(1)外电路的电流方向是由________(填字母,下同)极流向________极。
(2)电池正极反应式为_____________________________________________________。
(3)是否可用水代替电池中的混合有机溶剂?
______(填“是”或“否”),原因是________________________。
答案
(1)b a
(2)MnO2+e-+Li+===LiMnO2
(3)否 电极Li是活泼金属,能与水反应
9.乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应:
C2H5OH+3O2===2CO2+3H2O,电池示意图如图所示。
下列说法中正确的是( )
A.电池工作时,质子向电池的负极迁移
B.电池工作时,电子由b极沿导线流向a极
C.a极上发生的电极反应:
C2H5OH+3H2O+12e-===2CO2+12H+
D.b极上发生的电极反应:
4H++O2+4e-===2H2O
10.科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。
质子膜H2S燃料电池的结构示意图如下图所示。
下列说法错误的是( )
A.电极a为电池的负极
B.电极b上发生的电极反应:
O2+4H++4e-===2H2O
C.电路中每通过4mol电子,在正极消耗44.8LH2S
D.每17gH2S参与反应,有1molH+经质子膜进入正极区
11.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。
已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2,有关该电池的说法正确的是( )
A.充电时阳极反应:
Ni(OH)2+OH--e-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
12.锌—空气燃料电池可作电动车的动力电源,电解质溶液为KOH溶液,反应为2Zn+O2+2H2O+4OH-===2Zn(OH)
。
下列说法正确的是( )
A.放电时,电解质溶液中K+移向负极
B.放电时,电解质溶液的pH不变
C.充电时,阴极的反应为Zn(OH)
+2e-===Zn+4OH-
D.充电时,当有4.48L氧气(标准状况下)释放出来时,则析出固体Zn为13g
微专题
新型电源及电极反应式的书写
近几年高考中的新型电池种类繁多,“储氢电池”“高铁电池”“海洋电池”“燃料电池”“锂离子电池”等,这些新型电源常以选择题的形式呈现。
解析这类考题,首先要理解常见的化学电源种类及原电池的工作原理,其次会判断正负电极或阴阳极,以及会书写电极反应式等。
1.电极反应式书写的一般步骤(类似氧化还原反应方程式的书写)
2.已知总方程式,书写电极反应式
(1)书写步骤
①步骤一:
写出电池总反应式,标出电子转移的方向和数目(ne-)。
②步骤二:
找出正、负极,失电子的电极为负极;确定溶液的酸碱性。
③步骤三:
写电极反应式。
负极反应:
还原剂-ne-===氧化产物
正极反应:
氧化剂+ne-===还原产物
(2)书写技巧
若某电极反应式较难写时,可先写出较易的电极反应式,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。
如:
CH3OCH3(二甲醚)酸性燃料电池中:
总反应式:
CH3OCH3+3O2===2CO2+3H2O
正极:
3O2+12H++12e-===6H2O
负极:
CH3OCH3+3H2O-12e-===2CO2+12H+
特别提醒 简单电极反应中转移的电子数,必须与总方程式中转移的电子数相同。
3.氢氧燃料电池在四种常见介质中的电极反应总结
负极
正极
专题训练
1.(燃料电池)(2018·安顺模拟)有一种MCFC型燃料电池,该电池所用燃料为H2,电解质为熔融的K2CO3。
电池的总反应为2H2+O2===2H2O,负极反应:
H2+CO
-2e-===H2O+CO2。
下列说法正确的是( )
A.电路中的电子经正极、熔融的K2CO3、负极后再到正极,形成闭合回路
B.电池放电时,电池中CO
的物质的量将逐渐减少
C.正极反应为2H2O+O2+4e-===4OH-
D.放电时CO
向负极移动
2.Li—SOCl2电池可用于心脏起搏器。
该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。
电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为______________________________。
(2)电池正极发生的电极反应为______________________________________________。
答案
(1)锂 4Li-4e-===4Li+
(2)2SOCl2+4e-===4Cl-+S+SO2↑
3.Mg—AgCl电池是一种能被海水激活的一次性贮备电池,电池总反应方程式为2AgCl+Mg===Mg2++2Ag+2Cl-,试书写该电池的正、负极电极反应式。
答案 负极:
Mg-2e-===Mg2+
正极:
2AgCl+2e-===2Ag+2Cl-
4.铝—空气海水电池:
以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。
电池总反应为4Al+3O2+6H2O===4Al(OH)3;
负极:
________________________________________________________________________;
正极:
________________________________________________________________________。
答案 4Al-12e-===4Al3+ 3O2+6H2O+12e-===12OH-
5.一种碳纳米管能够吸附氢气,可作二次电池(如下图所示)的碳电极。
该电池的电解质溶液为6mol·L-1的KOH溶液。
(1)写出放电时的正、负极电极反应式。
答案 负极:
H2-2e-+2OH-===2H2O;
正极:
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-。
(2)写出充电时的阴、阳极电极反应式。
答案 阴极:
2H2O+2e-===H2↑+2OH-;
阳极:
2Ni(OH)2+2OH--2e-===2NiO(OH)+2H2O。
1.(2016·全国卷Ⅱ,11)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是( )
A.负极反应式为Mg-2e-===Mg2+
B.正极反应式为Ag++e-===Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
2.(2017·全国卷Ⅲ,11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+xS8===8Li2Sx(2≤x≤8)。
下列说法错误的是( )
A.电池工作时,正极可发生反应:
2Li2S6+2Li++2e-===3Li2S4
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
3.(2016·全国卷Ⅲ,11)锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)
。
下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为Zn+4OH--2e-===Zn(OH)
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
4.(2015·全国卷Ⅰ,11)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
5.(2015·天津理综,4)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO
)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
6.
(1)[2016·北京理综,26
(1)]用零价铁(Fe)去除水体中的硝酸盐(NO
)已成为环境修复研究的热点之一。
Fe还原水体中的NO
的反应原理如图所示。
①作负极的物质是________。
②正极的电极反应式是__________________________________________________。
(2)[2013·北京理综,26(4)]通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:
__________________________________________________。
答案
(1)①铁 ②NO
+8e-+10H+===NH
+3H2O
(2)①还原 ②NO+O2--2e-===NO2
第22讲 电解池 金属的电化学腐蚀与防护
1.按要求书写电极反应式和总反应方程式:
(1)用惰性电极电解MgCl2溶液
阳极反应式:
____________________________________________________________;
阴极反应式:
__________________________________________________________________;
总反应离子方程式:
___________________________________________________________。
(2)用Al作电极电解NaOH溶液
阳极反应式:
______________________________________________________________;
阴极反应式:
_________________________________________________________________;
总反应离子方程式:
______________________________________________________________。
答案
(1)2Cl--2e-===Cl2↑Mg2++2H2O+2e-===H2↑+Mg(OH)2↓
Mg2++2Cl-+2H2OMg(OH)2↓+Cl2↑+H2↑
(2)2Al-6e-+8OH-===2AlO
+4H2O 6H2O+6e-===3H2↑+6OH-(或6H++6e-===3H2↑)
2Al+2H2O+2OH-2AlO
+3H2↑
(3)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:
____________________________________________________________;
阴极反应式:
_______________________________________________________________;
总反应方程式:
______________________________________________________________。
答案 2Al-6e-+3H2O===Al2O3+6H+ 6H++6e-===3H2↑ 2Al+3H2OAl2O3+3H2↑
2.锰、硫、氮的化合物在人类生产、生活中有重要作用。
(1)MnO2可作超级电容器材料。
用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是__________________。
MnO2是碱性锌锰电池的正极材料,已知碱性锌锰电池的总反应为Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2,碱性锌锰电池放电时,正极的电极反应式是____________________________。
(2)硫化氢的转化是资源利用和环境保护的重要研究课题。
由硫化氢获得硫单质有多种方法。
将用烧碱吸收H2S后所得的溶液加入如图所示的电解池的阳极区进行电解。
电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S
①写出电解时阴极的电极反应式:
__________________________________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_______________________________。
(3)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是____________,说明理由:
________________________________________。
答案
(1)Mn2++2H2O-2e-===MnO2+4H+ MnO2+H2O+e-===MnO(OH)+OH-
(2)①2H2O+2e-===H2↑+2OH-②S
+2H+===(n-1)S↓+H2S↑
(3)NH3 根据总反应:
8NO+7H2O3NH4NO3+2HNO3,电解产生的HNO3多,应补充NH3
3.若用惰性电极电解CuSO4溶液一段时间后,需加入98gCu(OH)2固体,才能使电解质溶液复原,则这段时间,整个电路中转移的电子数为多少?
答案 4NA
4、写出下图的电极反应式及总反应式
(金属表面镀银)
下图电解的目的是在铝表面形成一层致密的氧化膜
阳极反应式:
2Al-6e-+6HCO
===Al2O3+6CO2↑+3H2O;
阴极反应式:
6H2O+6e-===3H2↑+6OH-。
5.下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。
下列说法中正确的是( )
A.阳极的电极反应式为2Cl--2e-===Cl2↑
B.阴极的电极反应式为TiO2+4e-===Ti+2O2-
C.通电后,O2-、Cl-均向阴极移动
D.石墨电极的质量不发生变化
6.采用电化学法还原CO2是一种使CO2资源化的方法。
下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。
下列说法中正确的是( )
A.Zn与电源的负极相连
B.ZnC2O4在交换膜右侧生成
C.电解的总反应为2CO2+Zn=ZnC2O4
D.通入11.2LCO2时,转移0.5mol电子
7.离子液体是一种室温熔融盐,为非水体系。
由有机阳离子、Al2Cl
和AlCl
组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为____________________。
若改用AlCl3水溶液作电解液,则阴极产物为________。
答案 负 4Al2Cl
+3e-===Al+7AlCl
H2
8.用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,CN-与阳极产生的ClO-反应生成无污染的气体,下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为Cl-+2OH--2e-===ClO-+H2O
C.阴极的电极反应式为2H2O+2e-===H2↑+2OH-
D.除去CN-的反应:
2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
微专题
隔膜在电化学中的功能
1.常见的隔膜
隔膜又叫离子交换膜,由高分子特殊材料制成。
离子交换膜分三类:
(1)阳离子交换膜,简称阳膜,只允许阳离子通过,即允许H+和其他阳离子通过,不允许阴离子通过。
(2)阴离子交换膜,简称阴膜,只允许阴离子通过,不允许阳离子通过。
(3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。
2.隔膜的作用
(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。
(2)能选择性的通过离子,起到平衡电荷、形成闭合回路的作用。
专题训练
1.(提高电流效率)已知:
电流效率=电路中通过的电子数与消耗负极材料失去电子总数之比。
现有两个电池Ⅰ、Ⅱ,装置如图所示。
下列说法正确的是( )
A.Ⅰ和Ⅱ的电池反应不相同
B.能量转化形式不同
C.Ⅰ的电流效率低于Ⅱ的电流效率
D.5min后,Ⅰ、Ⅱ中都只含1种溶质
2.(提高产品纯度)(2017·太原市第五中学高三检测)工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。
下列说法不正确的是( )
已知: