测定空气中氧气含量的装置全.docx
《测定空气中氧气含量的装置全.docx》由会员分享,可在线阅读,更多相关《测定空气中氧气含量的装置全.docx(9页珍藏版)》请在冰豆网上搜索。
测定空气中氧气含量的装置全
测定空气中氧气含量的罕见的装置(全)之邯郸勺丸创作
江苏省特级教师 赵美荣
序号
装置
实验操纵
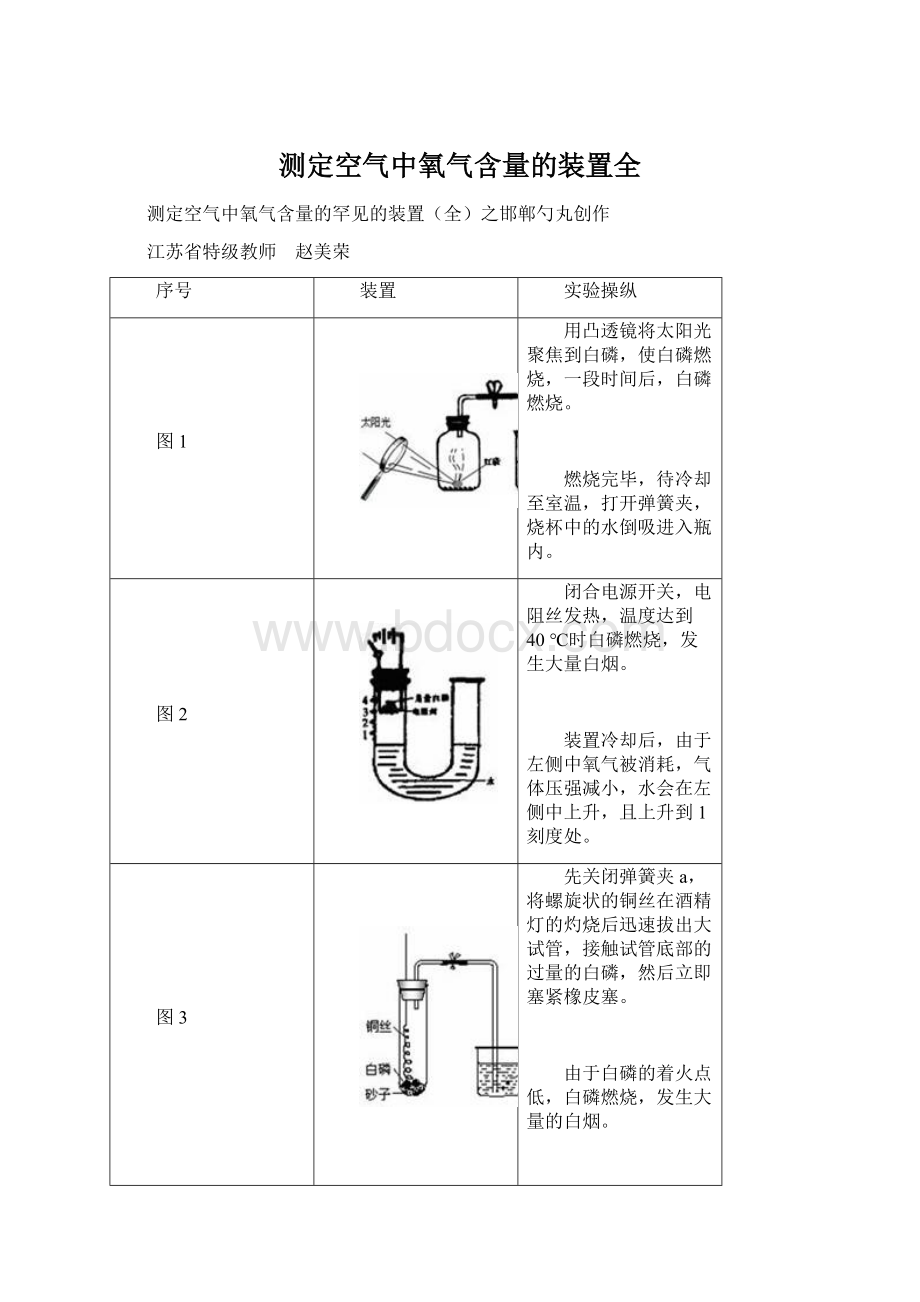
图1
用凸透镜将太阳光聚焦到白磷,使白磷燃烧,一段时间后,白磷燃烧。
燃烧完毕,待冷却至室温,打开弹簧夹,烧杯中的水倒吸进入瓶内。
图2
闭合电源开关,电阻丝发热,温度达到40℃时白磷燃烧,发生大量白烟。
装置冷却后,由于左侧中氧气被消耗,气体压强减小,水会在左侧中上升,且上升到1刻度处。
图3
先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速拔出大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞。
由于白磷的着火点低,白磷燃烧,发生大量的白烟。
燃烧完毕,待冷却至室温,打开弹簧夹,烧杯中的水倒吸进入瓶内。
图4
用水浴加热的法子使白磷燃烧,足以使白磷着火燃烧。
燃烧完毕,待冷却至室温,打开弹簧夹,烧杯中的水倒吸进入瓶内。
图5
在一封闭的试管内放一颗白磷,用酒精灯微微加热白磷,白磷燃烧,有大量白烟生成,注射器被推向外侧(右侧)。
待装置冷却,注射器逐渐向内侧(左侧)移动,根据注射器停止时的位置,确定空气中氧气的体积。
图6
在一端封闭的粗玻璃管内放一颗白磷,用胶塞塞住,并推入到玻璃管中部,记下位置。
用酒精灯微微加热白磷,白磷燃烧,有大量白烟生成,胶塞被推向外侧(右侧)。
待装置冷却,胶塞逐渐向内侧(左侧)移动,根据胶塞停止时的位置,确定空气中氧气的体积。
图7
用生石灰和水反应时放出的热量使白磷燃烧。
烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处。
图8
在一个耐热活塞的底部放一小块(足量)白磷,然后迅速将活塞下压,使空气内能增大,温度达到40℃。
白磷燃烧,发生大量白烟,冷却至原来温度时,松开手,活塞最终将回到刻度4处。
图10
在一玻璃管的两端,通过橡皮塞装上两只注射器,玻璃管内装几团细的铜丝,把一个注射器内的空气体积调到50mL的位置,另一只注射器不留空气加热玻璃管的铜丝部位。
待铜丝被灼热后,把注射管缓慢地以2~3次/分的速度左右推动。
大约3~4min之后停止加热。
待玻璃管冷却至室温后,注射器内空气减少。
图11
在滴管中盛适量的氢氧化钠溶液。
将燃着的硫粉迅速拔出集气瓶内,硫粉燃烧,发出淡蓝色的火焰。
燃烧完毕,待冷却至室温,打开弹簧夹,烧杯中的水倒吸进入瓶内。
探究空气中氧气的含量
湖北省教研室组长 杨国安
亲爱的同学,很高兴与你见面了!
老师要告诉你一个小秘密:
在《我们周围的空气》单元里,“探究空气中氧气含量的实验”可重要啦!
这不,近几年来在各省市中考试题中频繁出现。
本文中的例3就是我出的一道中考题。
遗憾的是,当年我市考生平均得分率只有41%!
现在,你一定很想知道,怎样才干掌握这一考点?
老师告诉你,掌握这一考点有秘决:
一是你要深入理解实验原理;二是你要有流畅的解题思路,找到解题的突破口。
深入理解实验原理
对于探究空气成分的实验,以下几点需要你认真研读,深入理解,这是你正确解答这类题目的基础。
【实验原理】
利用物质在密闭容器里燃烧或与氧气反应生成固体物质,把容器里空气中的氧气耗尽,根据气体体积的减少量来确定氧气的含量。
【实验药品】
能用来测定空气中氧气含量的物质必须是易与氧气反应且没有气体生成的物质,如红磷(或白磷)
等。
不克不及用木炭、硫来代替红磷(或白磷)。
木炭、硫燃烧的产品是气体,且消耗的氧气的体积恰好
等于生成的气体的体积,密闭体系内气体的压强几乎没有变更。
【实验装置】如图1所示(当然,也可用其他合理装置)。
【实验步调】
1.在集气瓶内加入少量水(用于溶解生成的五氧化二磷,同时吸收燃烧发生的热,有利于瓶内降温),把集气瓶剩余容积划分为5等分,并做上记号。
2.用止水夹夹紧乳胶管。
把燃烧匙内的红磷放在酒精灯火焰上点燃,立即伸入瓶中并把塞子塞紧。
观察红磷燃烧时的现象。
3.待红磷熄灭并冷却后,打开止水夹,观察实验现象及水面的变更情况。
【实验现象】
红磷燃烧时发出黄白色火焰,同时放出热量,随着反应的进行,瓶内充满白烟。
待集气瓶冷却到室温时,打开止水夹,烧杯中的水被吸进集气瓶中,进水的体积恰好近似于集气瓶中原空气体积的1/5。
【注意事项】
1.装置不克不及漏气。
2.红磷要过量,以包管瓶内的氧气耗完。
3.点燃红磷后要立即伸入集气瓶中,并塞紧塞子,不克不及使外界空气进入瓶内。
4.止水夹要夹紧,防止红磷燃烧时气体膨胀使瓶中气体从导管逸出。
5.等到集气瓶冷却到室温时再打开止水夹,防止瓶内气温高于外界气温,使进入瓶内的水减少
领悟解题思路
以上内容是你正确解题的基础。
接下来,需要你积极领悟解题思路,寻找解题突破口。
只有思路流畅,你才干在平时考试或中考中游刃有余。
总体思路:
测定空气中氧气含量的方法有多种,但其原理只有一种,这就是利用足量的某物质与密闭容器里空气中的氧气充分反应,通过观察进水的体积或活塞移动的体积,来确定空气中氧气的含量。
例1 某同学设计了测定空气中氧气含量的实验,装置如图1所示。
回答下列问题:
⑴红磷在集气瓶中燃烧的符号表达式为 。
⑵待燃烧停止,白烟消失并冷却后,打开止水夹,观察到进入集气瓶中水的体积不到总容积的1/5,你认为其原因可能是 、 。
(填2点即可)
⑶如将红磷换成炭粉,实验能否成功?
(填“能”或“不克不及”)。
原因是 。
思路分析
测定空气中氧气含量的物质,是容易与氧气反应且没有气体生成的物质。
如红磷在密闭容器中燃烧,消耗了容器里的氧气,
生成了五氧化二磷固体。
木炭燃烧的产品是二氧化碳气体,木炭消耗氧气的体积与生成的二氧化碳气体的体积相同,密闭体系内气体的压强变更很小。
测定的氧气的含量小于实际含量,或是装置有问题,或是操纵有问题。
如装置漏气;红磷的量缺乏;止水夹未夹紧;装置未冷却到室温就开始读数等。
答案
⑴红磷+氧气
五氧化二磷
⑵装置漏气 红磷的量缺乏
⑶不克不及 炭粉虽然消耗了氧气,但燃烧生成的二氧化碳是气体,瓶内压强变更很小,水基本不克不及进入集气瓶中
例2 某课外活动小组的同学,用图2所示的装置粗略测定空气中氧气的体积分数。
该装置的气密性良好,活塞可左右滑动,实验前活塞处在刻度10cm处。
已知白磷在空气中燃烧的最低温度为40℃。
回答下列问题:
⑴可观察到玻璃管内开始发生的现象是:
白磷着火燃烧,活塞先向 移动(填“左”或“右”,下同),后向 移动。
⑵实验结束,恢复到常温后,活塞应停在约 (填整数)cm处。
思路分析
烧杯中的沸水使白磷的温度上升,当白磷的温度达到40℃时,白磷着火燃烧。
白磷燃烧时放出的热量使密闭容器中的气体受热膨胀,活塞右移;当膨胀的体积不及消耗的氧气的体积时,活塞左移。
由于空气中的氧气约占总体积的1/5,所以,待装置冷却至室温,活塞最后停在刻度约为8cm的位置上。
答案
⑴右 左 ⑵8
例3 某同学为测定空气里氧气的含量,设计了如图3所示的实验装置。
该同学在“金属梯”的每一步的凹处放置一颗用滤纸吸干水后的白磷,用放大镜会聚6V手电筒光于靠近水面的一步“金属梯”处的白磷上。
回答下列问题:
⑴一段时间后,可观察到的现象是_________________。
⑵“金属梯”的每一步上都放置一小颗白磷与只靠近水面的一步“金属梯”处放一大颗白磷相比,优点是______________________。
思路分析
放大镜会聚6V手电筒光,使金属梯最下端凹处的白磷的温度升高,白磷着火燃烧。
白磷燃烧放出的热量,使金属梯上各步凹处的白磷由下往上依次燃烧。
由于试管中的氧气逐渐减少,试管内气体的压强也逐渐减小,试管内的水位逐渐上升。
当氧气全部耗尽时,水面不再上升。
金属梯上各步凹处放置一颗小白磷,可增大白磷与氧气的接触面积,尽可能多地消耗试管里的氧气。
答案
⑴白磷像“上楼梯”般依次燃烧,开始时冒白烟,燃烧快停止时在倒置试管的上部出现黄烟。
试管内的水位先下降,然后上升到一定位置后恒定不动
⑵尽可能多地消耗试管内的氧气
例4 铁能在湿润的空气中与氧气反应生成铁锈,一位同学应用上述反应原理测定空气中氧气的含量,他选用的仪器如图4所示。
回答下列问题:
⑴试管和铁丝球应该如何放置?
⑵实验中观察到什么现象?
⑶实验要进行一周左右的时间,才干观察到明显的现象,你知道时间较长的原因吗?
思路分析
在密闭容器内,细铁丝与湿润空气中的氧气反应生成铁锈,使容器内的氧气耗尽,容器内气体压强小于容器外的大气压,水进入容器。
铁生锈的速度很慢,为了将试管中的氧气全部耗尽,需要较长的时间。
答案
⑴把细铁丝放在倒立着的试管里,将烧杯移至试管下方使试管口浸没在水中,并用烧杯中的水液封
试管中的空气。
(如图5所示)
⑵一段时间后,试管内液面上升,试管中铁丝生锈。
⑶铁生锈是一个缓慢氧化的过程,为了包管试管中的氧气能完全与铁丝反应,实验需要较长时间。
亲爱的同学,“测定空气中氧气的含量”的原理你已十分清楚了,解题思路也相当明晰了,如果在
平时考试或中考中遇到了这样一类题目,我相信你已成竹在胸了!