好北京高考化学选修四电化学专题.docx
《好北京高考化学选修四电化学专题.docx》由会员分享,可在线阅读,更多相关《好北京高考化学选修四电化学专题.docx(29页珍藏版)》请在冰豆网上搜索。
好北京高考化学选修四电化学专题
第四章电化学基础
【学习目标】
1、原电池、电解池
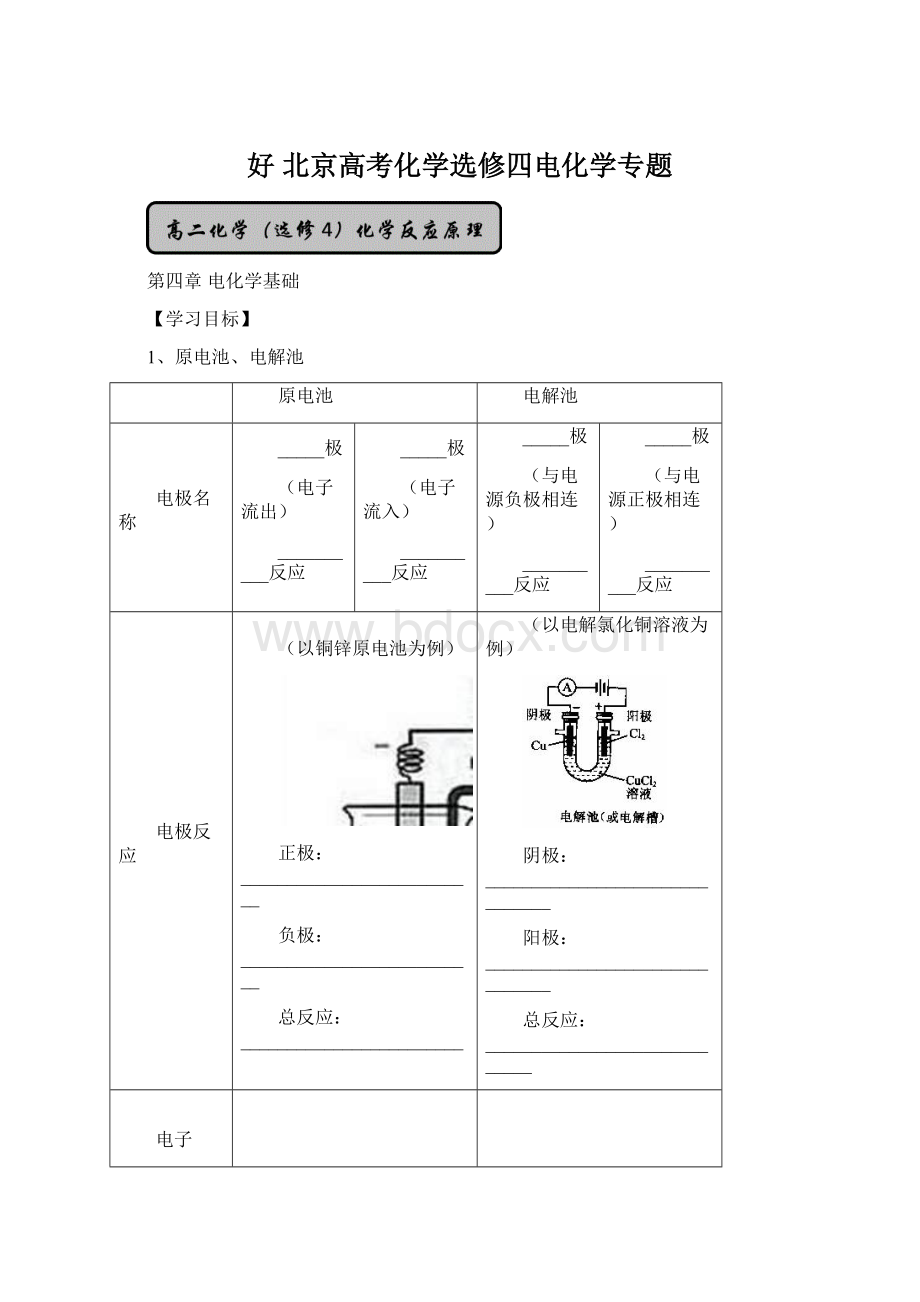
原电池
电解池
电极名称
_____极
(电子流出)
__________反应
_____极
(电子流入)
__________反应
_____极
(与电源负极相连)
__________反应
_____极
(与电源正极相连)
__________反应
电极反应
(以铜锌原电池为例)
正极:
__________________________
负极:
__________________________
总反应:
________________________
(以电解氯化铜溶液为例)
阴极:
_______________________________
阳极:
_______________________________
总反应:
_____________________________
电子
移动
方向
能量转化
__________能转化为_________能
__________能转化为_________能
2、化学电池
(1)一次电池:
常见的有碱性锌锰电池、锌银电池、锂电池等。
写出碱性锌锰电池的电极反应:
负极:
________________________________________________________
正极:
________________________________________________________
总反应:
______________________________________________________
(2)二次电池:
放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
写出铅蓄电池放电的电极反应:
负极:
________________________________________________________
正极:
________________________________________________________
总反应:
______________________________________________________
(3)燃料电池:
是使燃料与氧化剂反应直接产生电流的一种原电池。
(只在负极发生氧化反应)
写出氢氧燃料电池(酸性条件)电极反应:
负极:
_________________________________________________
正极:
_________________________________________________
总反应:
_______________________________________________
3、电解原理应用:
(1)氯碱工业:
写出点解氯化钠溶液的电极反应:
阴极:
________________________________________________________
阳极:
________________________________________________________
总反应:
______________________________________________________
(2)电镀:
电镀时,通常把待镀金属制品作阴极,把镀层金属做阳极,用含有镀层金属离子的溶液做电镀液。
冶炼粗铜:
电解时,用纯铜作为阴极,粗铜作为负极,用硫酸铜溶液作为电解液。
当直流电通过时,作为阳极的粗铜开始溶解,纯铜在阴极析出,粗铜中的杂志(贵重金属)会沉积在电解槽的底部。
(3)电冶金:
写出点解熔融氯化钠的电极反应:
阴极:
________________________________________________________
阳极:
________________________________________________________
总反应:
______________________________________________________
4、金属的电化学腐蚀与防护
(1)析氢腐蚀:
负极:
________________________________________________________
正极:
________________________________________________________
总反应:
______________________________________________________
(2)吸氧腐蚀:
负极:
________________________________________________________
正极:
________________________________________________________
总反应:
______________________________________________________
析氢腐蚀吸氧腐蚀
(3)牺牲阳极的阴极保护法:
将被保护的金属与更活泼的金属连接,构成原电池,使活泼金属作阳极被氧化,被保护的金属作阴极。
外加电源的阴极保护法:
利用外加直流电,负极接在被保护金属上成为阴极,正极接其他金属。
【知识与方法】
1、列关于化学电源的叙述错误的是()
A.普通锌锰干电池中碳棒为正极B.铅蓄电池中覆盖着PbO2的电极板是负极板
C.氢氧燃料电池的正极是通入氧气的那一极
D.碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高
2、关于原电池和电解池的叙述正确的是()
A.原电池中失去电子的电极为阴极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
3、为了保护地下钢管不受腐蚀,可使它与()
A.直流电源负极相连B.铜板相连C.锡板相连D.直流电源正极相连
4、根据下列事实,判断离子的氧化性顺序为①A+B2+===A2++B②D+2H2O===D(OH)2+H2↑③以B、E为电极与E的盐溶液组成原电池,电极反应为:
E2++2e-=E,B-2e-=B2+()
A.D2+>A2+>B2+>E2+B.D2+>E2+>A2+>B2+C.E2+>B2+>A2+>D2+D.A2+>B2+>D2+>E2+
5、埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是()
A.在含铁元素较多的酸性土壤中B.在潮湿疏松的碱性土壤中
C.在干燥致密不透气的土壤中D.在含碳粒较多,潮湿透气的中性土壤中
6、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是()
A.利用电池外壳的金属材料B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品D.回收其中石墨电极
7、电解含下列离子的水溶液,若阴极析出相等质量的物质,则消耗的电量最多的是()
A.Ag+B.Cu2+C.Na+D.Hg2+
8、下列变化中属于原电池反应的是( )
A.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化
B.在空气中金属铝表面迅速被氧化形成保护膜
C.红热的铁丝与水接触表面形成蓝色保护层
D.在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生
9、下列过程需通电后才能进行的是()
A.电离B.电解C.电化腐蚀D.电泳
10、用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后()
A.溶液的pH变大B.c(Na+)与c(CO32-)的比值变大
C.溶液浓度变大,有晶体析出D.溶液浓度不变,有晶体析出
11、下列关于金属腐蚀的说法中不正确的是()
A.金属腐蚀的本质是金属原子失去电子而被氧化B.金属腐蚀一般包括化学腐蚀和电化学腐蚀
C.纯的金属一般难以发生电化学腐蚀D.钢铁在酸性环境中会发生吸氢腐蚀
12、银器的保护主要是维持它的原貌,对于轻微腐蚀蒙有硫化银的银器,可将其和铝片一起接触浸泡在稀NaOH溶液中,经一定时间污迹消失,取出后用水洗于净,再用软布或棉团擦光。
有关叙述正确的是()
A.溶液中的OH-离子向正极移动B.在银表面上的反应为:
Ag2S+2e-=2Ag+S2-
C.在铝表面的反应为:
Al-3e-=Al3+D.在铝表面的反应为:
Al+4OH—+3e-=AlO2-+2H2O
13、微型钮扣电池在现代生活中有广泛应用。
有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是:
()
A.在使用过程中,电池负极区溶液的pH减小B使用过程中,电子由Ag20极经外电路流向Zn极C.Zn是负极,Ag2O是正极D.Zn电极发生还原反应,Ag2O电极发生氧化反应
14、若在铜片上镀银时,下列叙述正确的是()
①将铜片接在电池的正极上,②将银片接在电源的正极上,③在铜片上发生的反应是:
Ag++e-=Ag,④在银片上发生的反应是:
4OH--4e-=O2+2H2O,⑤需用CuSO4溶液,⑥需用AgNO3溶液作电解液
A.①③⑥B.②③⑥C.①④⑤D.②③④⑥
15、下列关于铜电极的叙述正确的是()
A.铜锌原电池中铜是正极B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极D.电解稀硫酸制H2、O2时铜作阳极
16、有七种金属:
钾、锌、铁、锡、铜、银、铂,它们的标号分别为A、B、C、D、E、F、G。
①常温下,只有A和水反应生成氢气;②D、E、G都能和稀硫酸反应生成氢气,B、C、F无此性质;③C、F组成原电池时,F为正极;④在G的硫酸盐溶液中加入D,发现D溶解,G析出;⑤将G、E接触放置,E不易锈蚀;⑥以铂作电极,电解相同浓度的B和C的硝酸盐溶液时,在阴极上首先得到C,G在空气中放置极易生锈。
则A是____,B是____,C是____,D是____,E是____,F是____,G是____
17、右图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(1)在A、B、C、D各电极上析出生成物的物质的量比为________________________。
18、将1L含有0.4molCuSO4和0.2molNaCl的水溶液用惰性电极电解一段时间后,在一个电极上得到0.1molCu,另一电极上析出气体(在标准状况下)的体积是多少?
【能力与探究】
1、(2009北京)下列叙述不正确的是
A.铁表面镀锌,铁作阳极B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:
D.工业上电解饱和和食盐水的阳极反应:
2、(2010北京)下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
3、(2011北京)结合右图判断,下列叙述正确的是
A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是
C.Ⅰ和Ⅱ中正极反应均是
D.Ⅰ和Ⅱ中加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
4、(2013北京)下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极B.金属护拦表面涂漆
C.汽水底盘喷涂高分子膜D.地下钢管连接镁块
5、(2013北京)用石墨电极电解CuCl2溶液(见右图)。
下列分析正确的是
A.a端是直流电源的负极B.通电使CuCl2发生电离
C.阳极发生反应:
Cu2++2e-=CuD.通电一段时间后,在阴极附近观察到黄绿色气体
6、关于实现下列物品用途的主要物质的说法,不正确的是
7、下列叙述正确的是
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2
C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e—=2H2O
D.右图中电子由Zn极流向Cu,盐桥中的Cl—移向CuSO4溶液
8.查处酒后驾驶采用的"便携式乙醇测量仪"以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-=X+2H+。
下列说法中正确的是
A.电池内部H+由正极向负极移动B.另一极的电极反应式为O2+4e-+2H2O=4OH-C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:
2CH3CH2OH+O2→2CH3CHO+2H2O
9、用选项中的电极、溶液和如图所示装置可组成原电池。
下列现象或结论的叙述正确的是
选项
电极a
电极b
A溶液
B溶液
现象或结论
A
Cu
Zn
CuSO4
ZnSO4
一段时间后,a增加的质量与b减少的质量相等
B
Cu
Zn
稀H2SO4
ZnSO4
盐桥中阳离子向b极移动
C
Fe
C
NaCl
FeCl3
外电路电子转移方向:
b→a
D
C
C
FeCl3
KI、淀粉混合液
若开始时只增大FeCl3溶液浓度,b极附近溶液变蓝的速度加快
10、空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。
下图为RFC工作原理示意图,有关说法正确的是
A.当有0.1mol电子转移时,a极产生1.12LO2(标准状况下)
B.b极上发生的电极反应是:
4H2O+4e-=2H2↑+4OH-
C.d极上发生的电极反应是:
O2+4H++4e-=2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
11、某种可充电聚合物锂离子电池放电时的反应为:
Li1-xCoO2+LixC6=6C+LiCoO2其工作原理示意图如右。
下列说法不正确的是
A.放电时LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时将电池的负极与外接电源的负极相连
D.放电时,电池的正极反应为:
Li1-xCoO2+xLi++xe−=LiCoO2
12、将反应Cu(s)+2Ag+(aq)
Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
A.KNO3盐桥中的K+移向Cu(NO3)2溶液
B.当电流计指针为0时,该反应达平衡,平衡常数K=0
C.若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
D.若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
13、铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH−−2e−=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH−−2e−=Ni2O3+3H2O
14、铅蓄电池是最常见的二次电池,其构造示意图如下。
发生反应的化学方程式为:
Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l)
下列说法不正确的是
A.放电时,正极反应为:
PbO2(s)+4H+(aq)+SO42-(aq)+2e-==PbSO4(s)+2H2O(l)
B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接
C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接
D.铅蓄电池做电源电解Na2SO4溶液时,当有2molO2产生时,消耗8molH2SO4
15、一种太阳能电池的工作原理示意图如下所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是
A.K+移向催化剂b
B.催化剂a表面发生反应:
Fe(CN)64--e-=Fe(CN)63-
C.Fe(CN)63-在催化剂b表面被氧化
D.电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变
16、关于下列各装置图的叙述不正确的是
①②③④
A.用装置①精炼铜,a极为粗铜,电解质溶液为硫酸铜溶液
B.装置②盐桥中KCl的Cl-移向乙烧杯
C.装置③中钢闸门应与外接电源的负极相连
D.装置④可以验证温度对化学平衡的影响
17、用石墨作电极,电解盛放在
形管中的饱和
溶液(滴有酚酞溶液),如下图。
下列叙述正确的是
A.阴极附近溶液先变红
B.电解时在阳极得到氯气,阴极得到金属钠
C.电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性
D.当阳极生成
气体时,整个电路中转移了
18、关于右图装置说法正确的是
A.装置中电子移动的途径是:
负极FeM溶液石墨正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
19、有关下列四个常用电化学装置的叙述中,正确的是
图Ⅰ碱性锌锰电池
图Ⅱ铅-硫酸蓄电池
图Ⅲ电解精炼铜
图Ⅳ银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
20、下列说法不正确的是
A
B
C
D
通电一段时间后,搅拌均匀,溶液的pH增大
甲电极上的电极反应为:
2Cl--2e-==Cl2↑
Pt电极上的电极反应为:
O2+2H2O+4e-==4OH-
总反应的离子方程式为:
2Fe3++Cu==Cu2++2Fe2+
21、关于下列各装置图的叙述中,正确的是
A.若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸
D.装置④可用于实验室配置一定物质的量浓度的稀硫酸
22、根据右图回答,下列说法正确的是
A.若a为粗铜,b为纯铜,X为CuSO4,该装置可用于铜的精炼
B.若a为纯铁,b为纯铜,X为CuSO4该装置用于铁表面镀铜
C.燃料电池中正极反应为:
O2(g)+2e-+2H+=H2O
D.当X为NaCl时,b极上产生的气体能使湿润的淀粉KI试纸变蓝
23、加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。
下列说法正确的是
A.a电极是阴极B.a极区的KI最终转变为KIO3
C.阳极电极反应:
4OH—-4e—====2H2O+O2↑
D.电解过程中OH—从a极区通过离子交换膜c进入b极区
24、某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右,下列说法不正确的是
A.A为电源正极
B.阳极区溶液中发生的氧化还原反应为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.1molCr2O72-被还原
2425
25、下列关于右图装置的说法正确的是
A.若断开K1关闭K2,X、Y均为石墨,Z是NaCl溶液,则X附近能得到氢氧化钠
B.若断开K1关闭K2,X是纯铜,Y是粗铜,Z是CuSO4溶液,则该装置可用于铜的精炼
C.若断开K2关闭K1,X是Cu,Y是Fe,Z是含有空气的海水,则该装置可用于保护Fe
D.若断开K2关闭K1,X是Cu,Y是Zn,Z是稀H2SO4,则溶液中的SO42-移向Y极
26、下列叙述正确的是
A.K与N连接时,X为硫酸,一段时间后溶液的pH增大
B.K与N连接时,X为氯化钠,石墨电极反应:
2H++2e—=H2↑
C.K与M连接时,X为硫酸,一段时间后溶液的pH增大
D.K与M连接时,X为氯化钠,石墨电极反应:
4OH—-4e—=2H2O+O2↑
27、下图是一套电化学装置,对其有关说法错误的是
28
A装置A是原电池,装置B是电解池B.反应一段时间后,装置B中溶液PH增大
C.a口若消耗1molCH4,d口可产生4mol气体
D.a口通入C2H6时的电极反应为C2H6-14e-+18OH-=2CO32-+12H2O
28、将右图所示实验装置的K闭合,下列判断正确的是
A.
电极上发生还原反应B.电子沿Zn
a
b
Cu路径流动
C.片刻后甲池中c(SO42−)增大D.片刻后可观察到滤纸b点变红色
29、下列关于金属腐蚀与防护的说法正确的是
A.金属腐蚀就是金属失去电子被还原的过程B.铝制品的耐腐蚀性强,说明铝的化学性质不活泼
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.铁门上的铜铆钉处在潮湿的空气中直接发生反应:
Fe-3e-=Fe3+
30、下列说法不正确的是
A.与铜质水龙头连接处的钢制水管易发生腐蚀
B.把被保护的钢铁设备作为阴极,外加直流电源可进行保护
C.原电池产生电流时,阳离子移向正极,阴离子移向负极
D.铅蓄电池是最常见的二次电池,正极板上覆盖有Pb
31、下列说法正确的是
A.电化学腐蚀比化学腐蚀更普遍、腐蚀速度更快;但后者比前者的腐蚀危害更大
B.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
C.燃料电池是将燃料和氧化剂的化学