届高中化学一轮复习第4章材料家族中的元素鲁教版.docx
《届高中化学一轮复习第4章材料家族中的元素鲁教版.docx》由会员分享,可在线阅读,更多相关《届高中化学一轮复习第4章材料家族中的元素鲁教版.docx(107页珍藏版)》请在冰豆网上搜索。
届高中化学一轮复习第4章材料家族中的元素鲁教版
第4章材料家族中的元素
[循着图示·想一想][特色特性·记一记]
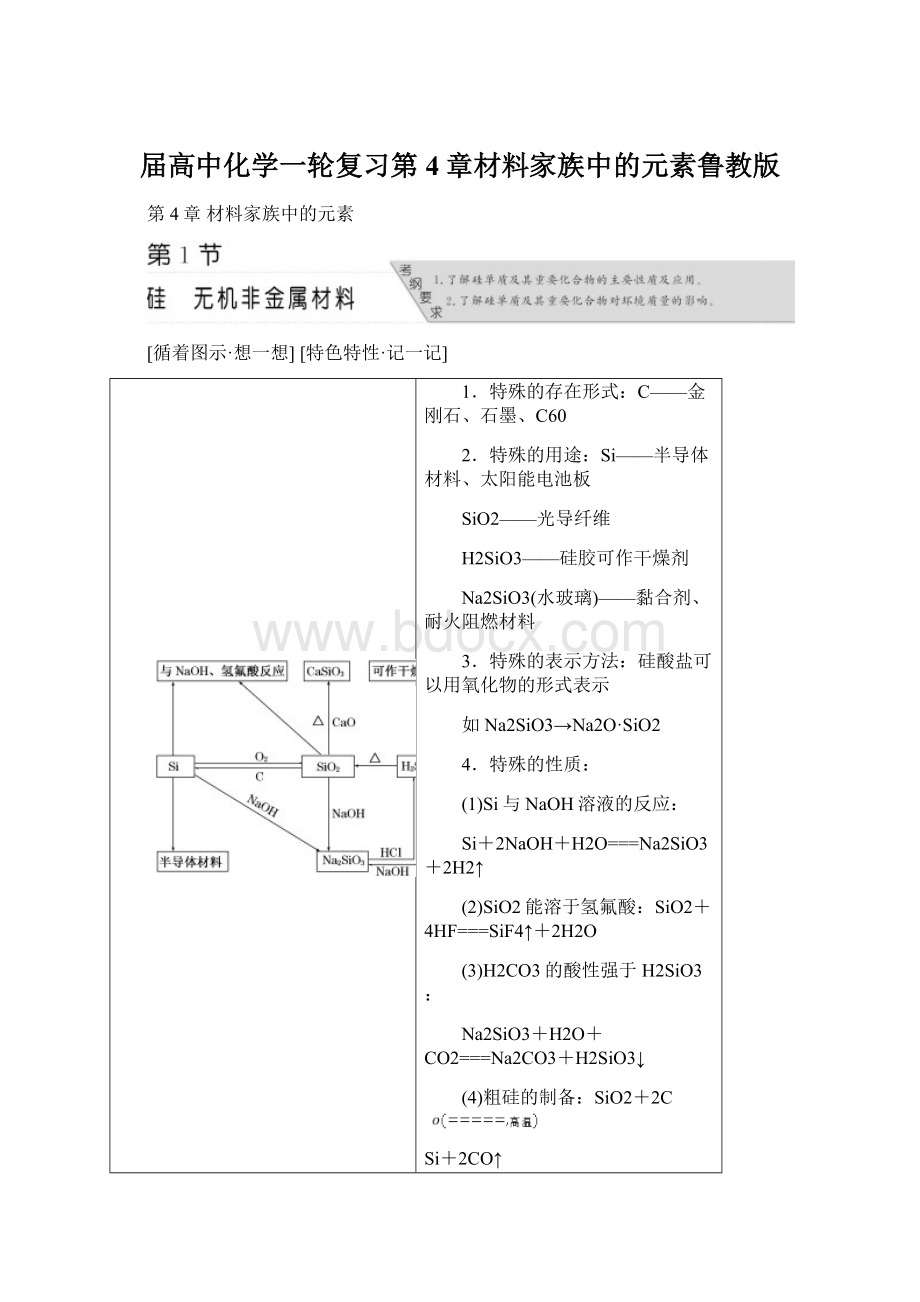
1.特殊的存在形式:
C——金刚石、石墨、C60
2.特殊的用途:
Si——半导体材料、太阳能电池板
SiO2——光导纤维
H2SiO3——硅胶可作干燥剂
Na2SiO3(水玻璃)——黏合剂、耐火阻燃材料
3.特殊的表示方法:
硅酸盐可以用氧化物的形式表示
如Na2SiO3→Na2O·SiO2
4.特殊的性质:
(1)Si与NaOH溶液的反应:
Si+2NaOH+H2O===Na2SiO3+2H2↑
(2)SiO2能溶于氢氟酸:
SiO2+4HF===SiF4↑+2H2O
(3)H2CO3的酸性强于H2SiO3:
Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓
(4)粗硅的制备:
SiO2+2C
Si+2CO↑
考点一
[记牢主干知识]
1.硅元素的原子结构与存在
硅元素在地壳中含量为第三位,在周期表中位置为第3周期,第ⅣA族,原子结构示意
图为,在自然界中只以化合态形式存在。
2.单质硅与半导体材料
(1)Si的物理性质
灰黑色固体,有金属光泽,熔点高、硬度大、有脆性。
(2)Si的化学性质
①与氢氟酸反应的化学方程式:
Si+4HF===SiF4↑+2H2↑;
②与NaOH溶液反应的化学方程式:
Si+2NaOH+H2O===Na2SiO3+2H2↑;
③与O2反应:
Si+O2
SiO2。
(3)用途——半导体材料
制晶体管、集成电路、硅芯片、太阳能电池、硅合金等。
3.二氧化硅与光导纤维
(1)二氧化硅存在
在自然界中主要存在:
沙子、石英、水晶。
(2)二氧化硅物理性质:
熔点高,硬度大。
(3)二氧化硅化学性质
(4)二氧化硅用途
制造电子部件、光学仪器、光导纤维,生产水泥、玻璃等硅酸盐产品,水晶可制作饰品。
(5)光导纤维
光导纤维既可用来制造高性能的现代通讯材料,又可用于能量传输、信息处理、遥测遥控和医疗器械制造等方面。
4.硅酸
[练通基础小题]
一、基础知识全面练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)单质硅常用作半导体材料和光导纤维(×)
(2)硅在自然界中只以化合态的形式存在(√)
(3)硅的化学性质不活泼,常温下不与任何物质反应(×)
(4)SiO2不与任何酸反应,可用石英制造耐酸容器(×)
(5)Si→SiO2→H2SiO3均能一步转化(×)
(6)不能用SiO2与水反应的方法来制取硅酸,不能用瓷坩埚来加热烧碱或纯碱使其熔化(√)
2.SiO2与Na2CO3发生反应:
SiO2+Na2CO3
Na2SiO3+CO2↑,能说明H2SiO3的酸性比碳酸强吗?
提示:
不能;此反应中生成的CO2气体脱离反应体系有利于反应的向右进行,与其氧化物对应酸的强弱无关;而强酸制弱酸的规律一般适用于在溶液中发生的反应。
二、常考题点分组练
题点
(一) 硅及其化合物的性质
1.下列说法错误的是( )
A.(2015·安徽高考)SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
B.(2015·江苏高考)下列转化能一步实现:
粗硅
SiCl4
Si
C.(2013·广东高考)SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中
D.(2013·广东高考)高温下用焦炭还原SiO2制取粗硅
解析:
选A 既能和酸反应生成盐和水又能和碱反应生成盐和水的氧化物为两性氧化物,SiO2与氢氟酸反应不生成盐和水,故SiO2不是两性氧化物,A项错误。
2.下列说法正确的是( )
A.在粗硅的制取中发生2C+SiO2
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
解析:
选C 选项A、D的反应在高温下均生成了气体,使平衡正移,致使反应能顺利进行,但不能说明C、Si的还原性强弱,也不能说明H2SiO3与H2CO3酸性的强弱,故错误;NaOH能与玻璃成分中的SiO2反应生成Na2SiO3而使瓶塞粘在一起。
由SiO2制取H2SiO3的过程为:
SiO2
Na2SiO3
H2SiO3。
[知能存储]
硅及其化合物的特性
1.硅单质的特性
(1)Si的还原性强于C,但C却在高温下还原出Si:
SiO2+2C
Si+2CO↑。
(2)非金属单质与碱液作用一般无H2放出,但Si与碱液作用却放出H2:
Si+2NaOH+H2O===Na2SiO3+2H2↑。
(3)非金属单质一般不能与非氧化性酸作用,但Si能与HF作用:
Si+4HF===SiF4↑+2H2↑。
(4)非金属单质大多为绝缘体,但Si为半导体。
2.含硅化合物的特性
物质
一般规律
含硅化合物的特性
SiO2
酸性氧化物一般与水反应生成相应酸
SiO2不溶于水,不与水反应
酸性氧化物一般不与酸发生复分解反应
SiO2+4HF===SiF4↑+2H2O
H2SiO3
“较强酸制较弱酸”是复分解反应的一般规律,H2CO3酸性强于H2SiO3
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓
以下反应不能说明酸性的强弱Na2CO3+SiO2
Na2SiO3+CO2↑
CaCO3+SiO2
CaSiO3+CO2↑
无机酸一般易溶于水
硅酸难溶于水
题点
(二) 硅的制备
3.半导体工业中,有一句行话:
“从沙滩到用户”,即由SiO2制取Si。
制取过程中不涉及的化学反应是( )
A.2C+SiO2
Si+2CO↑
B.SiO2+2NaOH===Na2SiO3+H2O
C.Si+2Cl2
SiCl4
D.SiCl4+2H2
Si+4HCl
解析:
选B 工业制取纯硅的工艺流程为:
SiO2
粗硅
SiCl4
纯硅,该工艺流程中不涉及SiO2与NaOH溶液的反应。
4.硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是________。
(2)工业上生产粗硅的反应有:
SiO2+2C
Si(粗)+2CO↑;SiO2+3C
SiC+2CO↑。
若产品中单质硅与碳化硅的物质的量之比为1∶1,则参加反应的C和SiO2的物质的量之比为________。
(3)工业上可以通过如图所示的流程制取纯硅:
①若反应Ⅰ为Si(粗)+3HCl
SiHCl3+H2,则反应Ⅱ的化学方程式为
________________________________________________________________________。
②整个制备过程中必须严格控制无水无氧。
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:
__________________________________________。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是________。
解析:
(1)硅在元素周期表中的位置是第3周期第ⅣA族。
(2)根据反应SiO2+2C
Si(粗)+2CO↑,SiO2+3C
SiC+2CO↑,生成1molSi需C2mol、SiO21mol,生成1molSiC需C3mol、SiO21mol,产品中Si与SiC的物质的量之比为1∶1,则参加反应的C和SiO2的物质的量之比为5∶2。
(3)①反应Ⅱ的化学方程式为SiHCl3+H2
Si(纯)+3HCl。
②化学方程式为SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑。
答案:
(1)第3周期第ⅣA族
(2)5∶2
(3)①SiHCl3+H2
Si(纯)+3HCl
②SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑ ③5∶1
题点(三) 硅单质及其化合物的转化关系
5.下列变化中,不能一步实现的是( )
A.Na2SiO3―→H2SiO3 B.H2SiO3―→SiO2
C.SiO2―→H2SiO3D.SiO2―→Na2SiO3
解析:
选C Na2SiO3
H2SiO3;H2SiO3
SiO2,SiO2
Na2SiO3,SiO2不与H2O反应,故不能一步转化为H2SiO3。
6.(2016·南宁联考)已知A是灰黑色的、有金属光泽的固体单质。
根据如图所示的物质之间的转化关系,回答下列有关问题。
(1)写出B、C两物质的名称:
B________,C________。
(2)写出D→B的化学方程式:
____________________________________________
________________________________________________________________________。
(3)写出B→C的离子方程式:
____________________________________________
________________________________________________________________________。
解析:
灰黑色有金属光泽的固体单质A能与O2反应,能与NaOH溶液反应,且A由氧化物D与碳高温下制得,故A为Si,依据各物质间的转化关系进而推知B为Na2SiO3,C为H2SiO3,D为SiO2。
答案:
(1)硅酸钠 硅酸
(2)SiO2+2NaOH===Na2SiO3+H2O
(3)SiO
+H2O+CO2===CO
+H2SiO3↓
[知能存储]
含硅化合物间的重要转化关系
①SiO2+2NaOH===Na2SiO3+H2O
②Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓
(或SiO
+2H+===H2SiO3↓)
③H2SiO3
H2O+SiO2
上述转化关系是含硅化合物推断题的重要突破口。
考点二
[记牢主干知识]
1.硅酸盐
(1)硅酸盐:
是由硅、氧和金属元素组成的化合物的总称,是构成地壳岩石的重要成分。
(2)硅酸盐组成的表示方法:
通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成,如硅酸钠(Na2SiO3)可表示为Na2O·SiO2,长石(KAlSi3O8)可表示为K2O·Al2O3·6SiO2。
(3)硅酸钠:
①白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。
②与酸性较硅
酸强的酸反应:
a.与盐酸反应的化学方程式:
Na2SiO3+2HCl===2NaCl+H2SiO3↓。
b.与CO2水溶液反应的化学方程式:
Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓。
③用途:
黏合剂(矿物胶),耐火阻燃材料。
2.无机非金属材料
(1)传统无机非金属材料,如水泥、玻璃、陶瓷等硅酸盐材料。
①常见硅酸盐材料比较
水泥
玻璃
陶瓷
生产原料
石灰石、黏土
纯碱、石灰石、石英
黏土
主要设备
水泥回转窑
玻璃熔窑
陶瓷窑
②玻璃生产中的两个重要反应:
Na2CO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2
CaSiO3+CO2↑。
(2)新型无机非金属材料,如高温结构陶瓷、光导纤维、生物陶瓷、压电陶瓷等。
[练通基础小题]
一、基础知识全面练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)玻璃是一种晶体,有较高的熔点(×)
(2)水玻璃是一种特殊的玻璃,泡花碱属于碱(×)
(3)向一定浓度的Na2SiO3溶液中通入适量CO2出现白色沉淀,证明H2CO3的酸性比H2SiO3的酸性强(√)
(4)传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料(√)
(5)新型无机非金属材料克服了传统无机非金属材料的许多缺点(√)
(6)高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点(√)
(7)水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐产品(×)
(8)2MgO·SiO2中的酸根阴离子为SiO
(×)
2.填写下列材料主要成分的化学式。
(1)刚玉________;
(2)大理石、石灰石________;
(3)普通玻璃____________;
(4)石英、水晶________。
答案:
(1)Al2O3
(2)CaCO3 (3)Na2SiO3、CaSiO3、SiO2 (4)SiO2
二、常考题点分组练
题点
(一) 无机非金属材料
1.下列说法正确的是( )
A.(2015·全国卷Ⅱ)硅胶可用作食品干燥剂
B.(2014·海南高考)玻璃容器可长期盛放各种酸
C.(2012·广东高考)Mg2+、H+、SiO
、SO
在水溶液中能大量共存
D.(2012·全国卷)合成纤维和光导纤维都是新型非金属材料
解析:
选A 氢氟酸不能用玻璃瓶盛放,B错误;Mg2+、H+与SiO
反应生成H2SiO3沉淀而不能大量共存,C错误;合成纤维属于有机合成材料,D错误。
2.大多数物质的俗名是根据其特殊的物理性质或用途得来的。
下列物质的俗名与化学式或用途不相符的一组是( )
选项
俗名
主要成分(化学式)
用途
A
石英
SiO2
集成电路
B
纯碱
Na2CO3
制备玻璃
C
水玻璃
Na2SiO3
制备硅胶
D
铁红
Fe2O3
用作油漆和涂料
解析:
选A 石英主要用于生产玻璃和光导纤维等,晶体硅才用于制作集成电路。
[易错警示]
硅及其化合物在常用物质中的易错点
(1)用作半导体材料的是晶体硅而不是SiO2,用于制作光导纤维的是SiO2而不是硅,计算机芯片的成分是晶体硅而不是SiO2。
(2)水晶、石英、玛瑙、硅石、沙子等主要成分是SiO2,而不是硅酸盐。
(3)传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐。
题点
(二) 复杂硅酸盐成分的表示方法
3.SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。
盛放NaOH溶液的试剂瓶若用玻璃塞容易形成瓶体与瓶塞粘连,而无法打开,发生反应的化学方程式为_________________________________________。
长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。
由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________________________。
解析:
玻璃的成分中含有SiO2,能与NaOH溶液反应生成粘性很强的Na2SiO3而发生粘连,反应方程式为SiO2+2NaOH===Na2SiO3+H2O。
由于钙长石和钠长石中氧原子的物质的量分数相同,钠长石中钠与铝的原子个数比为1∶1,扩2倍后可知钙长石中钙和铝的原子个数比为1∶2。
钠长石中氧原子的物质的量分数为
,则钙长石用氧化物的形式表示为CaO·Al2O3·nSiO2,因此:
1+3+2n=8,n=2,钙长石的化学式为CaO·Al2O3·2SiO2,即为CaAl2Si2O8。
答案:
SiO2+2NaOH===Na2SiO3+H2O CaAl2Si2O8
4.(2016·洛阳模拟)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。
(1)三硅酸镁的氧化物形式为_______________________________________________。
(2)Al2O3、MgO和SiO2都可以制耐火材料,其原因是________。
a.Al2O3、MgO和SiO2都是白色固体
b.Al2O3、MgO和SiO2都是金属氧化物
c.Al2O3、MgO和SiO2都有很高的熔点
解析:
(1)Mg2Si3O8·nH2O改写成氧化物的形式为2MgO·3SiO2·nH2O。
(2)Al2O3、MgO和SiO2均具有很高的熔点,故可作为耐火材料。
答案:
(1)2MgO·3SiO2·nH2O
(2)c
[探规寻律]
硅酸盐改写成氧化物形式的方法
(1)氧化物的书写顺序:
活泼金属氧化物―→较活泼金属氧化物―→二氧化硅―→水。
(2)氧化物前系数的配置原则:
除氧元素外,其他元素按配置前后原子个数守恒原则配置系数,且不同氧化物间以“·”隔开。
(3)当系数配置出现分数时应化为整数。
如正长石:
KAlSi3O8不能写成
K2O·
Al2O3·3SiO2,应写成K2O·Al2O3·6SiO2。
以“高纯硅的制备”为载体串联硅元素单质及其化合物知识
高考载体[2014·天津高考T7(4)]
晶体硅(熔点1410℃)是良好的半导体材料。
由粗硅制纯硅的过程如下:
Si(粗)
SiCl4
SiCl4(纯)
Si(纯)
[知识串联设计]
(1)工业上用焦炭与石英砂在高温下反应制取粗硅,其反应的化学方程式为________________________________________________________________________。
上述反应中的氧化剂是________,还原剂是________。
(2)用焦炭和石英砂制取粗硅为什么要隔绝空气进行?
________________________________________________________________________。
(3)粗硅与Cl2加热到460℃时发生反应,写出该反应的化学方程式:
_________________。
(4)在1100℃时,SiCl4被H2还原的化学方程式为_____________________________
________________________________________________________________________。
(5)如何通过实验除去SiO2中混有少量的CaCO3杂质?
___________________。
(6)石英既能与NaOH溶液反应,又能与氢氟酸反应,它是两性氧化物吗?
________。
试分别写出它与NaOH溶液、氢氟酸发生反应的化学方程式:
________________________
________________________________________________________________________。
(7)中学化学中能与NaOH溶液反应生成H2的单质有哪些?
________。
试分别写出反应的化学方程式_______________________________________________________________
________________________________________________________________________。
(8)陶瓷、水泥、玻璃是常用的硅酸盐材料,其中,生产普通玻璃的主要原料是什么?
________________________________________________________________________。
答案:
(1)SiO2+2C
Si+2CO↑ SiO2 C
(2)焦炭能与空气中的氧气发生反应
(3)Si+2Cl2
SiCl4
(4)2H2+SiCl4
Si+4HCl
(5)加入盐酸后过滤
(6)不是 SiO2+2NaOH===Na2SiO3+H2O、
SiO2+4HF===SiF4↑+2H2O
(7)Al和Si 2Al+2NaOH+2H2O===2NaAlO2+3H2↑、
Si+2NaOH+H2O===Na2SiO3+2H2↑
(8)石英砂、纯碱和石灰石
1.硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。
在无机非金属材料中,硅一直扮演着主角。
下面几种物质中含有硅单质的是( )
解析:
选C 玛瑙、光导纤维和水晶的主要成分是SiO2,硅单质可用来制造太阳能电池板。
2.(2016·南昌二模)C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及化合物的说法中正确的是( )
A.三种元素在自然界中既有游离态又有化合态
B.二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应
C.最低价的气态氢化物都具有还原性,易与O2发生反应
D.其最高价氧化物对应水化物的酸性强弱:
H2SO4>H2SiO3>H2CO3
解析:
选C 硅是亲氧元素,硅元素在自然界中以硅酸盐、二氧化硅的形式存在,故A错误;二氧化硅属于酸性氧化物,能与氢氟酸反应,故B错误;最低价的气态氢化物化合价能升高,具有还原性,故C正确;碳酸酸性大于硅酸,酸性:
H2SO4>H2CO3>H2SiO3,故D错误。
3.(2016·宿州模拟)下列叙述中正确的是( )
A.因为Na2CO3+SiO2
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水反应生成硅酸
解析:
选D A项的反应之所以能够发生,是因为生成的产物中有气体生成,平衡正向移动,促使反应能够顺利进行,故不能通过此反应判断H2CO3与H2SiO3的酸性强弱,A错误;CO2和SiO2的物理性质差异较大,B错误;SiO2与氢氟酸的反应不属于酸性氧化物与一般酸的反应,在此反应中SiO2并没有表现出碱性氧化物的性质,C错误。
4.(2016·济南联考)下列离子方程式的书写正确的是( )
A.水玻璃中通入过量二氧化碳:
Na2SiO3+CO2+H2O===2Na++CO
+H2SiO3
B.澄清石灰水中通入过量二氧化碳:
Ca(OH)2+2CO2===Ca2++2HCO
C.硅与氢氟酸的反应:
Si+4H++4F-===SiF4↑+2H2↑
D.二氧化硅溶于烧碱溶液中:
SiO2+2OH-===SiO
+H2O
解析:
选D Na2SiO3是强电解质,应拆成Na+、SiO
,且应生成HCO
,A错;B项正确写法是CO2+OH-===HCO
;C项,氢氟酸是弱酸,不能拆分成H+和F-。
5.青石棉(crocidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。
青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉是一种硅酸盐产品
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为
Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1mol青石棉能使1molHNO3被还原
解析:
选B 硅酸盐指的是硅、氧与其他化学元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称,故青石棉是一种硅酸盐产品;青石棉是一种纯净物,不可能含有一定量的石英晶体;1molNa2O·3FeO·Fe2O3·8SiO2·H2O跟足量硝酸反应时,失去3mol电子,而还原产物只有NO,故能使1molHNO3被还原。
6.下列关于工业生产的说法中,不正确的是( )
A.工业上,用焦炭在电炉中还原