氧族元素专题.docx
《氧族元素专题.docx》由会员分享,可在线阅读,更多相关《氧族元素专题.docx(26页珍藏版)》请在冰豆网上搜索。
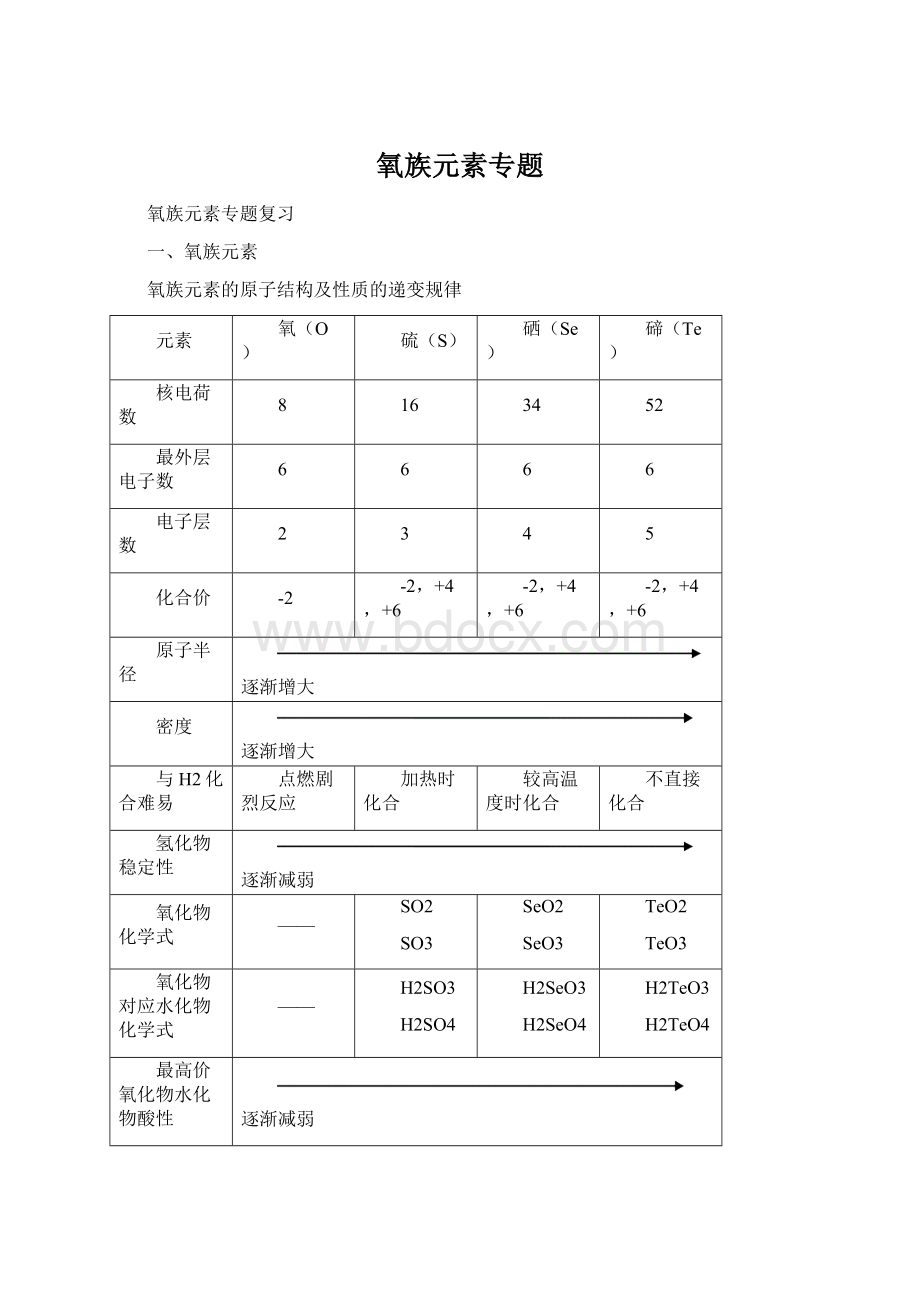
氧族元素专题
氧族元素专题复习
一、氧族元素
氧族元素的原子结构及性质的递变规律
元素
氧(O)
硫(S)
硒(Se)
碲(Te)
核电荷数
8
16
34
52
最外层电子数
6
6
6
6
电子层数
2
3
4
5
化合价
-2
-2,+4,+6
-2,+4,+6
-2,+4,+6
原子半径
逐渐增大
密度
逐渐增大
与H2化合难易
点燃剧烈反应
加热时化合
较高温度时化合
不直接化合
氢化物稳定性
逐渐减弱
氧化物化学式
——
SO2
SO3
SeO2
SeO3
TeO2
TeO3
氧化物对应水化物化学式
——
H2SO3
H2SO4
H2SeO3
H2SeO4
H2TeO3
H2TeO4
最高价氧化物水化物酸性
逐渐减弱
元素非金属性
逐渐减弱
练习1、含有硒(Se)的保键品已进入市场,已知该元素与氧具有相同的最外层电子数。
则下列关于硒的叙述中不正确的是()
A.最高价氧化物的化学式为SeO3
B.单质Se是一种半导体材料
C.原子半径比硫大,比溴小
D.单质的氧化性比氯气弱,比溴强,比O3弱
解析:
本题解题的关键在于搞清楚Se与O、S、Cl、Br等元素在元素周期表中的相对位置关系及Se单质和臭氧的特殊性质。
如Se可作为半导体材料,臭氧是很强的氧化剂等。
另外元素周期律的知识是判断选项正误的钥匙。
Se位于元素周期表的第ⅥA族,最外层为6个电子,故最高价为+6价,最低价为-2价,因此最高价氧化物的形式为SeO3。
再由于Se原子半径较S原子的大,故体现部分金属性质。
硒可作为半导体材料。
因此选项A、B都正确。
根据O、S、Cl、Br与Se在元素周期表中的相对位置关系,运用元素周期律的知识不难判断出原子半径大小关系为:
Se>S、Se>Br;单质的氧化性的关系为O3>O2>S>Se、Cl2>Br2>Se,因此可判断C、D两选项中的部分判断存在错误。
二、同素异形体
1.概念:
同一元素形成的几种性质不同的单质,叫做该元素的同素异形体。
2.注意:
①同一元素②单质③性质不同
3.与同位素的区别:
同位素研究的对象是“原子”
判断下列的各组物质是同素异形体的是:
O2和O3,H2和D2,H2和O2,H2O和H2O2,H和D。
三、臭氧
1.物理性质
常温常压下,有特殊臭味的淡蓝色气体,密度比氧气的大,比氧气易溶于水。
液态呈深蓝色,固态呈紫黑色。
注意与氧气加以区别。
2.化学性质
①不稳定性
2O3=3O2
常温下缓慢分解,高温或有催化剂时可以迅速分解(氟氯烃、氮氧化物、碳氧化物均有催化作用,具体反应见课本)。
②极强的氧化性
(1)Ag、Hg等在空气中或氧气中不易被氧化的金属,可以与臭氧发生反应。
2Ag+2O3=Ag2O2+2O2PbS+2O3=PbSO4+O2
(2)臭氧可以使淀粉碘化钾试纸变蓝,放出氧气
它还能氧化色素,所以它能作漂白剂。
与之相似的有:
四、过氧化氢(H2O2)
1.物理性质
无色粘稠的液体,其水溶液俗称双氧水。
2.化学性质
①弱酸性
过氧化氢具有漂白性,其原理为过氧化氢具有一定的氧化性
②氧化性
(1)可以使淀粉碘化钾试纸变蓝
(2)发黑的油画可以利用过氧化氢复原,其原理为:
PbS(黑色)+4H2O2=PbSO4(白色)+4H2O
(3)过氧化氢可以将亚硫酸钠氧化成硫酸钠
(4)过氧化氢还可以将硫化氢氧化成黄色的硫
遇到更强的氧化剂时,则表现出还原性
③还原性
(1)氯气可以氧化双氧水
(2)在酸性条件下,高锰酸钾可以氧化过氧化氢,生成氧气。
④不稳定性
过氧化氢不稳定,在加热或者剧烈振荡的情况下会快速分解。
2H2O2=2H2O+O2↑(氧化性:
H2O2>O2)
(3)保存
保存在棕色瓶中置于阴凉处。
(4)用途
氧化剂、漂白剂、消毒剂、脱氯剂、火箭燃料、生产过氧化物,在医疗上用稀双氧水作为杀菌消毒剂,工业上用10%的双氧水漂白毛、丝以及羽毛等。
练习1、针对以下A~D四个涉及H2O2的反应(未配平),填写空白。
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2
H2O+O2
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)。
(3)H2O2体现弱酸性的反应是(填代号),其理由为。
解析:
反应A是一个非氧化还原反应。
盐酸是为人熟知的强酸,它与Na2O2反应除了生成盐以外还得到H2O2,按照“强酸可置换弱酸”的规律,在此反应中H2O2表现出弱酸的性质。
反应B中Ag2O变成单质银,可见H2O2当是一种还原剂,其中的氧元素应合理地认为转化成为氧气。
至于生成物中的水,其氧元素可认为从氧化银而来。
过氧化氢的分解反应C,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性。
练习2.过氧化氢的沸点比水高,但受热容易分解。
某试剂厂先制得7%~8%的过氧化氢溶液,再浓缩成30%溶液时,可采用的适宜方法是
A.常压蒸馏B.减压蒸馏C.加生石灰常压蒸馏D.加压蒸馏
五、硫
1.物理性质
硫通常情况下是一种淡黄色的固体,俗名硫黄,不溶于水,易溶于CS2(常用此性质用CS2来洗涤附有硫的试管)。
2.化学性质
由硫所处的化合价可知,硫既有氧化性又有还原性。
①氧化性
(1)类似于氧气和氯气,硫在一定条件下可以与氢气发生反应,生成硫化氢:
H2+S=H2S
(2)在一定条件下,硫还可以与钠、铁、铜、银等金属发生反应
Fe+S=FeS(注意,只能生成硫化亚铁)
2Cu+S=Cu2S(注意,生成的是硫化亚铜)
2Ag+S=Ag2S
(3)地上掉落的汞珠通常用硫粉来处理,生成硫化汞
②还原性
(1)硫能在氧气中燃烧,只能生成二氧化硫。
S+O2=SO2(只能生成二氧化硫)
(2浓硫酸、浓硝酸等强氧化性酸可以氧化硫单质
S+6HNO3=H2SO4+6NO2↑+2H2O
(3)S与氧气反应
在空气中现象:
淡蓝色火焰,放热,产生刺激性气味气体。
在纯氧中现象:
蓝紫色火焰,放热,产生刺激性气味气体。
(4)点燃黑火药的化学方程式S+2KNO3+3CK2S+N2↑+3CO2↑
(5)和热的氢氧化钠溶液反应:
3S+6NaOH=2Na2S+Na2SO3+3H2O
试管壁上粘有硫可用CS2清洗或热NaOH清洗。
③既体现氧化性又体现还原性
硫与强碱如氢氧化钠等发生歧化反应,生成对应的硫化物与亚硫酸盐
练习1、已知硫和氧同族,性质相似,请用化学方程式解释下列实验现象:
(1)CS2和Na2S水溶液一起振荡,水溶液由无色变有色。
(2)P2S5溶于K2S水溶液中。
(3)Na2S2溶液中加稀HCl产生浅黄色沉淀。
六、硫化氢
1.物理性质
无色、有臭鸡蛋气味的气体。
有剧毒,密度比空气大,能溶于水,常温常压下1∶2.6
2.化学性质
①不稳定性
硫化氢不稳定,易分解。
H2SH2+S
②可燃性
硫化氢可以在氧气中燃烧,其燃烧产物于氧气的量有关系。
氧气不足:
2H2S+O2(不足)=2S+2H2O
氧气足量:
2H2S+3O2(足量)=2SO2+2H2O
注意:
当硫化氢与氧气的物质的量之比不同时,硫化氢被氧化所得产物不相同。
有关此处的计算相关例题。
③还原性
在硫化氢中硫处于最低价,所以它具有还原性。
其还原性顺序为:
S2->I->Fe2+>Br->Cl-
硫化氢的燃烧也体现了它的还原性。
(1)卤素单质可以将硫氧化
H2S+X2=2HX+S
(2)二氧化硫也可以氧化硫化氢为硫单质
(3)浓H2SO4、浓HNO3、Fe3+等也能将它氧化。
H2S+Fe3+
3.硫化氢的水溶液—氢硫酸
(1)物理性质
氢硫酸易挥发,应密封保存。
(2)化学性质
①具有酸的通性
使指示剂变色,与金属反应,与碱反应(与一元碱反应时能生成酸式盐和正盐两种,说明它是二元酸),与盐的反应。
1)氢硫酸能与硫酸铜反应生成黑色的硫化铜沉淀
H2S+CuSO4=CuS↓+H2SO4H2S+2AgNO3=Ag2S↓+2HNO3
2)氢硫酸也能与硫化钠反应生成硫氢化钠
H2S+Na2S=2NaHS(说明它是二元酸)
3)氢硫酸为弱酸,可以与盐酸反应生成硫化氢
2HCl+Na2S=2NaCl+H2S↑
②氧化性(与金属的反应,由H+体现)
氢硫酸可以与金属钠等反应,放出氢气。
③还原性
凡能与硫化氢气体反应的都能与氢硫酸发生氧化还原反应。
注意:
氢硫酸露置一空气中时在它的表面会形成一层不溶于水的薄膜,所以氢硫酸需要新制。
七、二氧化硫
1.物理性质
是一种无色、有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水1∶40。
易液化的气体有:
Cl2、NH3、SO2(可用于进行喷泉实验)
2.化学性质
①酸性氧化物
具有酸性氧化物的通性
(1)二氧化硫溶于水能生成亚硫酸
SO2+H2O
H2SO3(能使紫色石蕊试液变红)
二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。
(3)二氧化硫能与碱如氢氧化钠反应:
(4)二氧化硫还可以与碱性氧化物反应:
SO2+Na2O=Na2SO3
如钙基固硫:
SO2+CaO===CaSO3
(5)CO2与SO2性质的比较
名称
CO2
SO2
与水反应
CO2+H2O=H2CO3
SO2+H2O=H2SO3
与碱反应
CO2+NaOH=NaHCO3
CO2+2NaOH=Na2CO3+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
SO2+NaOH=NaHSO3
SO2+2NaOH=Na2SO3+H2O
SO2+Ca(OH)2=CaSO3↓+H2O
与盐反应
CO2+CaCO3+H2O=Ca(HCO3)2
SO2+CaSO3+H2O=Ca(HSO3)2
(6)SO2与CO2的相互鉴别
鉴别SO2气体的常用方法:
用品红溶液,看能否使其褪色,有时还需再加热看能否再复原。
鉴别CO2气体的常用方法:
用澄清石灰水,看能否使其变浑浊,足量时再变澄清。
注意:
(1)当混有CO2时,不会影响SO2的鉴别;
(2)当混有SO2时会干扰CO2的鉴别,应先除去SO2后再用澄清石灰水鉴别CO2气体。
(3)除去CO2中的SO2,常用方法是使混合气体先通过足量溴水或酸性KMnO4溶液或饱和NaHCO3溶液(吸收SO2),再通过品红溶液(检验SO2是否被除尽)。
②二氧化硫有氧化性
SO2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现:
③二氧化硫有还原性
二氧化硫能被许多氧化剂氧化,如:
O2、KMnO4、HNO3、Fe3+、X2等
SO2+Br2+2H2O===H2SO4+2HBr
5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4
二氧化硫与浓硝酸反应:
二氧化硫与三价铁离子反应:
④二氧化硫有漂白性
漂白原理:
与有色物质结合成不稳定的无色化合物。
加热后,不稳定物质要分解,又恢复成原来的颜色。
它的漂白原理与前面的新制氯水、过氧化钠、过氧化氢等的漂白不同:
名称
氯水
二氧化硫
原理
氯水中的HClO将有色
物质氧化成无色物质
SO2溶于水产生的H2SO3与有色
物质结合生成不稳定无色物质
实质
氧化还原反应
非氧化还原反应
效果
永久性
暂时性
范围
可漂白大多数有色物质,能使紫色石蕊试液褪色
漂白某些有色物质,不能使紫色石蕊试液褪色
问题1.把Cl2和SO2混合用于漂白,能否增强漂白效果?
为什么?
练习1、高温下硫酸亚铁发生如下反应:
2FeSO4
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
A.BaSO3和BaSO4B.BaS
C.BaSO3D.BaSO4
练习2、某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是溶液;加热时溶液由红色逐渐变浅的原因是。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是溶液;加热时溶液由无色变为红色的原因是。
解析:
本题考查学生由实验现象判断实验原理的直觉和逆向思维能力。
首先要审清实验的装置为一封闭体系,受热时,有气体从溶液中逸出进入气球,导致溶液的颜色的变化;冷却后,逸出的气体又溶解在溶液中,得到原来溶液,恢复到原来溶液的颜色。
在中学阶段,因为气体的溶入和逸出而导致溶液颜色互变的最常见的是SO2与品红溶液之间以及NH3与酚酞溶液之间,然后根据题中现象进行分析、验证并解答即可。
⑤有效氯
从碘化钾KI中氧化出相同量的单质碘I2所需单质氯Cl2的质量与指定化合物的质量之比,常以百分数表示。
有效氯是根据它同盐酸作用时产生的氯气的量来计算的。
反应的化学方程式是:
Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O
Cl2+2KI=2KCl+I2
2Na2S2O3+I2=Na2S4O6+2NaI
反应生成的碘用硫代硫酸钠(Na2S2O3)溶液来滴定,就可以算出有多少氯气产生。
有效氯的质量分数是表示漂白粉的氧化能力(漂白作用主要是由氧化反应引起的)的,工业品漂白粉一般含有效氯25%左右,化学品可达到30%以上。
(7)二氧化硫的制法
1.工业制法
A.硫磺燃烧法S+O2
SO2
b.煅烧硫铁矿法4FeS2+11O2
2Fe2O3+8SO2
2.实验室制法
Na2SO3(s)+H2SO4(浓)===Na2SO4+SO2↑+H2O
实验中常使用溶质的质量分数为60%左右的硫酸,也可用浓硫酸。
不能用很稀的硫酸,因为SO2在水中的溶解度较大,常温常压下1体积水能溶解40体积的SO2
(8)二氧化硫的污染
1、pH小于5.6的雨水,称之为酸雨。
2、一般认为,酸雨是由于人为排放的SO2和氮氧化物等酸性气体进入大气,当这些气体达到一定浓度后,在水凝结过程中溶于水形成硫酸和硝酸,使雨水酸性变大,pH变小。
其转化可简单表示如下:
2SO2+2H2O+O2
2H2SO4NOx
HNO3
3、酸雨的危害
(1)对人体健康造成危害。
(2)破坏森林、草原和农作物。
(3)使土壤酸性增强、湖泊酸化、生态环境受损。
(4)破坏建筑物。
(6)三氧化硫
二氧化硫在一定条件下可以氧化成三氧化硫:
2SO2+O22SO3
SO3一种无色固体,具有酸性氧化物的通性,熔点为16.80C,沸点也只有44.8℃,易溶于水,溶于水时放出大量的热。
能溶于浓硫酸中。
SO3+H2O===H2SO4(用于工业制硫酸)
八、硫酸
一、稀硫酸的性质
H2SO4=2H+SO42-稀硫酸具有酸的通性。
利用硫酸的强酸性制备多种物质:
(1)制气体
制氢气Zn+H2SO4→ZnSO4+H2↑;
制H2S:
FeS+H2SO4→H2S↑+FeSO4
(2)制较弱的酸
制H3PO4:
Ca3(PO4)2+3H2SO4(浓)
2H3PO4+2CaSO4
制CH3COOH:
2CH3COONa+H2SO42CH3COOH+Na2SO4
(3)制化肥
Ca3(PO4)2+2H2SO4(浓)Ca(H2PO4)2+2CaSO42NH3+H2SO4=(NH4)2SO4
(4)制硫酸盐
制胆矾:
CuO+H2SO4+4H2O→CaSO4·5H2O(晶体)
制绿矾:
Fe+H2SO4→FeSO4+H2↑
利用H2SO4高沸点性制取易挥发性酸:
(1)制HF:
(铅皿中)
(2)制HCl:
(3)制HNO3:
NaNO3+H2SO4(浓)HNO3↑+NaHSO4
利用硫酸的稳定性制不稳定性酸:
Na2SO3+H2SO4→Na2SO4+H2O+SO2↑
九、浓硫酸
1.物理性质
纯硫酸是一种无色粘稠的油状液体(可用此鉴别浓硫酸和稀硫酸)。
常用浓硫酸的质量分数为98.3%的浓硫酸的沸点为338℃,其密度为1.84g/cm3,其物质的量浓度为18.4mol/L。
它的浓度越大,溶液的密度越大。
练习1.质量分数为90%的硫酸溶液与10%的硫酸溶液等体积混合后,溶液中溶质的质量分数()
A.大于50%B.小于50%C.等于50%D.不能作出估计
2.化学性质
(1)吸水性
利用浓H2SO4的吸水性做干燥剂。
注意:
可以干燥:
O2、H2、Cl2、N2、CO、CO2、SO2
不可以不干燥:
碱性:
NH3
还原性气体不能干燥:
H2S、HI、HBr
用H2SO4作催化剂:
CH2CH2+H2OCH3CH2OH(乙烯水化)
(2)脱水性
吸水性与脱水性的区别:
吸水性是指吸收物质中本来就有的湿存水或水蒸气,而脱水是指将化合物(主要是指有机化合物)中的氢、氧两种元素按原子个数比为2﹕1脱去。
利用浓H2SO4的脱水性:
(1)制C2H4:
CH3CH2OHCH2CH2↑+H2O
(2)制CO:
HCOOHCO↑+H2O
(3)强氧化性
氧化性酸与酸的氧化性的区别
(1)酸根部分易得电子——有氧化性——氧化性酸
(2)酸的氧化性应包括H+的氧化性(酸所共有的)与酸根的氧化性(氧化性酸的特点)两种类型
A.与金属的反应
浓硫酸可以氧化金属铜等,生成二氧化硫:
2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O
练习2.向50mL18mol/LH2SO4溶液中加入适量的铜片并加热。
充分反应后,被还原的H2SO4的物质的量是()
A.小于0.45molB.等于0.45molC.在0.45~0.90mol之间D.大于0.45mol
B.钝化
由于浓硫酸有强氧化性,在常温下,可使某些金属如Fe、Al等表面因氧化生成一层致密的氧化膜,阻止内部金属继续与浓硫酸反应,这种现象称为钝化。
C.与非金属反应
(1)木炭、硫、磷等非金属在加热条件下能与浓硫酸反应。
C+2H2SO4=(体现了浓硫酸的性)
S+2H2SO4=3SO2↑+2H2O
(2)硫可以将磷单质氧化成磷酸
(3)浓硫酸还能与一些具有还原性的化合物发生氧化还反应
H2S+H2SO4=S↓+SO2↑+2H2O
2HBr+H2SO4=Br2+SO2↑+2H2O
3.检验SO42-的方法
①
现象(产生白色沉淀)
现象(沉淀不消失)
结论:
可能含有
、
、
。
②
现象(产生白色沉淀)
现象(沉淀不消失)
结论:
可能含
、
。
③
现象(产生白色沉淀)
现象(沉淀不消失)
结论:
可能含
、
。
④
现象(产生白色沉淀)
现象(沉淀不消失)
结论:
可能含
、
、
、
。
小结:
在实验室中,常常先用盐酸把溶液酸化,以排除Ag+、CO32-、SO32-、PO43-等离子的干扰,再加入BaCl2溶液,如有白色沉淀出现,则说明原溶液中一定有SO42-存在。
问题1、为什么不用硝酸酸化?
练习3.在某溶液中先滴加稀硝酸,再滴加氯化钡溶液,有白色沉淀产生,该溶液()
A.一定含有SO42-B.一定含有Ag+C.一定含有SO32-
D.一定含有Ag+或SO42-E。
可能含有SO42-或Ag+或SO32-
D.硫酸与浓硫酸的比较
浓H2SO4
稀H2SO4
1
主要以H2SO4分子形式存在
以H+、SO42-形式存在
2
强氧化性(S)与Cu、C加热反应
弱氧化性(H+)与Cu、C不反应
3
有吸水性,脱水性
无
4
使Al、Fe钝化(常温)
使Al、Fe溶解
5
与金属反应,还原为SO2
与H前金属反应还原为H2
十、硫酸盐
1.酸式盐NaHSO4、KHSO4的水溶液显酸性,因为:
所以,有强酸作用。
2.正盐
硫酸盐
结晶水合物的俗名
主要用途
CaSO4
CaSO42H2O生石膏
2CaSO4H2O熟石膏
制粉笔、模型、塑像等
Na2SO4
Na2SO410H2O芒硝
制玻璃、造纸工业
ZnSO4
ZnSO47H2O皓矾
收敛剂、防腐剂、颜料
BaSO4
重晶石
医疗上用作“钡餐”
FeSO4
FeSO47H2O绿矾
补血剂、制蓝黑墨水
CuSO4
CuSO45H2O蓝矾、胆矾
制农药、镀铜液
KAlSO4
KAlSO412H2O明矾
净水剂
Na2S2O3
Na2S2O35H2O海波
显影剂
(1)亚硫酸盐
亚硫酸盐具有氧化性和还原性、其盐的溶解性与硫酸盐近似。
①氧化性
亚硫酸盐能够与硫化氢反应生成硫:
②还原性
亚硫酸能被浓硝酸、三价铁离子和空气中的氧等氧化剂氧化
亚硫酸盐在空气中长期放置变质:
2SO32-+O2==2SO42-
③SO32-、S2-检验(加稀盐酸或稀H2SO4产生SO2、H2S)离子方程式为:
SO32-+2H+===H2O+SO2↑S2-+H2+===H2S↑
弱酸根离子一般应用强酸(HCl、H2SO4)检验。
练习1、写出Na2SO3与HCl、O2、SO2、BaCl2反应的离子方程式:
(2)硫代硫酸钠
名称:
硫代硫酸钠,大苏打,海波。
化学式:
Na2S2O3式量:
158.11沸点:
100℃熔点:
48℃
1.物理性质
无色透明的晶体,易溶于水,水溶液显弱碱性。
33℃以上的干燥空气中风化而失去结晶水。
2.化学性质
(1)在中性、碱性溶液中较稳定,在酸性溶液中会迅速分解。
Na2S2O3+2HCl=2NaCl+H2O+S↓+SO2↑
(2)具有很强的络合能力,能跟溴化银形成络合物。
AgBr+2Na2S2O3→Na3[Ag(S2O3)2]+NaBr
根据这一性质,它可以作定影剂。
洗相时,过量的大苏打跟底片上未感光部分的溴化银反应,转化为可溶的Na3[Ag(S2O3)2],把AgBr除掉,使显影部分固定下来。
(3)具有较强的还原性,能将氯气等物质还原。
Na2S2O3+4Cl2+5H2O=H2SO4+2NaCl+6HCl
所以,它可以作为绵织物漂白后的脱氯剂。
类似的道理,织物上的碘渍也可用它除去
(4)硫代硫酸钠的制取(了解)
①将纯碱溶解后,与二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2=Na2